Содержание
- 2. Солі є крихкими кристалічними речовинами. Вони, як правило, мають високі температури плавлення та різну розчинність у
- 3. Такі реакції перебігають у водних розчинах, тому для них не можна використовувати метали, які за звичайних
- 4. 2. Взаємодія солі з кислотою з утворенням іншої солі та іншої кислоти: K2CO3 + H2SO4 =
- 5. 3. Взаємодія розчинів солей з лугами з утворенням іншої основи та іншої солі: ZnCl2 + 2NaOH
- 6. Загальні способи добування солей. Поширення солей у природі та їх практичне значення
- 7. Розглянемо загальні способи добування солей. 1. Взаємодія металів з неметалами: 2Na + S = Na2S 2.
- 9. Скачать презентацию






 Роль химии в жизни человека
Роль химии в жизни человека Чистые вещества и смеси
Чистые вещества и смеси Изучение фотокатализа в химии
Изучение фотокатализа в химии Сероводород, Сульфиды. Оксид серы (IV). Сернистая кислота
Сероводород, Сульфиды. Оксид серы (IV). Сернистая кислота Поверхностные явления
Поверхностные явления Пены. Свойства пен
Пены. Свойства пен Дизельное топливо
Дизельное топливо Репликация ДНК. Элонгация репликации ДНК. (Лекция 4)
Репликация ДНК. Элонгация репликации ДНК. (Лекция 4) Общая характеристика твердого, жидкого и газообразного видов топлива
Общая характеристика твердого, жидкого и газообразного видов топлива Устойчивость и коагуляция золей
Устойчивость и коагуляция золей Пищевые кислоты
Пищевые кислоты Общая фармакология
Общая фармакология Многоатомные спирты
Многоатомные спирты Аминокислоты «Единственный путь, ведущий к знанию – это деятельность» Б. Шоу
Аминокислоты «Единственный путь, ведущий к знанию – это деятельность» Б. Шоу Горные породы: гранит, базальт
Горные породы: гранит, базальт Titration and Acid-Base Neutralization
Titration and Acid-Base Neutralization Титан (лат. Titanium; обозначается символом Ti)
Титан (лат. Titanium; обозначается символом Ti) Марганец и его свойства
Марганец и его свойства Силикатная промышленность и её направления
Силикатная промышленность и её направления  Состав тонких покрытий
Состав тонких покрытий Атомно-кристаллическое строение материалов
Атомно-кристаллическое строение материалов Материаловедение и технологии конструкционных материалов
Материаловедение и технологии конструкционных материалов Характеристика элементов VIII-Б группы. Семейство железа
Характеристика элементов VIII-Б группы. Семейство железа Валентність
Валентність  Виды присадок к моторным топливам. Керосин
Виды присадок к моторным топливам. Керосин Презентация по Химии "Кухня - маленька хімічна лабораторія" - скачать смотреть бесплатно
Презентация по Химии "Кухня - маленька хімічна лабораторія" - скачать смотреть бесплатно Молочні продукти
Молочні продукти 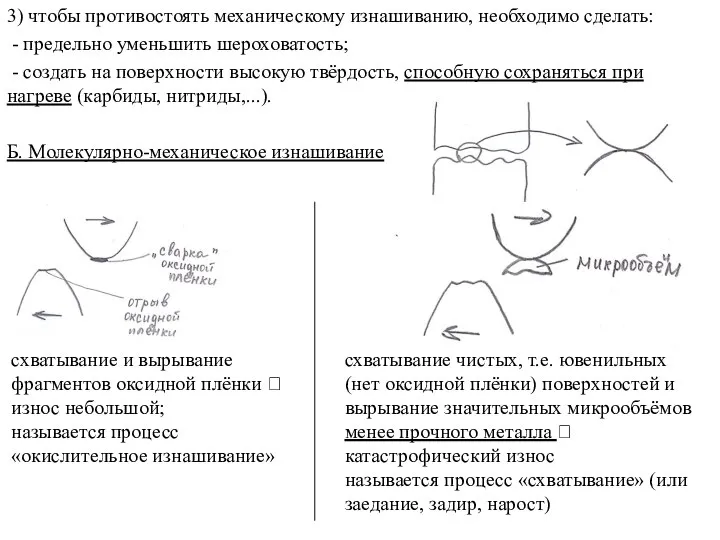 Молекулярно-механическое изнашивание
Молекулярно-механическое изнашивание