Содержание
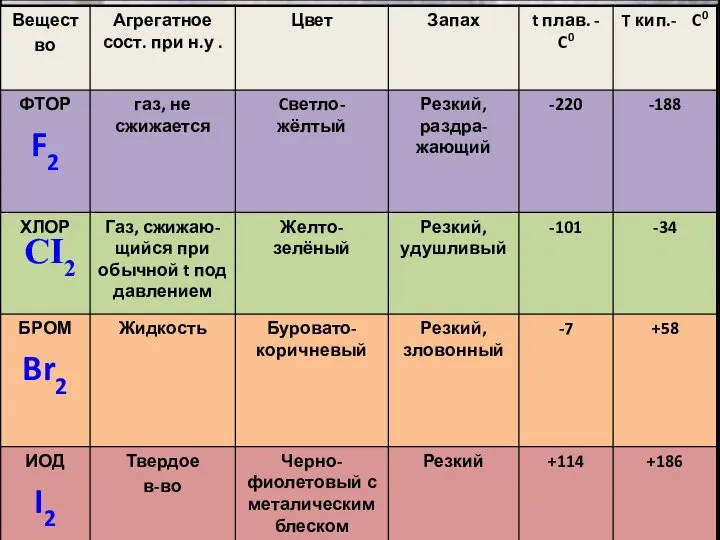
- 2. Общая характеристика галогенов Галогены – это естественная группа элементов, расположенных в главной подгруппе 7 группы. Фтор
- 3. +9 +53 +35 +17 Неметаллические-окислительные свойства ослабевают, металлические -восстановительные усиливаются !!! 2 7 2 8 7
- 4. F 1S22S22P5 S P CI 1S22S22P63S23P5 Br I …4S24P5 …5S25P5 Электронные формулы Вывод: галогены - р
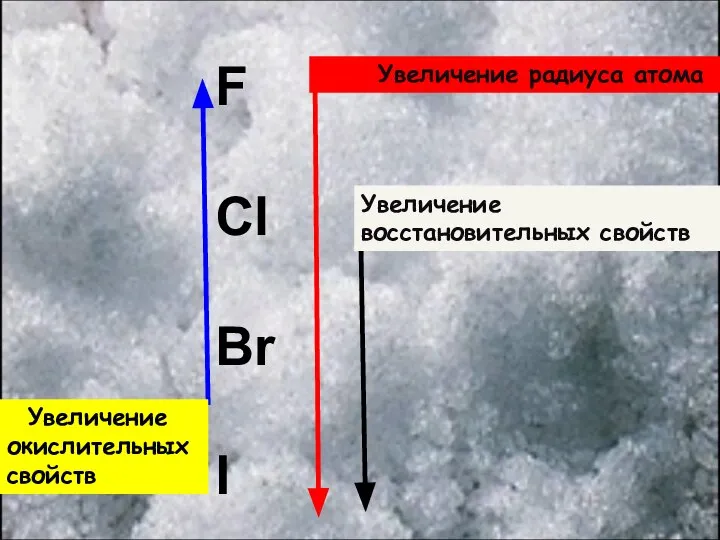
- 5. Увеличение восстановительных свойств Увеличение окислительных свойств Увеличение радиуса атома F Cl Br I
- 6. -1 +7 -1 +3 -1 +5 -1 +1 0 Определите степени окисления атомов галогенов в веществах
- 7. CI2 Br2 I2 F2 Простые вещества
- 8. :Г + Г: → :Г(:) Г: .. .. .. .. .. .. .. .. . .
- 9. CI2
- 10. 1.Взаимодействие с металлами Химические свойства галогенов 2 Na0 + CI20 = 2 NaCI +1 -1 CI20
- 11. Cu0 + I20 = Cu I2 2Fe0 + 3Br 20= 2FeBr 3 +2 -1 +3 -1
- 12. 2.Взаимодействие с водородом Н20 + Г20 = 2Н Г +1 -1 Н20 + CI20 = 2Н
- 13. 3.Взаимодействие с водой CI2 + H2O = HCI + HCIO Хлорноватистая кислота Соляная кислота 2F2 +
- 14. 4.Взаимодействие с растворами солей галогенов: CI2 F2 Br2 I2 CI2 + 2NaBr = 2 NaCl +
- 15. Получение В лаборатории* МnO2 + 4HCI = MnCI2 + CI2 + 2H2O +4 -1 +2 0
- 16. В промышленности Получают электролизом расплавов или растворов их солей. 2NaCl электролиз 2Na+Cl2 Расплав
- 17. Дезинфицирующие реагенты на основе хлора Применение галогенов
- 19. Скачать презентацию







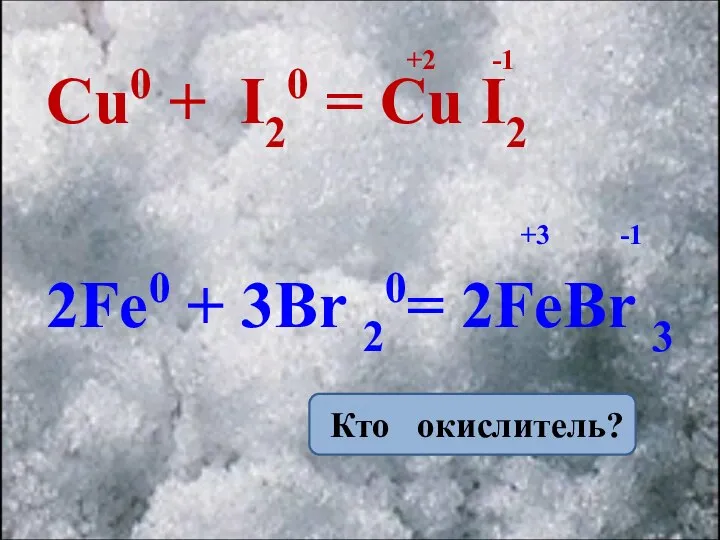





 Воздух, которым мы дышим
Воздух, которым мы дышим Гидролиз солей
Гидролиз солей Математический аппарат квантовой механики
Математический аппарат квантовой механики Гомо- и гетерополисахариды
Гомо- и гетерополисахариды Legaturi chimice
Legaturi chimice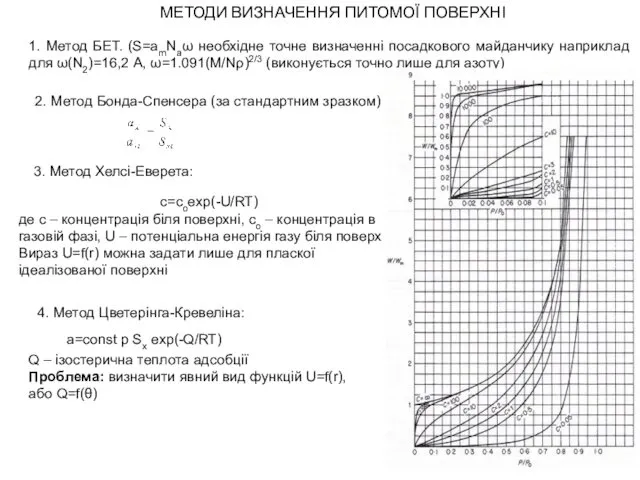 Методи визначення питомої поверхні
Методи визначення питомої поверхні Общие свойства металлов
Общие свойства металлов Термодинамика химического равновесия
Термодинамика химического равновесия Жидкостная хроматография Waters Breeze
Жидкостная хроматография Waters Breeze Добування кисню та вивчення його властивостей
Добування кисню та вивчення його властивостей Взаимодействие металлов с растворами кислот
Взаимодействие металлов с растворами кислот Основні принципи мас-спектрометрії
Основні принципи мас-спектрометрії Поделочные или полудрагоценные камни
Поделочные или полудрагоценные камни Понятие о валентности и химической связи. Ковалентная химическая связь.(Учитель химии и биологии Алексеева А.К. МОУ «Рунгинская СО
Понятие о валентности и химической связи. Ковалентная химическая связь.(Учитель химии и биологии Алексеева А.К. МОУ «Рунгинская СО Урок по химии Тема: Соединения элементов с кислородом
Урок по химии Тема: Соединения элементов с кислородом  Гетерогенные и лигандообменные равновесия и процессы
Гетерогенные и лигандообменные равновесия и процессы Теория химического строения органических соединений А.М. Бутлерова (ТХС)
Теория химического строения органических соединений А.М. Бутлерова (ТХС) Процессы минералообразования
Процессы минералообразования Липиды (жиры)
Липиды (жиры) Химия элементов VIA группы. Сера
Химия элементов VIA группы. Сера Модуль Химия на кухне. Белок
Модуль Химия на кухне. Белок Коррозия
Коррозия Аттестационная работа. Проектно-исследовательская деятельность учащихся на уроках химии и во внеурочной работе
Аттестационная работа. Проектно-исследовательская деятельность учащихся на уроках химии и во внеурочной работе Общая технология отрасли. Сахар и сахаристые вещества
Общая технология отрасли. Сахар и сахаристые вещества Получение олефинов пиролизом углеводородов
Получение олефинов пиролизом углеводородов Растворы. 11 класс
Растворы. 11 класс Ковалентная связь. Электроотрицательность
Ковалентная связь. Электроотрицательность Химическое равновесие. Необратимые и обратимые реакции
Химическое равновесие. Необратимые и обратимые реакции