Содержание
- 2. План лекции Общие понятия Расчет ЭДС гальванических элементов Диффузионный потенциал Мембранный потенциал Потенциометрия
- 3. Гальванический элемент Устройство, состоящее из двух электродов, дающее возможность получать электрический ток в результате химической реакции
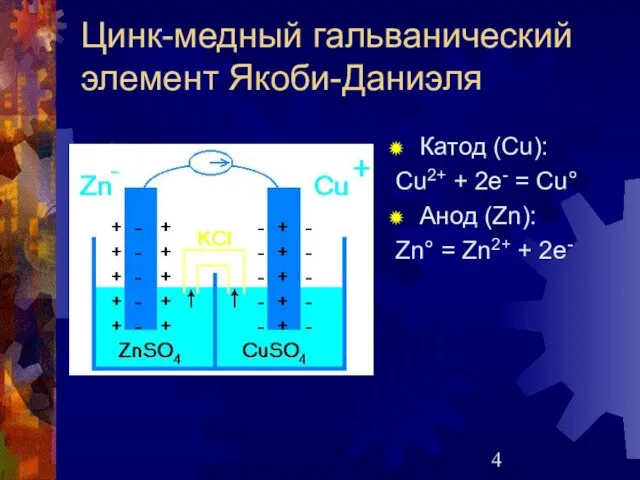
- 4. Цинк-медный гальванический элемент Якоби-Даниэля Катод (Сu): Cu2+ + 2e- = Cu° Анод (Zn): Zn° = Zn2+
- 5. ЭДС гальванического элемента, составленного из двух металлов Из потенциала положительно заряженного электрода вычитают потенциал отрицательно заряженного
- 6. ЭДС зависит от: Положения металлов в ряду напряжений Соотношения ионов взятых растворов
- 7. Концентрационный гальванический элемент Гальванический элемент, состоящий из одинаковых полуэлементов, различающихся только концентрациями растворенного вещества Анод: Ag°
- 8. ЭДC концентрационного гальванического элемента ЭДС = ЕAg1 – EAg2 0,2T ЕAg1 = E°Ag1 + -------- lg
- 9. Измеряя ЭДС концентрационного элемента можно практически определить: Активность ионов Коэффициент активности ионов Неизвестную концентрацию раствора а
- 10. Пример Цепь из двух водородных электродов: нормального – электрод сравнения и заполненного исследуемым раствором с неизвестной
- 11. Диффузионный потенциал Разность потенциалов, возникающая на границе раздела между двумя неодинаковыми по составу или по концентрации
- 12. Диффузионный потенциал усредняет скорости движения ионов при сохранении скачка потенциала на границе раздела растворов разной концентрации
- 13. Диффузионные потенциалы в биологических объектах Потенциал повреждения (поврежденная ткань заряжается отрицательно) составляет 30 – 40 мВ
- 14. Межфазовые потенциалы Возникают: На границе раздела между двумя несмешивающимися жидкостями; обусловлены неодинаковой растворимостью в них веществ
- 15. Мембранный потенциал Потенциал, возникающий на мембране с избирательной проницаемостью (пропускающей только ионы одного знака), разделяющей два
- 16. Потенциал покоя мембранный потенциал, возникающий между внутренней и наружной сторонами клеточной мембраны, находящейся в невозбужденном состоянии:
- 17. Возбужденное состояние клетки ↑ проницаемость мембраны для ионов Na+ Перемена знака на поверхности мембраны – деполяризация:
- 18. Потенциал действия Разность между потенциалом покоя и зарядом мембраны в возбужденном состоянии (амплитуда колебания мембранного потенциала)
- 19. Потенциометрия Физико-химический метод анализа, в основе которого лежит измерение ЭДС цепи, составленной из индикаторного электрода и
- 20. Методы потенциометрии Прямые – определение активности и концентрации ионов или веществ в растворе Косвенные – определение
- 21. Прямая потенциометрия Электроды сравнения – электроды, потенциал которых практически постоянен, легко воспроизводим и не зависит от
- 22. Индикаторные электроды Мембранные: ионоселективные – способны определять в растворе концентрацию одного иона С твердыми мембранами Стеклянный
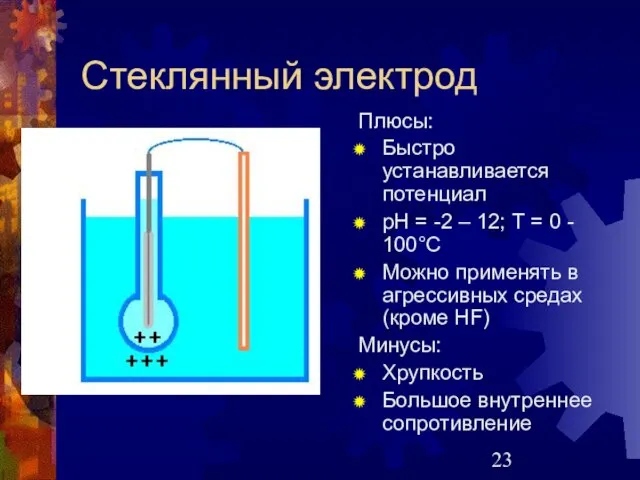
- 23. Стеклянный электрод Плюсы: Быстро устанавливается потенциал рН = -2 – 12; Т = 0 - 100°С
- 24. Ионоселективные электроды Действие основано на возникновении мембранного потенциала на мембране с избирательной чувствительностью к данному иону
- 25. Мембранный электрод С твердыми мембранами – метеллическая или кристаллическая пластинка, содержащая тот ион, который нужно определить
- 26. Ферментные электроды Мочевино-селективный уреаза СО(NH2)2 → NH4+ Пенициллино-селективный пенициллиназа Пенициллин → пенициллиновая кислота Позволяют определять глюкозу,
- 27. Косвенная потенциометрия (потенциометрическое титрование) График зависимости ЭДС цепи от объема титранта График изменения приращения потенциала на
- 29. Скачать презентацию
























 Коррозия металлов
Коррозия металлов Термоядролық реакция
Термоядролық реакция Зависимость свойств веществ от их строения. Химическая связь. Основные виды химической связи
Зависимость свойств веществ от их строения. Химическая связь. Основные виды химической связи Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6]
Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6]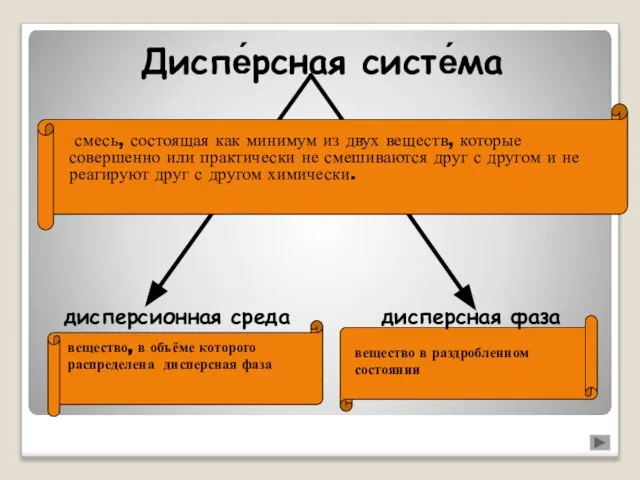 Дисперсные системы
Дисперсные системы Метасоматические горные породы
Метасоматические горные породы ИЗУЧЕНИЕ ОТДЕЛЬНЫХ ТЕМ БАЗОВОГО СОДЕРЖАНИЯ КУРСА ХИМИИ В 8 КЛАССЕ, НА ОСНОВЕ ТЕХНОЛОГИИ ПОЛНОГО УСВОЕНИЯ. Алексашенко Д.Н. Учите
ИЗУЧЕНИЕ ОТДЕЛЬНЫХ ТЕМ БАЗОВОГО СОДЕРЖАНИЯ КУРСА ХИМИИ В 8 КЛАССЕ, НА ОСНОВЕ ТЕХНОЛОГИИ ПОЛНОГО УСВОЕНИЯ. Алексашенко Д.Н. Учите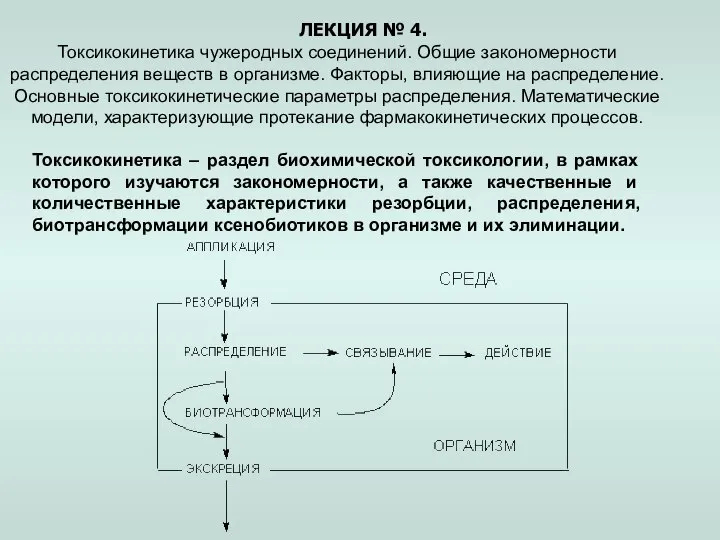 Токсикокинетика чужеродных соединений. Закономерности распределения веществ в организме. (Лекция 4)
Токсикокинетика чужеродных соединений. Закономерности распределения веществ в организме. (Лекция 4) Химические уравнения
Химические уравнения Подготовил: Денис Специально для PowerPoint.Net.Ru
Подготовил: Денис Специально для PowerPoint.Net.Ru  Нуклеофильное замещение у насыщенного атома углерода, SN у Csp3
Нуклеофильное замещение у насыщенного атома углерода, SN у Csp3 Электрохимическая коррозия.
Электрохимическая коррозия. Органическая химия. Лекция. Стероиды
Органическая химия. Лекция. Стероиды Вода - Н2О
Вода - Н2О Проект по химии на тему: «Дисахариды» Учениц 10 «Б» класса Богдановой Анны Ганиной Ольги
Проект по химии на тему: «Дисахариды» Учениц 10 «Б» класса Богдановой Анны Ганиной Ольги Валентность химических элементов. 1.Валентность водорода равна единице
Валентность химических элементов. 1.Валентность водорода равна единице Коллоидные растворы. Устойчивость коллоидных систем. Коагуляция. Лиофильные системы. (Часть 3)
Коллоидные растворы. Устойчивость коллоидных систем. Коагуляция. Лиофильные системы. (Часть 3) Ферментативный микроанализ. Использование в микроанализе ферментных электродов. (Лекция 6)
Ферментативный микроанализ. Использование в микроанализе ферментных электродов. (Лекция 6) Магистры Тема 3б
Магистры Тема 3б Хроматография
Хроматография “Nafen” alumina nanofibers as support for “Iriotec” antistatic pigments
“Nafen” alumina nanofibers as support for “Iriotec” antistatic pigments Основные понятия и законы химии. Периодический закон и периодическая система элементов Д. И. Менделеева. Теория строения веществ
Основные понятия и законы химии. Периодический закон и периодическая система элементов Д. И. Менделеева. Теория строения веществ Методология, принципы и методы изучения МПИ
Методология, принципы и методы изучения МПИ Основы кристаллического строения металлов
Основы кристаллического строения металлов Химия неорганических пигментов
Химия неорганических пигментов  д.з.051
д.з.051 Галогены. Межгалогенные соединения
Галогены. Межгалогенные соединения Экспресс-методы решения задач по химии
Экспресс-методы решения задач по химии