Содержание
- 2. Изменение цвета различных индикаторов при действии растворов кислот и щелочей
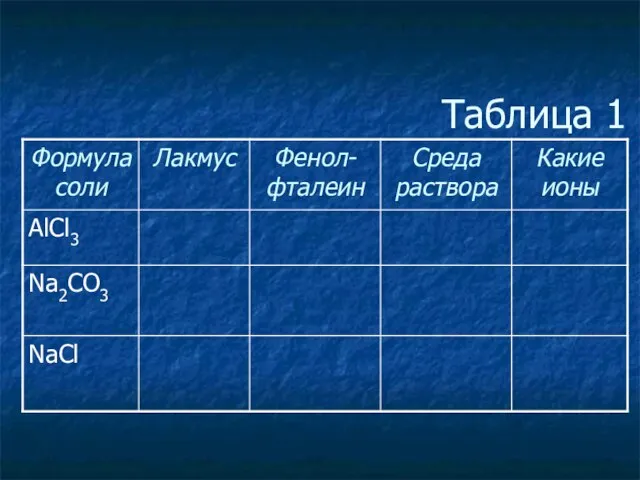
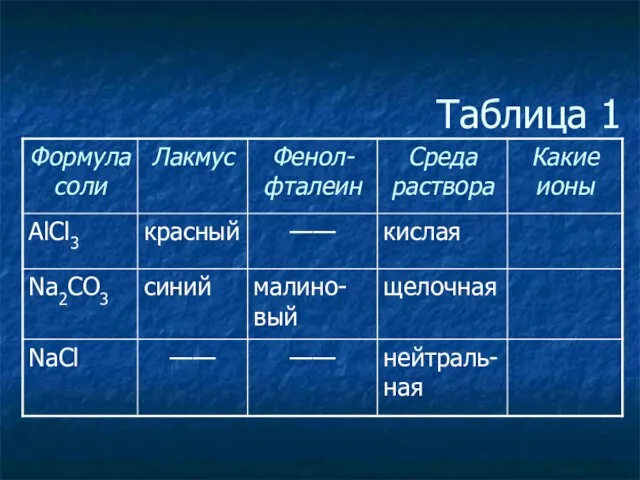
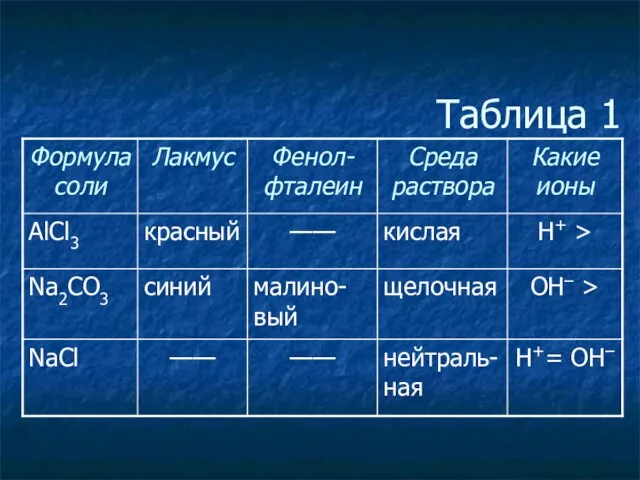
- 3. Таблица 1
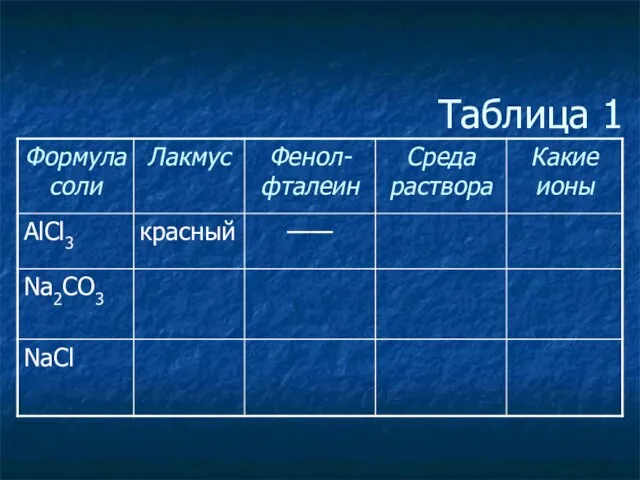
- 4. Таблица 1
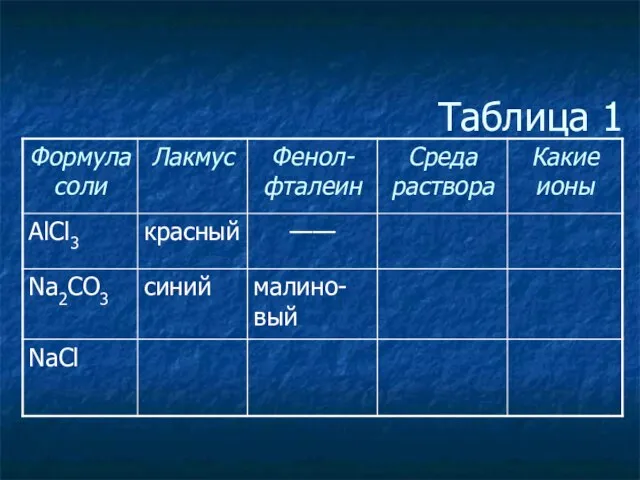
- 5. Таблица 1
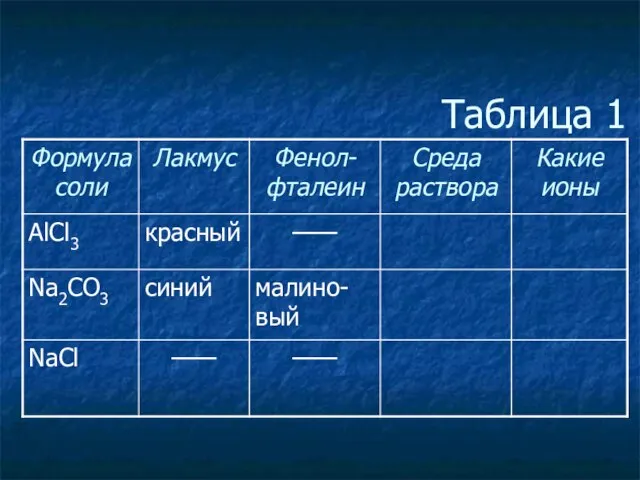
- 6. Таблица 1
- 7. Таблица 1
- 8. Таблица 1
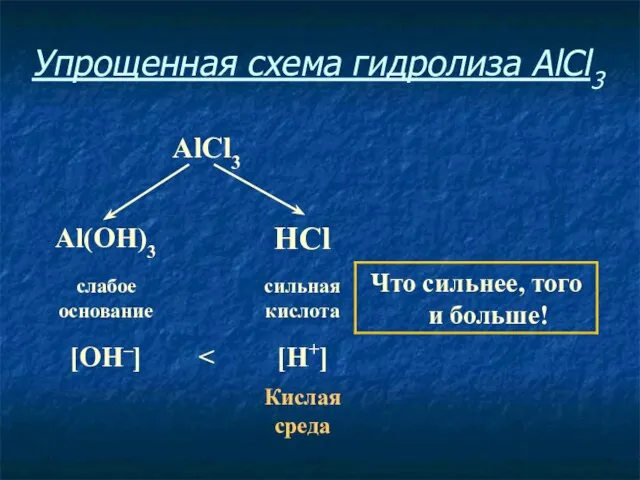
- 9. Упрощенная схема гидролиза AlCl3
- 10. Соль, образованная слабым основанием и сильной кислотой, имеет кислую среду, так как в растворе избыток ионов
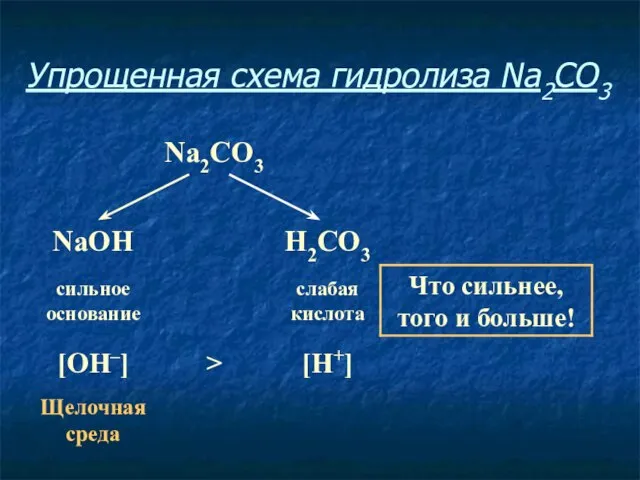
- 11. Упрощенная схема гидролиза Na2CO3
- 12. Соль, образованная сильным основанием и слабой кислотой, имеет щелочную среду, так как в растворе избыток гидроксид-ионов.
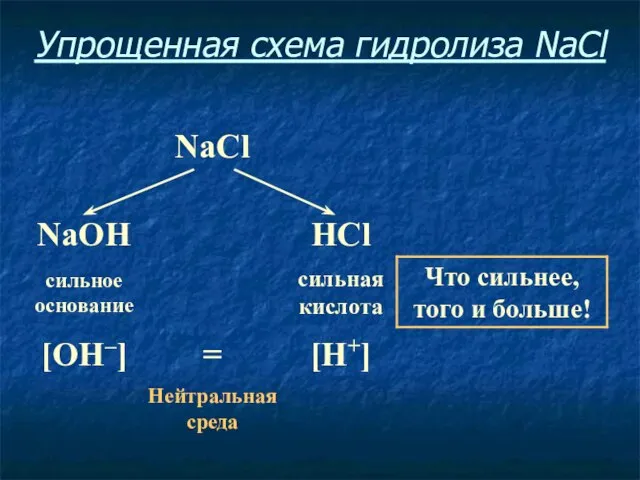
- 13. Упрощенная схема гидролиза NaCl
- 14. Соль, образованная сильным основанием и сильной кислотой, имеет нейтральную среду, так как в растворе одинаковое количество
- 15. Гидролиз — это реакция обмена между некоторыми солями и водой («гидро» — вода, «лизис» — разложение)
- 16. Уравнения гидролиза АlСl3 АlСl3 ↔ Аl3+ + 3Сl–
- 17. Уравнения гидролиза АlСl3 АlСl3 ↔ Аl3+ + 3Сl– Н2O ↔ Н+ + ОН–
- 18. Уравнения гидролиза АlСl3 АlСl3 ↔ Аl3+ + 3Сl– Н2O ↔ Н+ + ОН– _______________________________________________________________________________
- 19. Уравнения гидролиза АlСl3 АlСl3 ↔ Аl3+ + 3Сl– Н2O ↔ Н+ + ОН– _______________________________________________________________________________ Al3+ +
- 20. Уравнения гидролиза АlСl3 АlСl3 ↔ Аl3+ + 3Сl– Н2O ↔ Н+ + ОН– _______________________________________________________________________________ Al3+ +
- 21. Уравнения гидролиза АlСl3 АlСl3 ↔ Аl3+ + 3Сl– Н2O ↔ Н+ + ОН– ___________________________________________________________________ Al3+ +
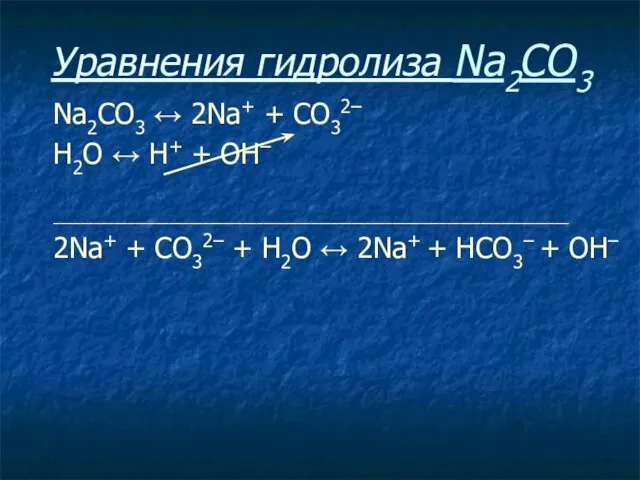
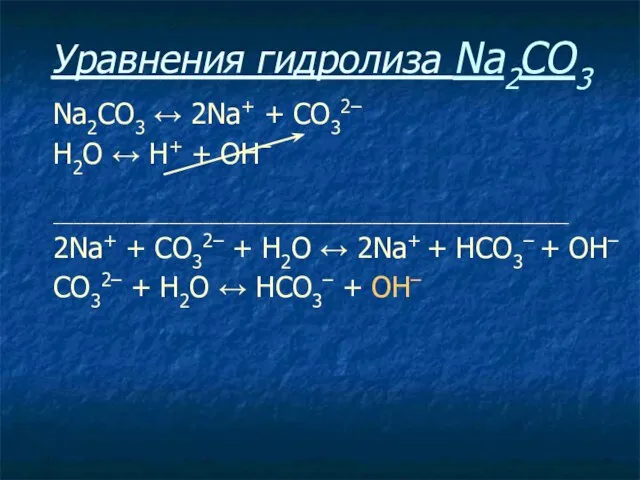
- 22. Уравнения гидролиза Na2CO3 Na2CO3 ↔ 2Na+ + СO32–
- 23. Уравнения гидролиза Na2CO3 Na2CO3 ↔ 2Na+ + СO32– Н2O ↔ Н+ + ОН–
- 24. Уравнения гидролиза Na2CO3 Na2CO3 ↔ 2Na+ + СO32– Н2O ↔ Н+ + ОН– ____________________________________________________________________________
- 25. Уравнения гидролиза Na2CO3 Na2CO3 ↔ 2Na+ + СO32– Н2O ↔ Н+ + ОН– ____________________________________________________________________________ 2Na+ +
- 26. Уравнения гидролиза Na2CO3 Na2CO3 ↔ 2Na+ + СO32– Н2O ↔ Н+ + ОН– ____________________________________________________________________________ 2Na+ +
- 27. Уравнения гидролиза Na2CO3 Na2CO3 ↔ 2Na+ + СO32– Н2O ↔ Н+ + ОН– ____________________________________________________________________________ 2Na+ +
- 28. Уравнения гидролиза NaCl NaCl ↔ Na+ + Сl– Н2O ↔ Н+ + ОН– ____________________________________________________________________________ Na+ +
- 29. Какую среду будут иметь водные растворы следующих солей: 1 вариант 2 вариант а) нитрата цинка (II)
- 30. Ответы
- 31. Zn(NO3)2 ↔ Zn2+ + 2NO3– Н2O ↔ Н+ + ОН – ________________________________________________________ Zn2+ + 2NO3– +
- 32. K2SO4 ↔ 2K+ + SO42– Н2O ↔ Н+ + ОН – ____________________________________________________________________________ 2K+ + SO42– +
- 33. Na2S ↔ 2Na+ + S2– Н2O ↔ Н+ + ОН – ____________________________________________________________________________ 2Na+ + S2– +
- 34. О значении и применении гидролиза... Под действием биологических катализаторов — ферментов в организме человека происходит гидролиз
- 35. Домашнее задание. Пользуясь таблицей «Сильные и слабые электролиты», приведите свои примеры солей, которые будут иметь кислую,
- 36. Урок окончен
- 38. Скачать презентацию
























 Ферменти. Історія вчення про ферменти
Ферменти. Історія вчення про ферменти Генетическая связь между классами неорганических веществ
Генетическая связь между классами неорганических веществ Биогеохимия: основные понятия, история развития, практическое значение идей биогеохимии
Биогеохимия: основные понятия, история развития, практическое значение идей биогеохимии Диоксины, глобальные экотоксиканты
Диоксины, глобальные экотоксиканты Электроматериаловедение
Электроматериаловедение Мило. Синтетичні миючі засоби.
Мило. Синтетичні миючі засоби.  Аминокислоты
Аминокислоты Изменение в составе ядер атомов. Изотопы
Изменение в составе ядер атомов. Изотопы Презентация по Химии "Отчет по месячнику химии" - скачать смотреть
Презентация по Химии "Отчет по месячнику химии" - скачать смотреть  Дисперсные системы: общая характеристика и классификация
Дисперсные системы: общая характеристика и классификация Кристаллы
Кристаллы История развития контролируемой радикальной полимеризации. Управление ростом полимерной цепи нитроксильными радикалами
История развития контролируемой радикальной полимеризации. Управление ростом полимерной цепи нитроксильными радикалами Нитраты в продуктах
Нитраты в продуктах Антибиотики-аминогликозиды: получение, свойства, исследование и применение. Связь между химическим строением и действием
Антибиотики-аминогликозиды: получение, свойства, исследование и применение. Связь между химическим строением и действием Элементы химической термодинамики и биоэнергетики
Элементы химической термодинамики и биоэнергетики Алюминий – металл будущего
Алюминий – металл будущего Тема : Спирты Презентация по химии Ученицы 11 «Б» класса ЗОШ №41 Зануды Татьяны
Тема : Спирты Презентация по химии Ученицы 11 «Б» класса ЗОШ №41 Зануды Татьяны  Предельные углеводороды и их галогенопроизводные. Спирты, эфиры, альдегиды и их производные
Предельные углеводороды и их галогенопроизводные. Спирты, эфиры, альдегиды и их производные Полиазометины (полишиффовы основания)
Полиазометины (полишиффовы основания) Химия и производство. Химическая промышленность и химические технологии
Химия и производство. Химическая промышленность и химические технологии Химическое равновесие
Химическое равновесие Алкалоиды. Классификация алкалоидов:
Алкалоиды. Классификация алкалоидов: Растворы
Растворы Хімія та обмін ліпідів
Хімія та обмін ліпідів Водорастворимые витамины
Водорастворимые витамины Теория сплавов
Теория сплавов Серебро - химический элемент в периодической таблице с атомным номером 47. 8 класс
Серебро - химический элемент в периодической таблице с атомным номером 47. 8 класс Моя профессия химик-аналитик
Моя профессия химик-аналитик