Содержание
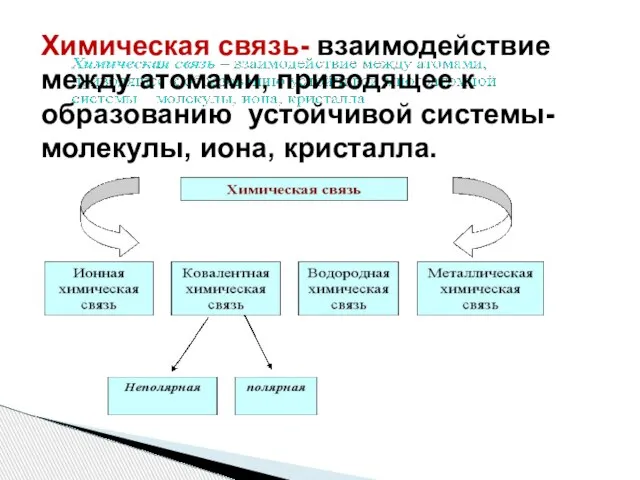
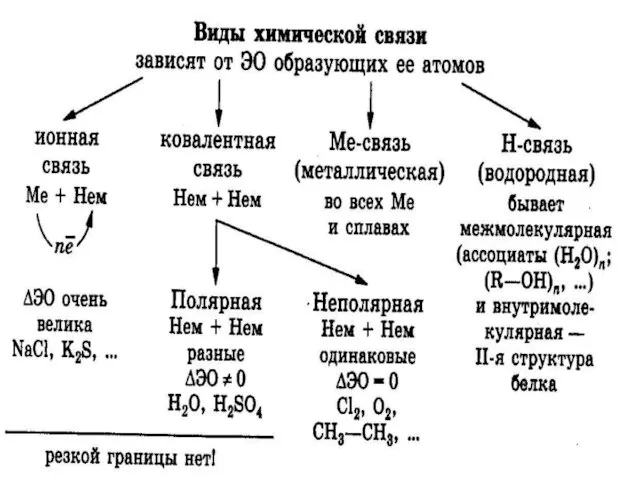
- 2. Химическая связь- взаимодействие между атомами, приводящее к образованию устойчивой системы- молекулы, иона, кристалла.
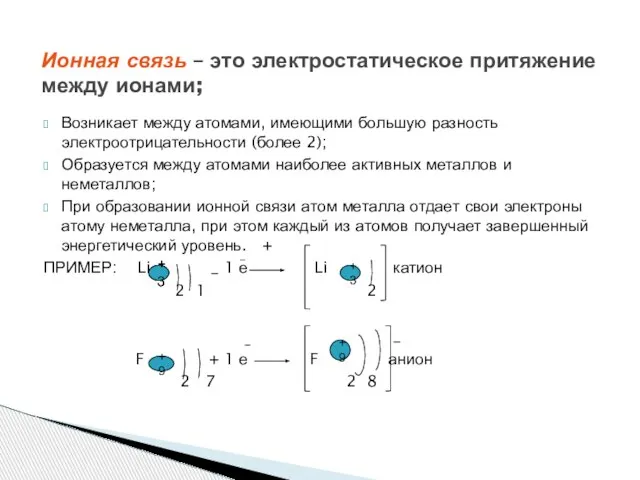
- 3. Возникает между атомами, имеющими большую разность электроотрицательности (более 2); Образуется между атомами наиболее активных металлов и
- 4. - ОН , -2 SO, - Cl
- 5. Вещества с ионной связью при н.у. находятся в твердом агрегатном состоянии и образуют кристаллы с ионной
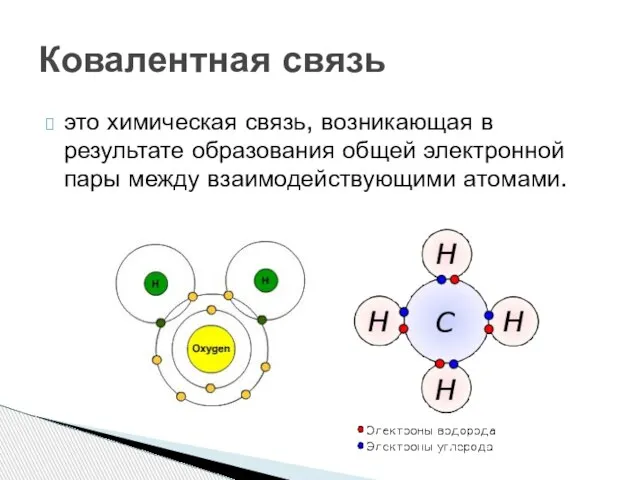
- 6. это химическая связь, возникающая в результате образования общей электронной пары между взаимодействующими атомами. Ковалентная связь
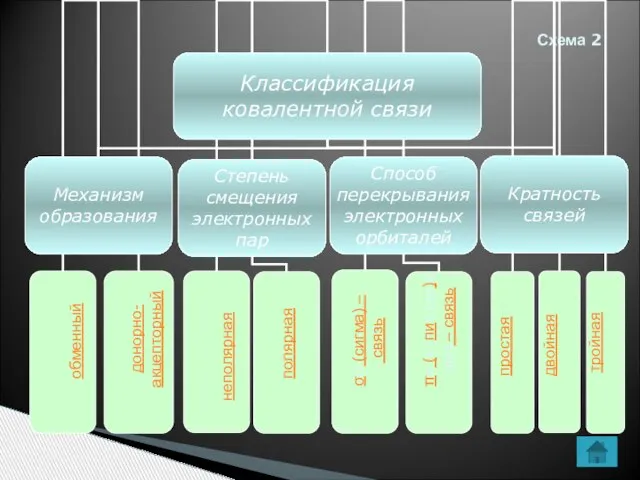
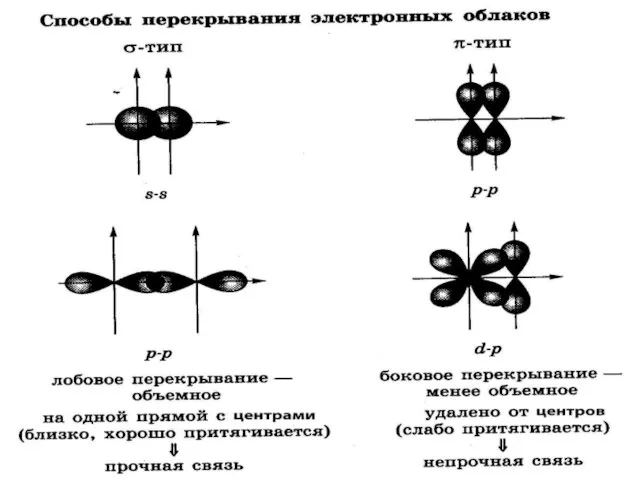
- 7. Схема 2 обменный донорно- акцепторный полярная неполярная σσ (сигма) – связь ππ (π (пиπ (пи)π (пи)
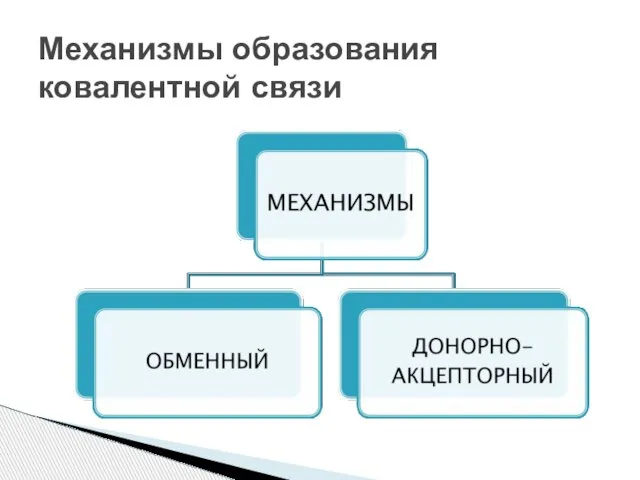
- 8. Механизмы образования ковалентной связи
- 9. Обменный механизм образования ковалентной связи ☼ Действует, когда атомы образуют общие электронные пары за счёт объединения
- 10. Донорно-акцепторный механизм образования ковалентной связи ☼ Действует между веществами донором и акцептором. Донор – вещество, у
- 11. Степень смещения электронных пар ☼Зависит от ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ элементов. Ряд электроотрицательности: F, O, N, C l, Br,
- 13. Кратность ковалентной связи ☼Зависит от числа общих электронных пар, связывающих атомы. Бывает: ПРОСТАЯ « - »
- 14. Длина связи – расстояние между центрами двух соседних атомов (зависит от радиуса атома и кратности связи);
- 15. насыщаемость – молекулы и ионы имеют определенный состав, т.к. образуется определенное и ограниченное число связей; направленность
- 16. газами жидкостями твердыми -- аморфные (расположение частиц в них неупорядоченное, например – стекло, смола, полимеры и
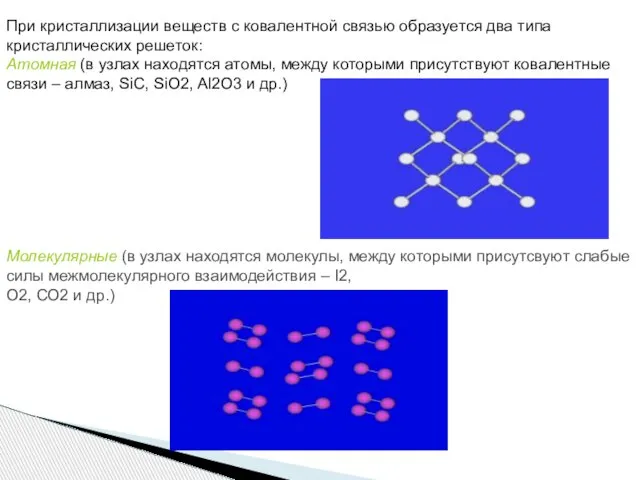
- 17. При кристаллизации веществ с ковалентной связью образуется два типа кристаллических решеток: Атомная (в узлах находятся атомы,
- 18. Металлическая химическая связь осуществляется свободными электронами, общими для всего кристалла. Металлы образуют металлические кристаллические решетки, в
- 19. Механизм образования металлической связи: 0 n+ М - nē = М Например: для элементов (металлов) Ι
- 20. ненасыщенная; ненаправленная. Особенности металлической связи: сравнительно небольшое количество электронов одновременно связывает множество атомных ядер – связь
- 21. Водородная химическая связь – это электростатическое притяжение между положительно поляризованными атомами водорода одной молекулы и отрицательно
- 22. Водородная связь Межмолекулярная водородная связь – это связь между атомами водорода одной молекулы и сильноотрицательными элементами(O,
- 23. Водородная связь Внутримолекулярная водородная связь – эта связь возможна при наличии в одной молекуле и электроноакцепторной
- 25. Физическая природа химической связи едина – это ядерно-электронное взаимодействие. Деление химической связи на виды условно и
- 26. Резких границ между разными видами химических связей нет, все виды химической связи имеют единую электрическую природу.
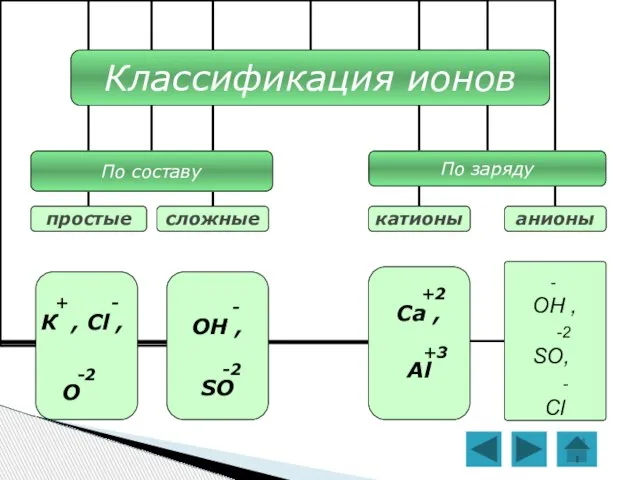
- 27. Что представляют собой ионы? Ионы – это положительно или отрицательно заряженные частицы, в которые превращаются атомы
- 28. Выполните упражнение №1 Из предложенного списка распределите формулы веществ в таблице по соответствующим столбикам: PCl 5,
- 29. Выполните упражнение №2 Покажите образование ионной связи в соединениях: Cu2O, KCl.
- 31. Скачать презентацию



















 Способы получения оксидов, оснований, кислот и солей. Урок №2
Способы получения оксидов, оснований, кислот и солей. Урок №2 Автометаморфизм
Автометаморфизм Строение атома
Строение атома Неорганические соединения. Вода. Роль воды в клетке
Неорганические соединения. Вода. Роль воды в клетке Йодиметрия и йодометрия. (Лекция 9)
Йодиметрия и йодометрия. (Лекция 9) Уксусная кислота
Уксусная кислота Фізико–хімічні властивості плюмбум телуриду та дефектна підсистема твердих розчинів PbTe-Sb2Te3
Фізико–хімічні властивості плюмбум телуриду та дефектна підсистема твердих розчинів PbTe-Sb2Te3 Мило та його склад
Мило та його склад  Аминокислоты «Единственный путь, ведущий к знанию – это деятельность» Б. Шоу
Аминокислоты «Единственный путь, ведущий к знанию – это деятельность» Б. Шоу Органогенні елементи. Хімія в організмах
Органогенні елементи. Хімія в організмах Энергетика химических реакций. Элементы химической термодинамики
Энергетика химических реакций. Элементы химической термодинамики Colloidal solutions coarsely dispersed systems
Colloidal solutions coarsely dispersed systems Тема урока: Арены. Электронное строение молекулы бензола. Гомологический ряд аренов, номенклатура, изомерия.
Тема урока: Арены. Электронное строение молекулы бензола. Гомологический ряд аренов, номенклатура, изомерия. Своя игра «Знаешь ли ты химические элементы?»
Своя игра «Знаешь ли ты химические элементы?» Соединения галогенов
Соединения галогенов Сапфиры. Месторождения сапфира
Сапфиры. Месторождения сапфира Идеальный газ. Основное уравнение МКТ
Идеальный газ. Основное уравнение МКТ Правила оформления лабораторных работ
Правила оформления лабораторных работ Ферменти. Історія вчення про ферменти
Ферменти. Історія вчення про ферменти Презентация Витамин С
Презентация Витамин С Комплексные соединения
Комплексные соединения Презентация по химии Применение электролиза
Презентация по химии Применение электролиза  Харчові добавки і їх вплив на організм людини
Харчові добавки і їх вплив на організм людини  Презентация по Химии "Закрепление, совершенствование, обобщение знаний и подготовка к ЕГЭ по темам курса неорганической химии&qu
Презентация по Химии "Закрепление, совершенствование, обобщение знаний и подготовка к ЕГЭ по темам курса неорганической химии&qu Химия - моя жизнь
Химия - моя жизнь Альдоль-кротоновая конденсация альдегидов и кетонов
Альдоль-кротоновая конденсация альдегидов и кетонов Диффузионный массоперенос в смесях твердых компонентов
Диффузионный массоперенос в смесях твердых компонентов Этанол (этиловый спирт)
Этанол (этиловый спирт)