Содержание
- 2. Лекция №16 Химия металлов ОСОБЕННОСТИ ХИМИИ d -ЭЛЕМЕНТОВ Cодержание 1. Общая характеристика d - элементов 2.
- 4. Общая характеристика d - элементов Валентными электронами являются от 1 до 10 d-е, а также 2,
- 5. (n-1)d1-5 ns2 Две группы d-элементов (n-1)d6-10 ns2 Свойственно проявление высших СО. В высших СО d-элементы III,
- 6. Cr [Ar] 3d54s1 Mn [Ar] 3d54s2 Fe [Ar] 3d64s2 Co [Ar] 3d74s2 Ni [Ar] 3d84s2 Cu
- 7. d-элементы характеризуются большой твердостью и высокими t пл. и t кип. d-элементы характеризуются высокой плотностью, что
- 8. Химические свойства d-элементов Сравнение d- и р-элементов в высших СО Группа р-элементы d-элементы VII VI V
- 9. На d-подуровне наблюдается повышенная устойчивость конфигурации d0, d5, d10 Ti:[Ar]3d24s2 Ti+IV: [Ar]3d04s0 Ti: (II),III,IV Fe:[Ar]3d64s2 Fe:
- 10. VIIB Mn: II, IV, VI, VII TcRe (IV,V) VII VIB Cr: II, III, VI MoW (IV,
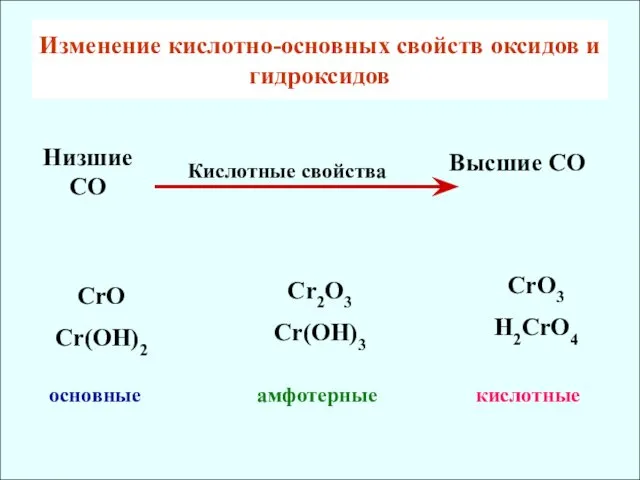
- 11. Изменение кислотно-основных свойcтв оксидов и гидроксидов CrO Cr(OH)2 основные Cr2O3 Cr(OH)3 CrO3 H2CrO4 амфотерные кислотные Низшие
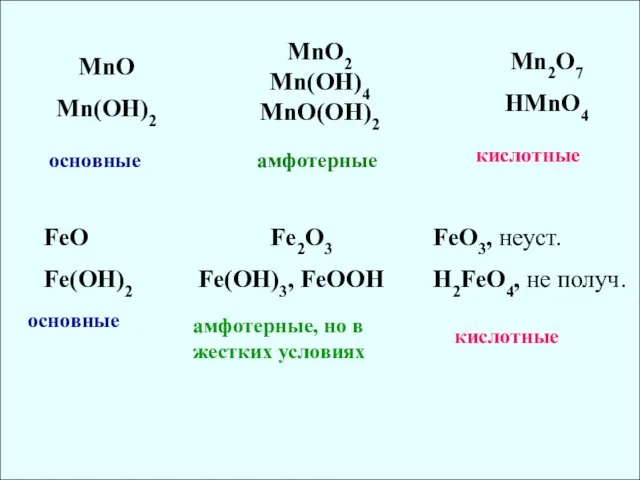
- 12. MnO Mn(OH)2 MnO2 Mn(OH)4 MnO(OH)2 Mn2O7 HMnO4 основные амфотерные кислотные FeO Fe(OH)2 Fe2O3 Fe(OH)3, FeOOH FeO3,
- 13. Cr(OH)3 + H2SO4 = Cr2(SO4)3 + H2O Cr(OH)3 + NaOH = Na[Cr(OH)4] тетрагидроксохромит натрия Cr2O3 +
- 14. Fe2O3 - обладает амфотерными свойствами, но в жестких условиях: Fe2O3 + HCl = FeCl3 + H2O
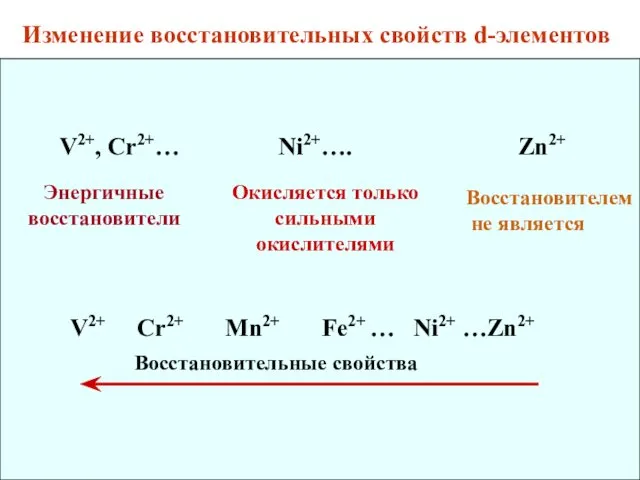
- 15. V2+, Cr2+… Ni2+…. Zn2+ Энергичные восстановители Окисляется только сильными окислителями V2+ Cr2+ Mn2+ Fe2+ … Ni2+
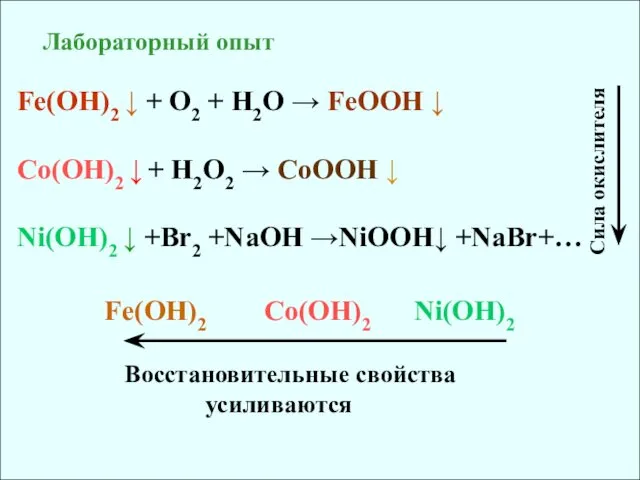
- 16. Лабораторный опыт Fe(OH)2 ↓ + O2 + H2O → FeOOH ↓ Co(OH)2 ↓ + H2O2 →
- 17. Cr(OH)2 + H2O + O2 = Cr(OH)3 В степени +II соединения хрома являются сильными восстановителями: Cоли
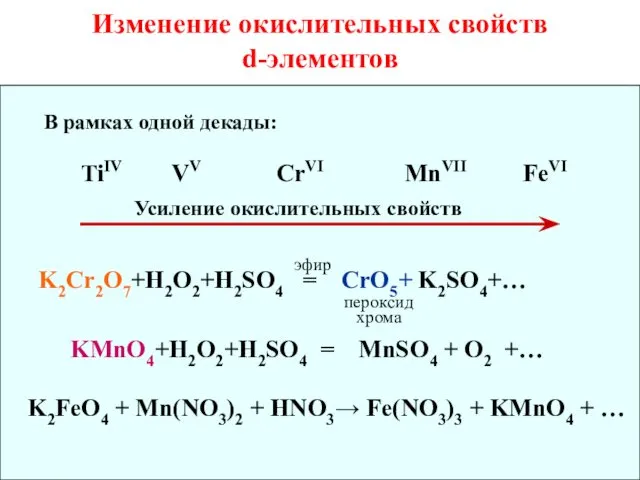
- 18. Изменение окислительных свойств d-элементов В рамках одной декады: TiIV VV CrVI MnVII FeVI Усиление окислительных свойств
- 19. Дихроматы и хроматы являются сильными окислителями: K2Cr2O7 + KJ + H2SO4 = J2 + Cr2(SO4)3 +
- 20. CoCl2 + 4KSCN → K2[Co(SCN)4] + 2KCl Эту способность используют: 1) для очистки d-элементов от примесей
- 21. 2) Для разделения близких по свойствам элементов: ZnSO4CdSO4 + NaOHизбыток Na2[Zn(OH)4]раствор Cd(OH)2 + Na2SO4 AgCl ↓
- 22. Fe2+ + K3[Fe(CN)6] = KFeFe(CN)6 + … III II III Fe3+ + 6 SCN- = [Fe(SCN)6]3-
- 23. ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ - высокая электропроводность - высокая теплопроводность - пластичность - твердость - тугоплавкость
- 24. Руды – это природные соединения металлов. 1 Оксидные руды: 2 Сульфидные руды: - FeS2 – пирит
- 25. Галогенидные руды (в основном щелочных и щелочноземельных металлов): 3 4 NaCl – галит (поваренная соль) KCl
- 26. РУТИЛ TiO2
- 27. Пиролюзит MnO2
- 28. Пирит FeS2
- 29. 1. Пирометаллургия – окислительный обжиг сульфидов и восстановление металлов из оксидов при высокой температуре. Fe2O3 +
- 30. 3. Гидрометаллургия - выделение металлов из растворов их солей более активными металлами CdSO4 + Zn Cd↓+
- 31. Au + KCN + O2 + H2O = K[Au(CN)2] + KOH K[Au(CN)2] + Zn = K2[Zn(CN)4]
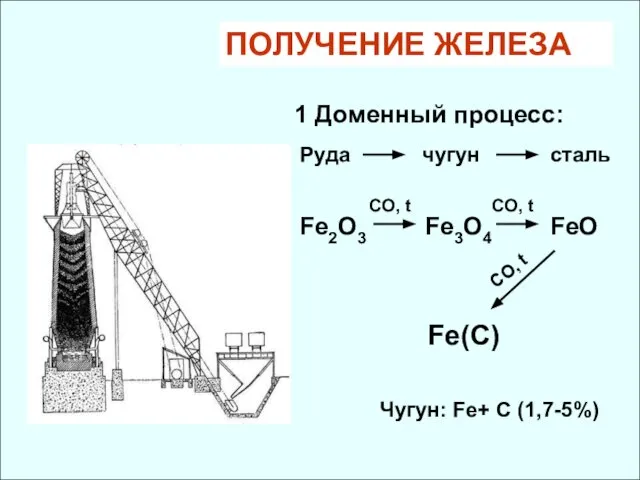
- 32. ПОЛУЧЕНИЕ ЖЕЛЕЗА 1 Доменный процесс: Руда чугун сталь Fe3O4 Fe2O3 CO, t CO, t FeO Fe(C)
- 33. 1. Разложение карбонильных комплексов (Ni, Co, Cr…) Fe + 5CO = Fe(CO)5 Порошок желтая жидкость пентакарбонил
- 34. РЯД НАПРЯЖЕНИЙ МЕТАЛЛОВ Li Cs Ca Na Mg Al Zn Fe Ni Pb H2 Cu Ag
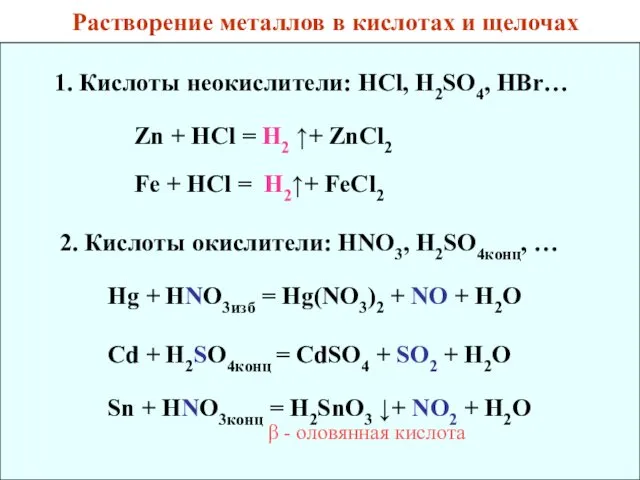
- 35. Растворение металлов в кислотах и щелочах 1. Кислоты неокислители: HCl, H2SO4, HBr… Zn + HCl =
- 36. 3. Смеси кислот: HNO3 + HCl – «царская водка» HNO3 + HF Nb + HNO3 +
- 38. Скачать презентацию



![Cr [Ar] 3d54s1 Mn [Ar] 3d54s2 Fe [Ar] 3d64s2 Co [Ar]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/453961/slide-5.jpg)


![На d-подуровне наблюдается повышенная устойчивость конфигурации d0, d5, d10 Ti:[Ar]3d24s2 Ti+IV:](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/453961/slide-8.jpg)





![CoCl2 + 4KSCN → K2[Co(SCN)4] + 2KCl Эту способность используют: 1)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/453961/slide-19.jpg)
![2) Для разделения близких по свойствам элементов: ZnSO4CdSO4 + NaOHизбыток Na2[Zn(OH)4]раствор](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/453961/slide-20.jpg)
![Fe2+ + K3[Fe(CN)6] = KFeFe(CN)6 + … III II III Fe3+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/453961/slide-21.jpg)








![Au + KCN + O2 + H2O = K[Au(CN)2] + KOH](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/453961/slide-30.jpg)



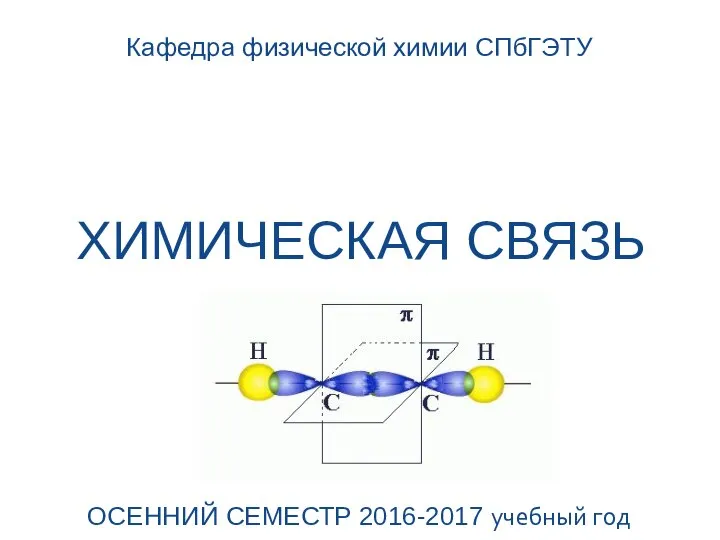 Химическая связь. Лекция 2
Химическая связь. Лекция 2 Сопряжение электронной плотности, как фактор обеспечения стабильности молекул
Сопряжение электронной плотности, как фактор обеспечения стабильности молекул Молярная концентрация вещества в растворе
Молярная концентрация вещества в растворе Связь между основными классами неорганических соединений
Связь между основными классами неорганических соединений Тема: Витамин Е Выполнила: студентка Шагиева А.А. ГОУ СПО ТОМУ № 1 г. Узловая 2012
Тема: Витамин Е Выполнила: студентка Шагиева А.А. ГОУ СПО ТОМУ № 1 г. Узловая 2012 Электрометрические методы анализа ЛВ. Термографические методы
Электрометрические методы анализа ЛВ. Термографические методы Особенности строения, реакционной способности и методы синтеза гидроксилсодержащих соединений
Особенности строения, реакционной способности и методы синтеза гидроксилсодержащих соединений Производство фенолформальдегидной смолы
Производство фенолформальдегидной смолы Диаграммы бинарных систем, образующих твердые растворы
Диаграммы бинарных систем, образующих твердые растворы Основания
Основания Скорость химических реакций
Скорость химических реакций Условная оптимизация методом классического математического анализа с применением множителей
Условная оптимизация методом классического математического анализа с применением множителей Азотосодержащие органические соединения
Азотосодержащие органические соединения Сера. Аллотропные модификации
Сера. Аллотропные модификации Эндогенная серия. Гидротермальная группа
Эндогенная серия. Гидротермальная группа Презентация по Химии "Нуклеиновые кислоты(НК)." - скачать смотреть бесплатно
Презентация по Химии "Нуклеиновые кислоты(НК)." - скачать смотреть бесплатно Вольфра́м — химический элемент с атомным номером 74 в Периодической системе химических элементов Д. И. Менделеева
Вольфра́м — химический элемент с атомным номером 74 в Периодической системе химических элементов Д. И. Менделеева Липиды. Определение. Классификация
Липиды. Определение. Классификация Ахрамович Наталья Михайловна учитель химии ГБОУ СОШ № 450 Курортного района Санкт – Петербурга
Ахрамович Наталья Михайловна учитель химии ГБОУ СОШ № 450 Курортного района Санкт – Петербурга Статья двумя способами. Приготовление катализатора
Статья двумя способами. Приготовление катализатора Группа веществ, изолируемых из объектов путём минерализации биологического материала (Продолжение)
Группа веществ, изолируемых из объектов путём минерализации биологического материала (Продолжение) Углеводы – структура, функции, свойства
Углеводы – структура, функции, свойства Карбоновые кислоты
Карбоновые кислоты Применение здм к кислотно-основным равновесиям и их роль в аналитической химии
Применение здм к кислотно-основным равновесиям и их роль в аналитической химии Презентация Химические свойства кислот в свете теории электролитической диссоциации 9 Класс
Презентация Химические свойства кислот в свете теории электролитической диссоциации 9 Класс Биогенные р-элементы-органогены и физиологически активные галогены
Биогенные р-элементы-органогены и физиологически активные галогены Карбонові кислоти. Насичені карбонові кислоти
Карбонові кислоти. Насичені карбонові кислоти Роль липидов в формировании потребительских свойств
Роль липидов в формировании потребительских свойств