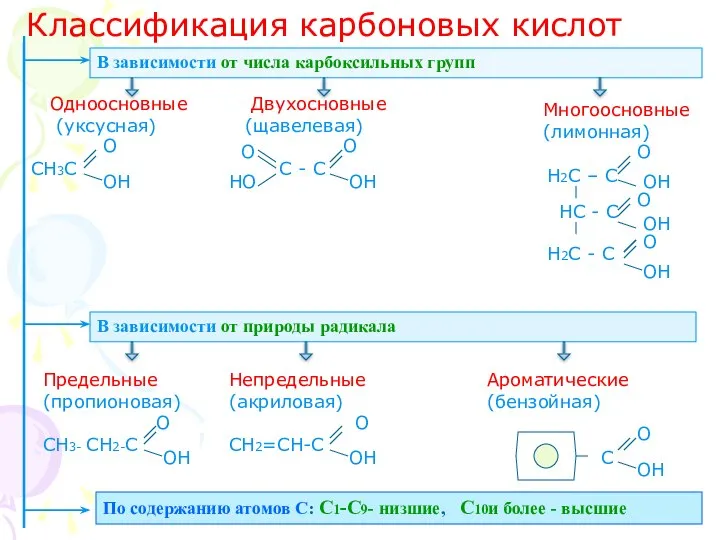
Химические свойства карбоновых кислот
І. Общие с неорганическими кислотами
Растворимые карбоновые кислоты в
водных растворах диссоциируют:
СН3 – СООН СН3 – СОО + Н
+
Среда кислая
? Как изменятся окраска
индикаторов в кислой среде ?
Лакмус (фиолетовый) – краснеет
Метилоранжевый- розовеет
Фенофталеин – не меняет цвет
2. Взаимодействие с металлами , стоящими в электрохимическом ряду напряжений до водорода:
2СН3 – СООН +Мg
Уксусная кислота
(СН3 –СОО)2Мg
Ацетат магния
+ Н2
2СН3 - СООН + Zn Уксусная кислота
(СН3 –СОО)2Zn
Ацетат цинка
+ Н2
При взаимодействии металла с раствором карбоновой кислоты образуется
водород и соль


 Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Химерні та трансгенні організми
Химерні та трансгенні організми  НЕМЕТАЛЛЫ Все, что я познаю, я знаю, для чего это мне надо и где и как я могу эти знания применить. Найти разумный баланс между
НЕМЕТАЛЛЫ Все, что я познаю, я знаю, для чего это мне надо и где и как я могу эти знания применить. Найти разумный баланс между  Строение и функции белков
Строение и функции белков  Алкадиены Непредельные углеводороды
Алкадиены Непредельные углеводороды Кинетика химических реакций. Основные понятия и законы химической кинетики
Кинетика химических реакций. Основные понятия и законы химической кинетики Золото (Au). Загальна характеристика
Золото (Au). Загальна характеристика Инсектициды на основе бакуловирусов
Инсектициды на основе бакуловирусов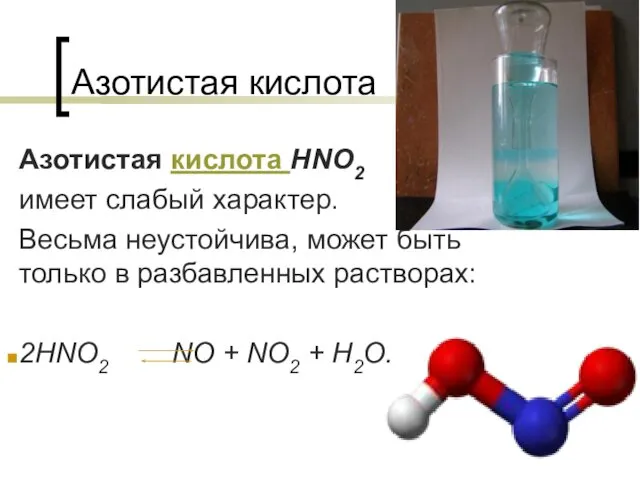 Азотистая кислота
Азотистая кислота Гноеродные (пиогенные) кокки
Гноеродные (пиогенные) кокки Реология расплавов и растворов полимеров
Реология расплавов и растворов полимеров Прогнозування хімічної обстановки під час застосування хімічної зброї
Прогнозування хімічної обстановки під час застосування хімічної зброї Алкины. Номенклатура и изомерия
Алкины. Номенклатура и изомерия Пиримидин. Оның туындылары
Пиримидин. Оның туындылары Электрометрические методы анализа ЛВ. Термографические методы
Электрометрические методы анализа ЛВ. Термографические методы Урок по химии в 10 классе: «Углерод и кремний – р-элементы IVA-группы» подготовил учитель химии и биологии ГУО СШ №163 г.Минска Ко
Урок по химии в 10 классе: «Углерод и кремний – р-элементы IVA-группы» подготовил учитель химии и биологии ГУО СШ №163 г.Минска Ко Строение кристаллов
Строение кристаллов Липиды. Химия липидов. Переваривание липидов в ЖКТ. Нарушение переваривания и всасывания
Липиды. Химия липидов. Переваривание липидов в ЖКТ. Нарушение переваривания и всасывания Презентация по Химии "Дмитро Іванович Менделєєв" - скачать смотреть бесплатно
Презентация по Химии "Дмитро Іванович Менделєєв" - скачать смотреть бесплатно Молекулы и атомы. Простые и сложные вещества
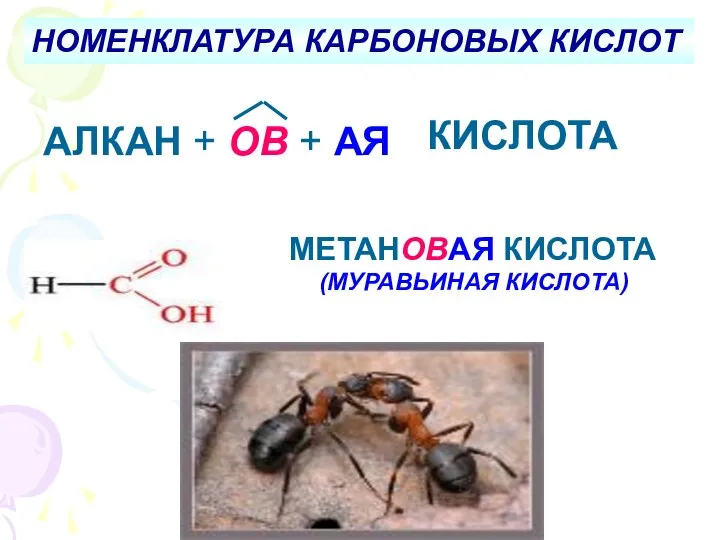
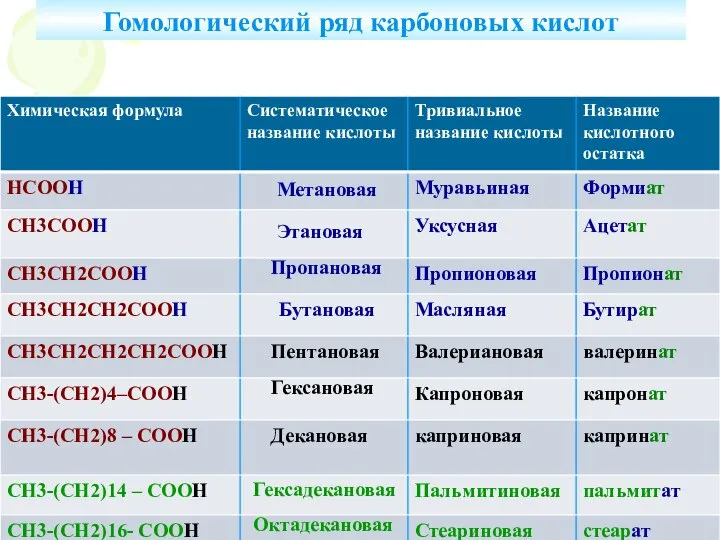
Молекулы и атомы. Простые и сложные вещества Кислоты
Кислоты Спирты. Классификация спиртов
Спирты. Классификация спиртов ПОРТФОЛІО вчителя хімії та біології Турбівської загальноосвітньої школи І – ІІІ ступенів 2014 рік
ПОРТФОЛІО вчителя хімії та біології Турбівської загальноосвітньої школи І – ІІІ ступенів 2014 рік Классификация минералов
Классификация минералов Кирпичики наноструктуры. Занятие 8
Кирпичики наноструктуры. Занятие 8 Неметаллические материалы и полиамиды
Неметаллические материалы и полиамиды Химический состав фракций нефти
Химический состав фракций нефти Коллоидные ПАВ. Мицеллообразование в растворах ПАВ. Липосомы
Коллоидные ПАВ. Мицеллообразование в растворах ПАВ. Липосомы