Содержание
- 2. Окисли́тельно-восстанови́тельные реа́кции (ОВР) — это химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав
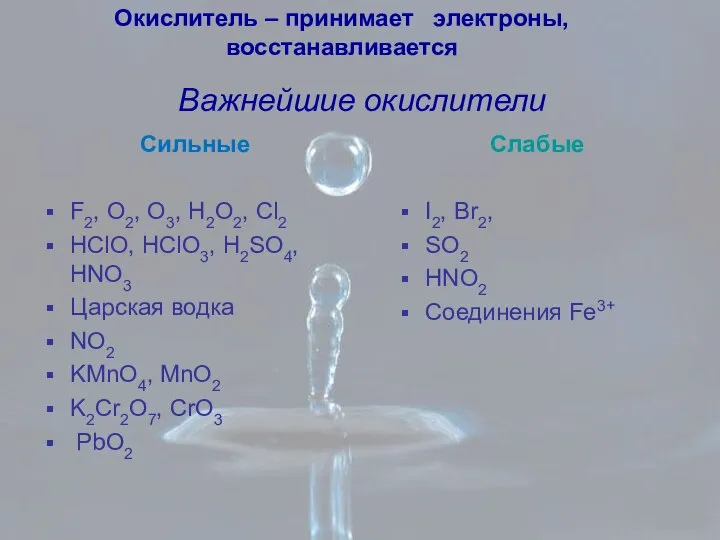
- 3. Важнейшие окислители Сильные F2, O2, O3, H2O2, Cl2 HClO, HClO3, H2SO4, HNO3 Царская водка NO2 KMnO4,
- 4. Сильные Щелочные и щелочно-земельные металлы Mg, Al, H2 HI и йодиды HBr и бромиды H2S и
- 5. Окислительно-восстановительная двойственность
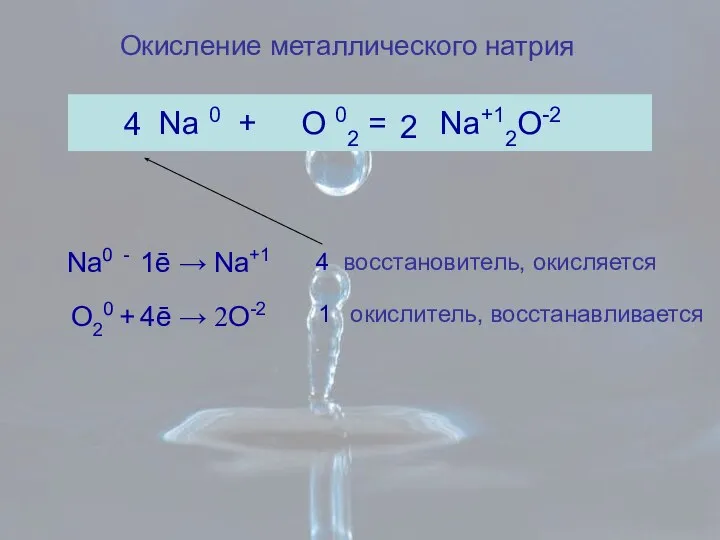
- 7. Окисление металлического натрия Na 0 + O 02 = Na+12O-2 2 4 восстановитель, окисляется окислитель, восстанавливается
- 9. Взаимодействие оксида кальция с водой Ca +2O -2 + H +12O -2 = Ca +2 (O
- 11. P2O5 + H2O = H3PO4 Относится ли данная реакция к окислительно – восстановительным? Данная реакция не
- 13. Взаимодействие железа с сульфатом меди (II) Fe + CuSО4 = FeSО4 + Cu Fe0 - 2ē
- 15. Скачать презентацию









 Ароматические углеводороды
Ароматические углеводороды Основные понятия и определения. Хроматография
Основные понятия и определения. Хроматография Электрохимические производства
Электрохимические производства Лекарственные средства, производные пиридина и пиперазина. (Тема 3)
Лекарственные средства, производные пиридина и пиперазина. (Тема 3) Гидролиз. Виды гидролиза
Гидролиз. Виды гидролиза Химиялық байланыстың табиғаты
Химиялық байланыстың табиғаты Оксид металлов
Оксид металлов Галогены. Способы получения, применение
Галогены. Способы получения, применение Камни и Козерог
Камни и Козерог Понятие об адсорбционной влаге
Понятие об адсорбционной влаге Фосфор Материал для повторения и подготовки к ГИА Учитель химии МОУ «Гимназия №1» г. Саратов Шишкина И.Ю.
Фосфор Материал для повторения и подготовки к ГИА Учитель химии МОУ «Гимназия №1» г. Саратов Шишкина И.Ю.  Enantioselective Total Synthesis
Enantioselective Total Synthesis Производство самодельного мыла: технология, экономика
Производство самодельного мыла: технология, экономика Чипсы: Вред или польза?. 9 класс
Чипсы: Вред или польза?. 9 класс Кислоты и классы химических веществ. 8 класс
Кислоты и классы химических веществ. 8 класс Тема 1.4 Закономерности химических процессов. Основы химической термодинамики и биоэнергетики
Тема 1.4 Закономерности химических процессов. Основы химической термодинамики и биоэнергетики Сырьевая база парфюмерно-косметической промышленности
Сырьевая база парфюмерно-косметической промышленности Возбудители колибактериоза
Возбудители колибактериоза Материаловедение и технология конструкционных материалов
Материаловедение и технология конструкционных материалов Предельные углеводороды. Метан как представитель предельных углеводородов
Предельные углеводороды. Метан как представитель предельных углеводородов Качественный анализ (часть 1)
Качественный анализ (часть 1) Соляная кислота (HCI)
Соляная кислота (HCI) Пестицидтердің жіктелуі
Пестицидтердің жіктелуі Органические вещества: липиды
Органические вещества: липиды Соли серной кислоты
Соли серной кислоты Общая характеристика металлов. Металлическая связь
Общая характеристика металлов. Металлическая связь Химическая связь 11 класс
Химическая связь 11 класс  Неорганические соединения серы
Неорганические соединения серы