Содержание
- 2. «Только с появлением теории Вернера химия комплексных соединений утратила характер лабиринта или темного леса, в котором
- 3. Приложения Химический словарик Источники Нахождение в природе Строение молекулы Классификация комплексных ионов Номенклатура Химические свойства Применение
- 4. Комплексное соединение Главная называют сложное соединение, образующееся при взаимодействии более простых неизменных частиц (атомов, ионов или
- 5. Главная Комплексообразователь обычно является катион (центральный ион) или нейтральный атом (центральный атом). Наиболее типичными комплексообразователями являются
- 6. Главная Координационное число количество лигандов, которые может присоединять комплексообразователь [Cu(NH3)4](OH)2 K2[HgI4]
- 7. Главная Лиганд [Cu(NH3)4](OH)2 K2[HgI4] расположено (координировано) определенное число ионов или полярных молекул вокруг центрального иона (атома)–комплексообразователя
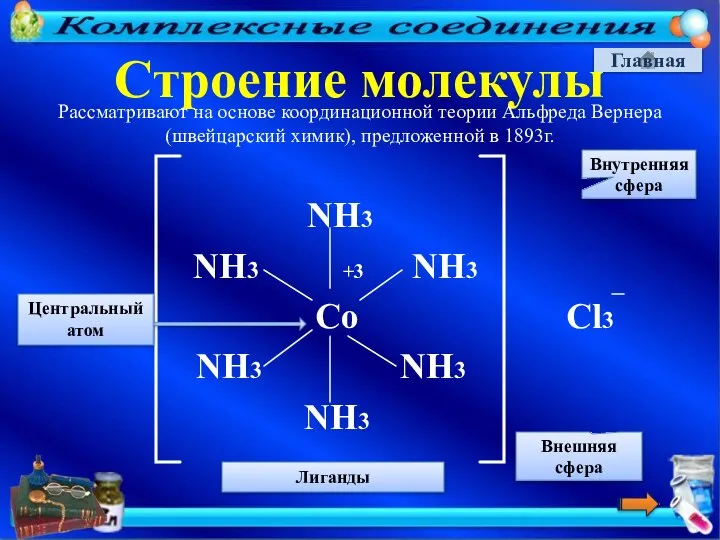
- 8. Главная Внутренняя координационная сфера [Cu(NH3)4](OH)2 K2[HgI4] Центральный ион (атом) с лигандами образует внутреннюю координационную сферу соединения,
- 9. Главная Внешняя координационная сфера [Cu(NH3)4](OH)2 K2[HgI4] Ионы, которые располагаются на более далеком расстоянии от комплексообразователя
- 10. Главная Нахождение в природе Гемоглобин Хлорофилл Ферменты
- 11. Главная Строение молекулы NH3 NH3 +3 NH3 Co Cl3 NH3 NH3 NH3 Внутренняя сфера Внешняя сфера
- 12. Главная
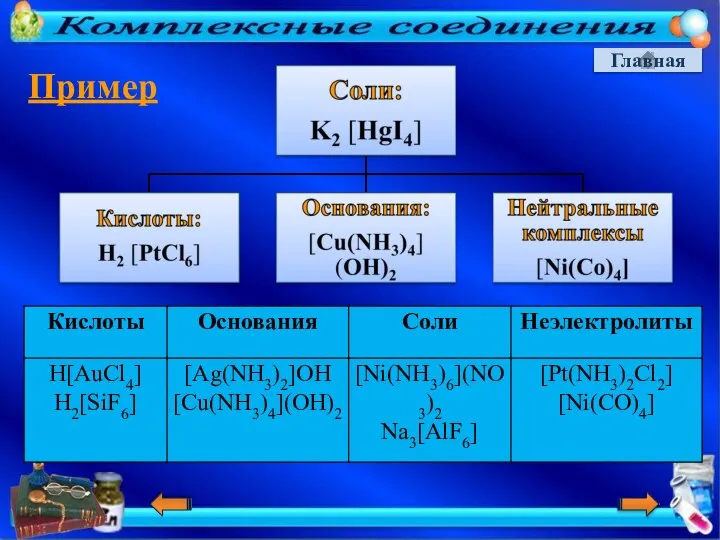
- 13. Главная Пример
- 14. Лигандами могут быть: а) полярные молекулы NH3, H2O, CO, NO. б) простые ионы F-, Cl-, Br-,
- 15. Главная Координационные соединения образованы металлами побочных подгрупп, имеющими, как правило, незавершенный d - уровень. Метод валентных
- 16. Главная Строение молекулы Для образования прочных связей внутри комплексного соединения энергетически выгодно освободить две d-орбитали спариванием
- 17. Главная Классификация комплексных ионов по заряду комплексов: катионные - [Ni(NH3)4]2+ анионные - [Co(CN)6 ]3- нейтральные -
- 18. Главная Классификация комплексных ионов б)по составу и химическим свойствам: кислоты - H[AuCl4] основания - [Ag(NH3)2]OH соли
- 19. Главная Классификация комплексных ионов в)по типу лигандов: гидроксокомплексы - K2[Zn(OH)4] аквакомплексы - [Fe(H2O)6]Cl3 ацидокомплексы (лиганды -
- 20. Главная Химические свойства Диссоциация (первичная) комплексных соединений K4[Fe(CN)6] → 4K+ + [Fe(CN)6]4- K3[Cr(OH)6] → 3K+ +
- 21. Главная Номенклатура Названия комплексов строятся по общим правилам IUPAC: читаются и записываются справа налево лиганды -
- 22. В соединении сначала называют анион, а затем катион. При указании внутренней сферы прежде всего называют анионы,
- 23. Главная НАЗВАНИЯ КОМПЛЕКСНЫХ АНИОНОВ: Fe - феррат Cu - купрат Ag - аргентат Au - аурат
- 25. Скачать презентацию




2 K2[HgI4]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1396850/slide-5.jpg)
2 K2[HgI4] расположено (координировано) определенное число ионов или полярных молекул вокруг центрального иона (атома)–комплексообразователя](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1396850/slide-6.jpg)
2 K2[HgI4] Центральный ион (атом) с лигандами](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1396850/slide-7.jpg)
2 K2[HgI4] Ионы, которые располагаются на более далеком расстоянии от комплексообразователя](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1396850/slide-8.jpg)





![Главная Классификация комплексных ионов по заряду комплексов: катионные - [Ni(NH3)4]2+ анионные](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1396850/slide-16.jpg)

![Главная Классификация комплексных ионов в)по типу лигандов: гидроксокомплексы - K2[Zn(OH)4] аквакомплексы](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1396850/slide-18.jpg)
![Главная Химические свойства Диссоциация (первичная) комплексных соединений K4[Fe(CN)6] → 4K+ +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1396850/slide-19.jpg)



 Презентация ИЗВЕСТНЯК
Презентация ИЗВЕСТНЯК  Көмірдің оптикалық қасиеттері
Көмірдің оптикалық қасиеттері Неорганические вещества
Неорганические вещества Хром. Соединения хрома
Хром. Соединения хрома Суды залалсыздандыру әдістері
Суды залалсыздандыру әдістері Сплав Вуда
Сплав Вуда Турнир юных химиков
Турнир юных химиков Ковалентная химическая связь
Ковалентная химическая связь Геохимия, как наука
Геохимия, как наука Дослідження на тему: Повітря Христинівщини За проектом “Екологічна ситуація у рідному місті”
Дослідження на тему: Повітря Христинівщини За проектом “Екологічна ситуація у рідному місті” Смоги и их влияние на человека
Смоги и их влияние на человека Значення хімічних процесів у природі
Значення хімічних процесів у природі Соединения серы. Серная кислота. Важнейшие соединения серы
Соединения серы. Серная кислота. Важнейшие соединения серы Генетическая связь между классами неорганических веществ Урок химии. Учитель: Антонова Е.Л.
Генетическая связь между классами неорганических веществ Урок химии. Учитель: Антонова Е.Л. Простые и сложные вещества Моцепуро Иван Класс 10 «а» Учитель: Макарова Е. И.
Простые и сложные вещества Моцепуро Иван Класс 10 «а» Учитель: Макарова Е. И. Классификация кристаллов по силам связи
Классификация кристаллов по силам связи Поверхностно-активные полимеры. Лекция 10
Поверхностно-активные полимеры. Лекция 10 Определение магматических пород без микроскопа
Определение магматических пород без микроскопа Моделирование химико-технологических процессов
Моделирование химико-технологических процессов Углеводы (сахара). Строение, свойства, участие в функционировании живых систем
Углеводы (сахара). Строение, свойства, участие в функционировании живых систем Металы. Общая характеристика металлов. Физические свойства и применение металлов.
Металы. Общая характеристика металлов. Физические свойства и применение металлов. Бетаин (триметилглицин)
Бетаин (триметилглицин) Насыщенные углеводороды. (Тема 1.1)
Насыщенные углеводороды. (Тема 1.1) Процессы подготовки газа к транспорту
Процессы подготовки газа к транспорту Вода и здоровье
Вода и здоровье Лекция 2. Строение атома и Периодический закон Д.И. Менделеева
Лекция 2. Строение атома и Периодический закон Д.И. Менделеева Тесты по химии (ответы)
Тесты по химии (ответы) Атыраудағы химиялық өндіріс кәсіп орындары
Атыраудағы химиялық өндіріс кәсіп орындары