Применение
в металло- и деревообработке, текстильной, лакокрасочной, нефтегазовой промышленностях
для травления железа
и стали и в качестве очищающих агентов перед сваркой, металлизацией, окраской или гальванической обработкой;
соляная кислота применяется для:
очищения руд олова и тантала,
производства патоки из крахмала,
удаления накипи с котлов и теплообменного оборудования ТЭЦ,
в качестве дубильного вещества в кожевенной промышленности.
4. азотная кислота применяется :
в качестве удобрения,
в производстве взрывчатых веществ,
процессах органического синтеза,
в металлургии,
при флотации руды,
переработки отработанного ядерного топлива.
ортофосфорная кислота применяется :
при производстве минеральных удобрений,
при пайке в качестве флюса (по окисленой меди, по чёрному металлу, по нержавеющей стали),
как составная часть ингибиторов коррозии и фреонов.












 Общая химия, понятия
Общая химия, понятия Алюминий. Строение и свойства атома
Алюминий. Строение и свойства атома Производные галогенуглеводородов жирного ряда, спиртов, простых и сложных эфиров, альдегидов
Производные галогенуглеводородов жирного ряда, спиртов, простых и сложных эфиров, альдегидов Фазовая диаграмма GaAs. Ретроградная растворимость. Селективная летучесть мышьяка из расплава. Методы борьбы с этими проблемами
Фазовая диаграмма GaAs. Ретроградная растворимость. Селективная летучесть мышьяка из расплава. Методы борьбы с этими проблемами Микроцентрифуги для выделения ДНК в ПЦР
Микроцентрифуги для выделения ДНК в ПЦР Презентация по Химии "«Медь»" - скачать смотреть _
Презентация по Химии "«Медь»" - скачать смотреть _ Химические элементы. Относительная атомная масса химических элементов
Химические элементы. Относительная атомная масса химических элементов Хімічний елемент Радій
Хімічний елемент Радій Аттестационная работа. Методика исследовательской деятельности учащихся. Химическое знание, 10 -11 классы
Аттестационная работа. Методика исследовательской деятельности учащихся. Химическое знание, 10 -11 классы Обобщение знаний по химии за курс основной школы
Обобщение знаний по химии за курс основной школы Общие способы получения металлов
Общие способы получения металлов Полупроводниковые твердые растворы
Полупроводниковые твердые растворы Типы химических реакций в органической химии. Типы реакций в органике
Типы химических реакций в органической химии. Типы реакций в органике Вклад М.В. Ломоносова в дидактику химии
Вклад М.В. Ломоносова в дидактику химии Строение электронных оболочек атомов. Урок 14. Орбитально-планетарная модель
Строение электронных оболочек атомов. Урок 14. Орбитально-планетарная модель Углерод и кремний
Углерод и кремний Биохимические изменения компонентов молока в процессе переработки
Биохимические изменения компонентов молока в процессе переработки Тема урока: Сложные эфиры. Цель урока: Рассказать учащимся о строении, получении и свойствах сложных эфиров. Познакомить с примен
Тема урока: Сложные эфиры. Цель урока: Рассказать учащимся о строении, получении и свойствах сложных эфиров. Познакомить с примен Презентация на тему Спирты Классификация, физические и химические свойства, изомерия
Презентация на тему Спирты Классификация, физические и химические свойства, изомерия  Белки. Строение аминокислот
Белки. Строение аминокислот Піридин. Способи добування та застосування
Піридин. Способи добування та застосування  Табличный способ решения задач на смеси и сплавы
Табличный способ решения задач на смеси и сплавы Лекция 5. Красные пигменты
Лекция 5. Красные пигменты Анализ качества лекарственных средств количественно определяемых методом редоксиметрии. Препараты серы и мышьяка
Анализ качества лекарственных средств количественно определяемых методом редоксиметрии. Препараты серы и мышьяка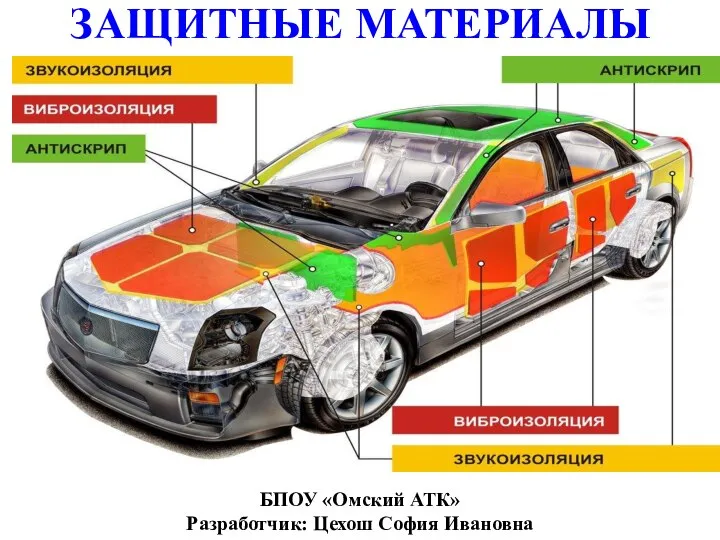 Защитные материалы
Защитные материалы Найважливіші мікробіологічні процеси, збудники яких є мікроорганізми
Найважливіші мікробіологічні процеси, збудники яких є мікроорганізми Хімічні зсуви сигналів ямр
Хімічні зсуви сигналів ямр Физика, химия и диагностика поверхности
Физика, химия и диагностика поверхности