Содержание
- 2. Неметаллы H He, Ne, Ar, Kr, Xe, Rn F, Cl, Br, I, At O, S, Se,
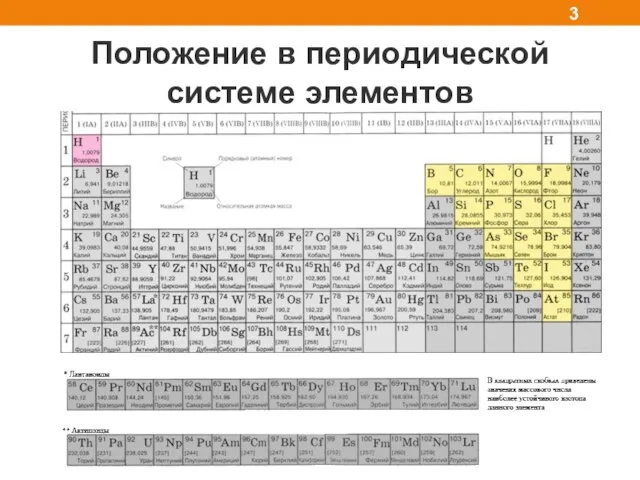
- 3. Положение в периодической системе элементов
- 4. Важнейшие свойства элементов Атомный радиус, нм (Å). Потенциал ионизации, I, эВ (кДж/моль). Сродство к электрону, Аē,
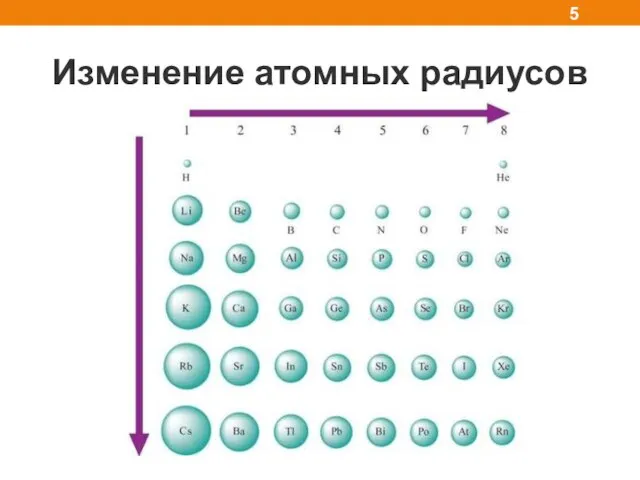
- 5. Изменение атомных радиусов
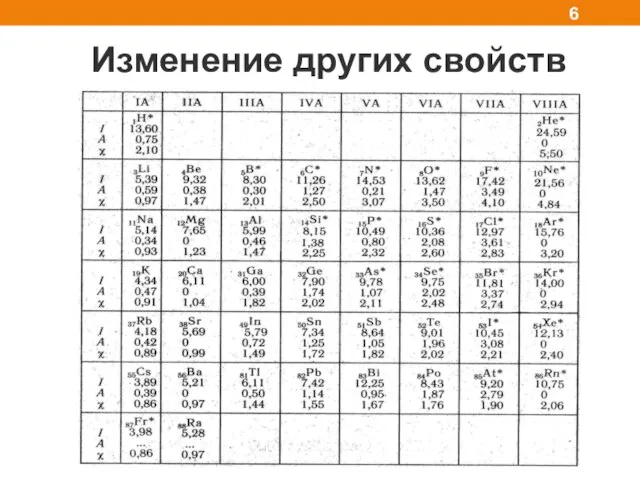
- 6. Изменение других свойств
- 7. Шкала электроотрицательности
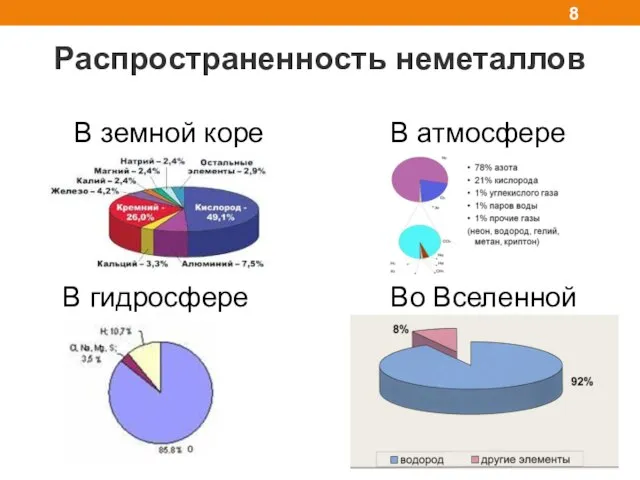
- 8. Распространенность неметаллов В земной коре В атмосфере В гидросфере Во Вселенной
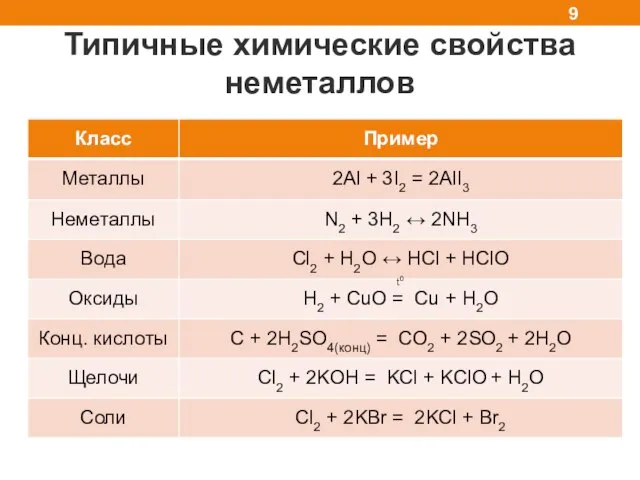
- 9. Типичные химические свойства неметаллов t0
- 10. Водород: положение в ПСХЭ 1H 1s1
- 11. Водород: физические свойства и нахождение в природе 1. Газ, бесцветный, без вкуса, без запаха. 2. Растворимость
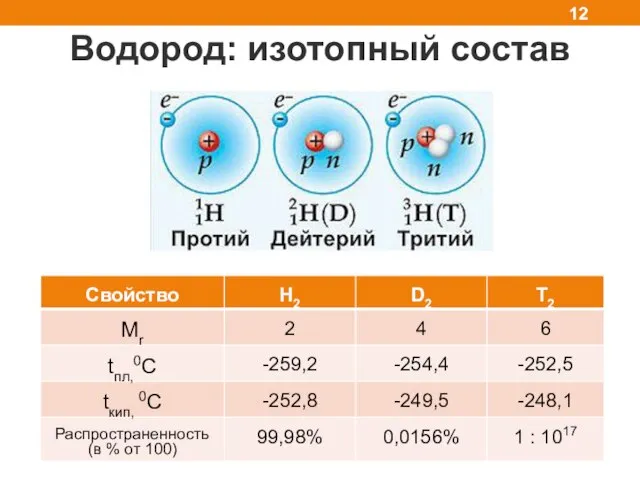
- 12. Водород: изотопный состав
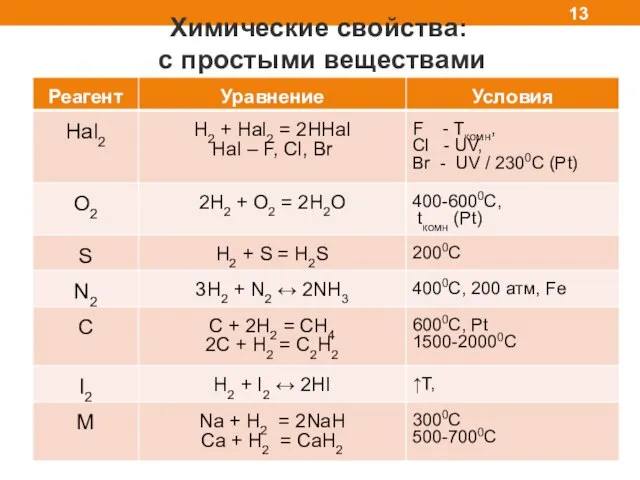
- 13. Химические свойства: с простыми веществами
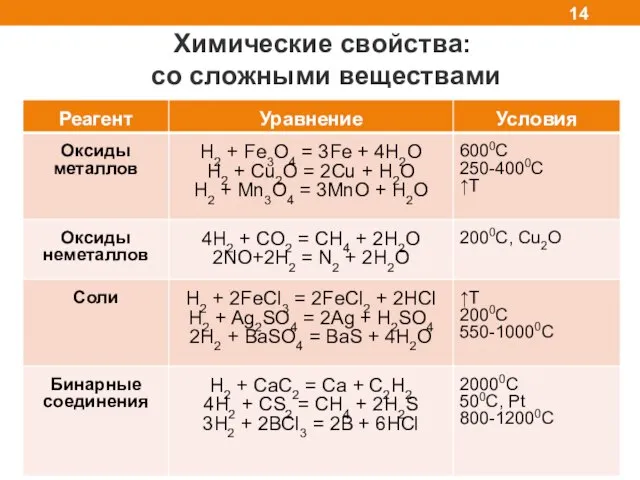
- 14. Химические свойства: со сложными веществами
- 15. Химические свойства: атомарный водород Cильный восстановитель!!! 2CrCl3 + 2HCl + 2Zn = 2CrCl2 + 2ZnCl2 +
- 16. Получение водорода
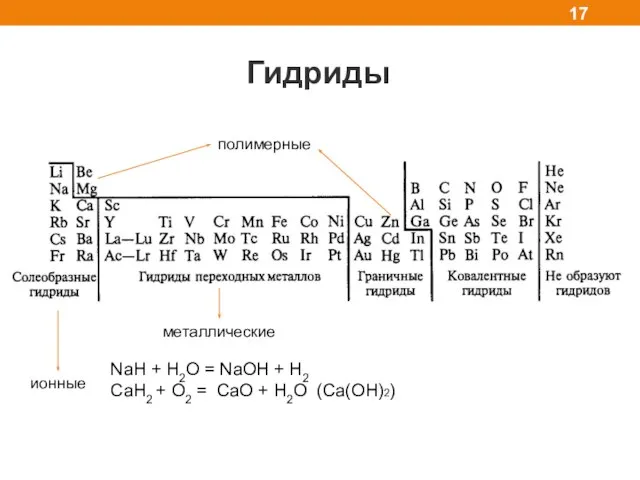
- 17. Гидриды металлические полимерные ионные NaH + H2O = NaOH + H2 CaH2 + O2 = CaO
- 18. Вода: типичные свойства PHal3 + 3H2O = H3PO3 + 3HHal↑
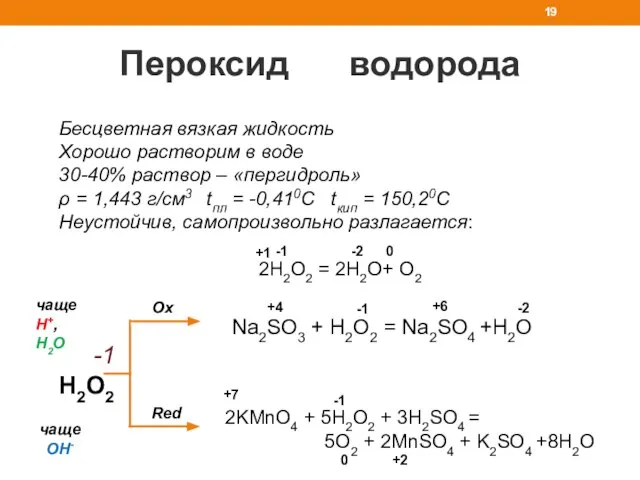
- 19. Пероксид водорода Бесцветная вязкая жидкость Хорошо растворим в воде 30-40% раствор – «пергидроль» ρ = 1,443
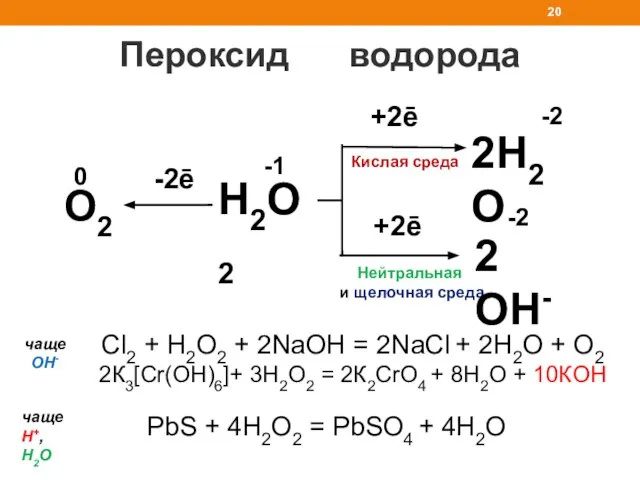
- 20. Пероксид водорода 2H2O +2ē +2ē Нейтральная и щелочная среда Кислая среда -2 H2O2 2 OH- -1
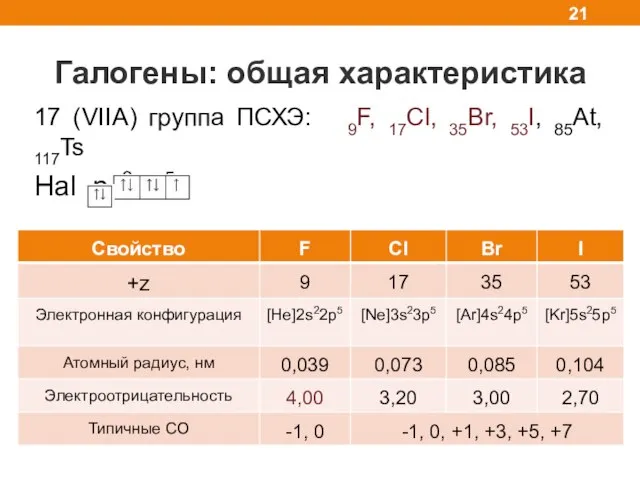
- 21. Галогены: общая характеристика 17 (VIIA) группа ПСХЭ: 9F, 17Cl, 35Br, 53I, 85At, 117Ts Hal ns2np5
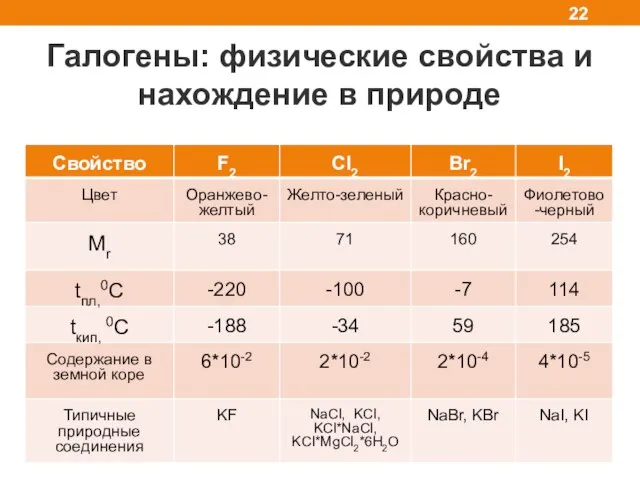
- 22. Галогены: физические свойства и нахождение в природе
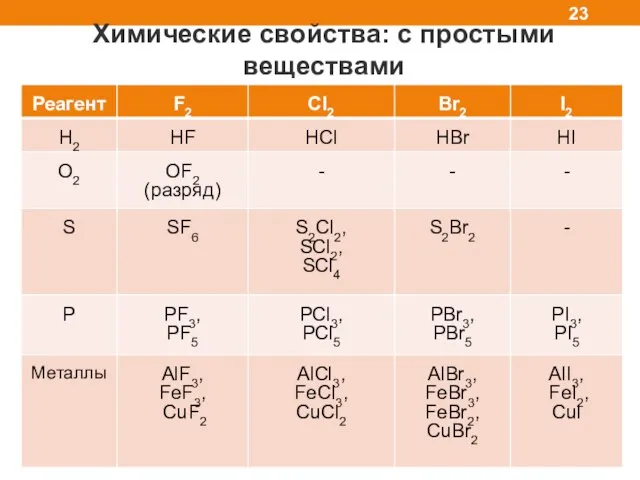
- 23. Химические свойства: с простыми веществами
- 24. Взаимодействие с водой
- 25. Взаимодействие со сложными веществами
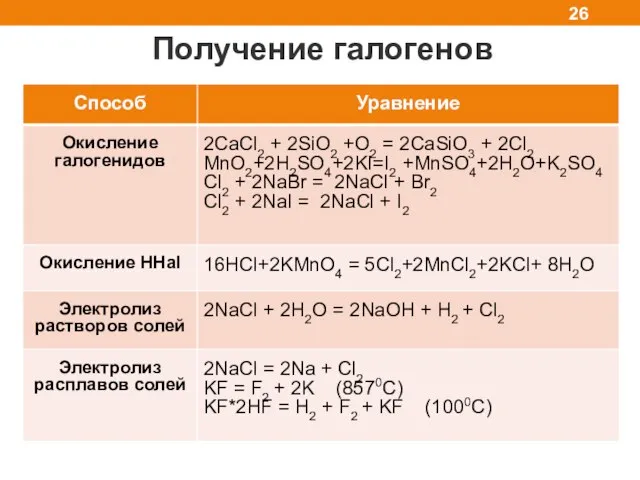
- 26. Получение галогенов
- 27. Соединения галогенов HНal – бесцветные газы, хорошо растворимы в воде 1 V H2O – 507 V
- 28. Свойства HHal
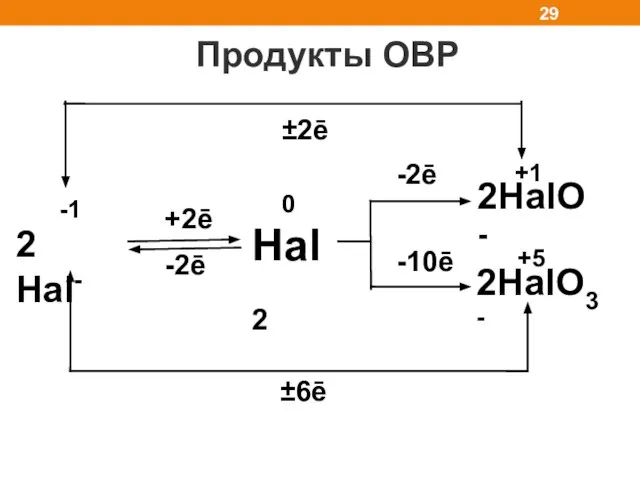
- 29. Продукты ОВР 2 Hal- -1 +2ē -2ē Hal2 2HalO- 2HalO3- 0 +5 +1 -2ē -10ē ±2ē
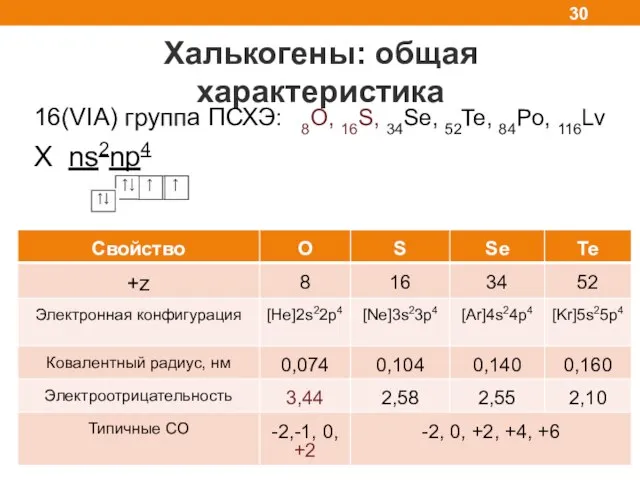
- 30. Халькогены: общая характеристика 16(VIA) группа ПСХЭ: 8O, 16S, 34Se, 52Te, 84Po, 116Lv X ns2np4
- 31. Физические свойства
- 32. Нахождение в природе Кислород – основной элемент биосферы Сера Содержание серы в земной коре: 4,8*10-3 %
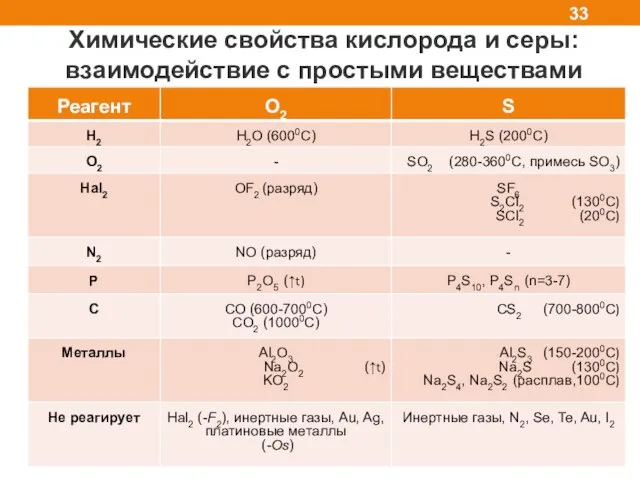
- 33. Химические свойства кислорода и серы: взаимодействие с простыми веществами
- 34. Химические свойства кислорода и серы: взаимодействие со сложными веществами
- 35. Получение серы и кислорода O2 S
- 36. Соединения серы. Сероводород H2S – бесцветный газ, характерный неприятный запах 100 г H2O – 2,58V H2S
- 37. Свойства H2S
- 38. Свойства H2S
- 39. Соединения серы. Оксиды серы
- 40. Свойства SO2 и сернистой кислоты
- 41. Свойства SO2 и сернистой кислоты
- 42. Свойства SO3
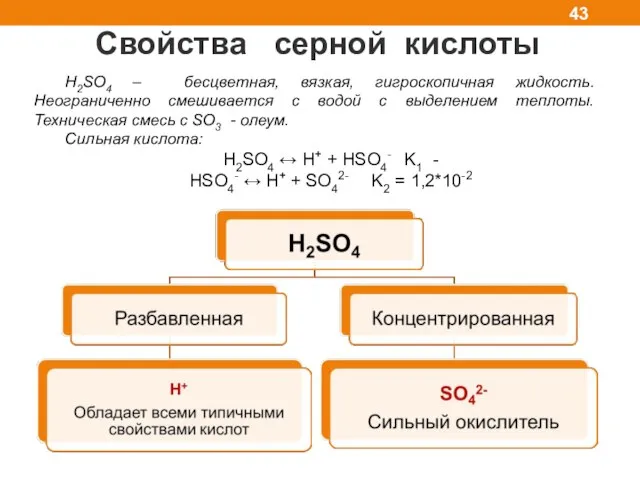
- 43. Свойства серной кислоты H2SO4 – бесцветная, вязкая, гигроскопичная жидкость. Неограниченно смешивается с водой с выделением теплоты.
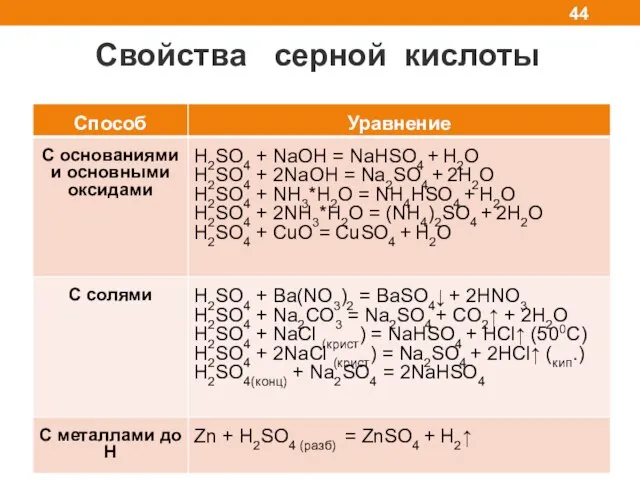
- 44. Свойства серной кислоты
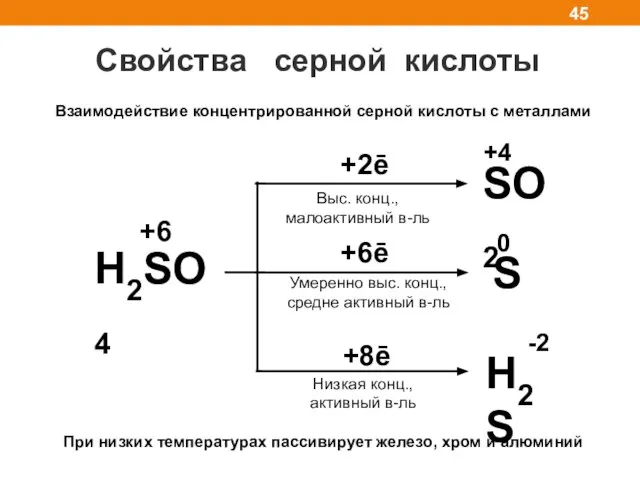
- 45. Свойства серной кислоты Взаимодействие концентрированной серной кислоты с металлами H2SO4 SO2 +4 +2ē +6ē -2 S
- 46. Свойства серной кислоты
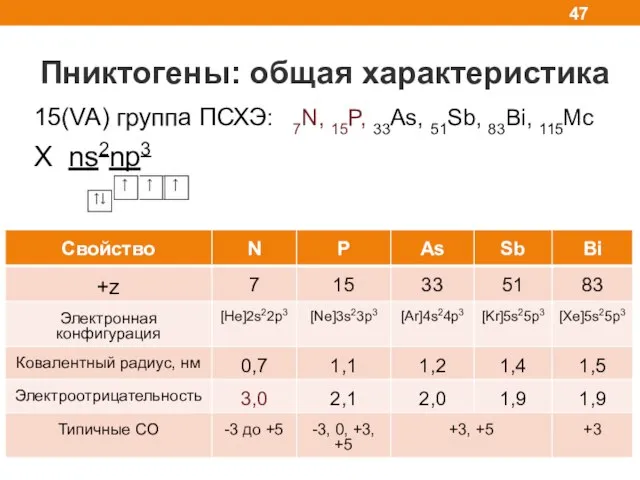
- 47. Пниктогены: общая характеристика 15(VA) группа ПСХЭ: 7N, 15P, 33As, 51Sb, 83Bi, 115Mc X ns2np3
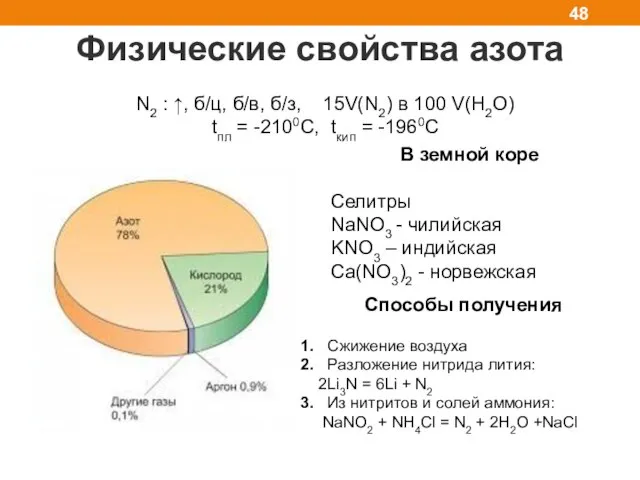
- 48. Физические свойства азота N2 : ↑, б/ц, б/в, б/з, 15V(N2) в 100 V(H2O) tпл = -2100С,
- 49. Физические свойства фосфора
- 50. Получение фосфора Содержание в земной коре: 0,04 атомных % (0,1 масс. %) Минералы: 1) Апатиты: Гидроксоапатит
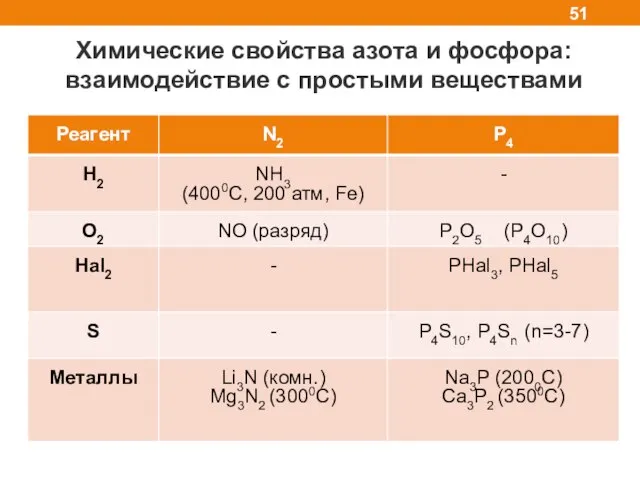
- 51. Химические свойства азота и фосфора: взаимодействие с простыми веществами
- 52. Взаимодействие со сложными веществами
- 53. Водородные соединения азота и фосфора NH3 и РН3 – бесцветные газы с резким запахом NH3 tпл
- 54. Свойства аммиака и фосфина
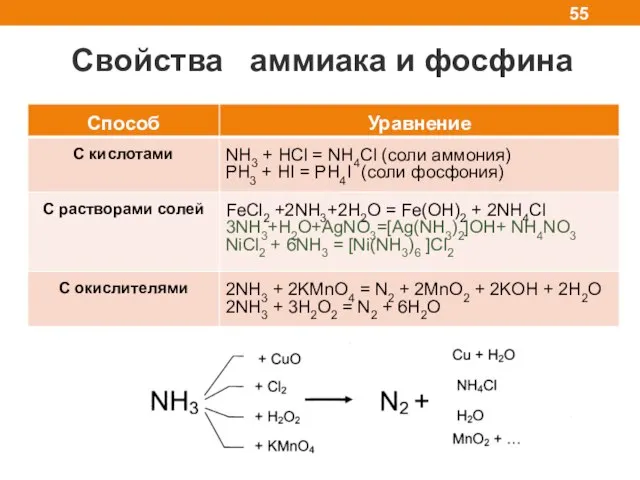
- 55. Свойства аммиака и фосфина
- 56. Оксиды азота и фосфора
- 57. Свойства азотистой кислоты и нитритов HNO2 – существует только в растворах. Получение: Ba(NO2)2 + H2SO4 =
- 58. Свойства азотной кислоты HNO3 – бесцветная, летучая жидкость. При переливании на воздухе образует туман – «дымящая
- 59. Свойства азотной кислоты: взаимодействие с неметаллами и их соединениями P(красн) + 5HNO3 (конц) = 4H3PO4 +
- 60. Свойства азотной кислоты: взаимодействие с металлами Cu + 4HNO3(60-68%) = Cu(NO3)2 + 2NO2 + 2H2O (Mg,
- 61. Свойства кислот фосфора 6NO2+2H2O (кип. H3PO4 Кристаллическое белое вещество, гигроскопичное, хорошо растворимо в воде, разлагается при
- 62. Химические свойства ортофосфорной кислоты 6NO2+2H2O (кип.
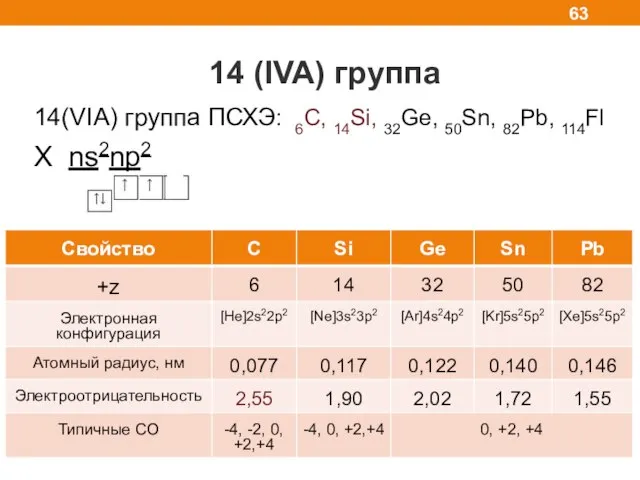
- 63. 14 (IVA) группа 14(VIA) группа ПСХЭ: 6С, 14Si, 32Ge, 50Sn, 82Pb, 114Fl X ns2np2
- 64. Углерод: нахождение в природе По содержанию в земной коре – на 17 месте
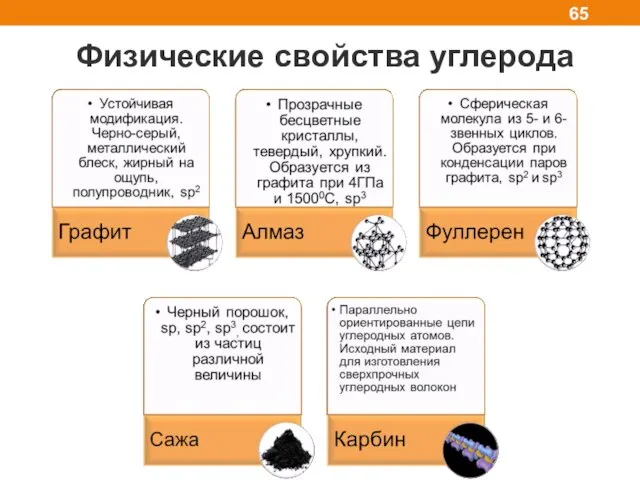
- 65. Физические свойства углерода
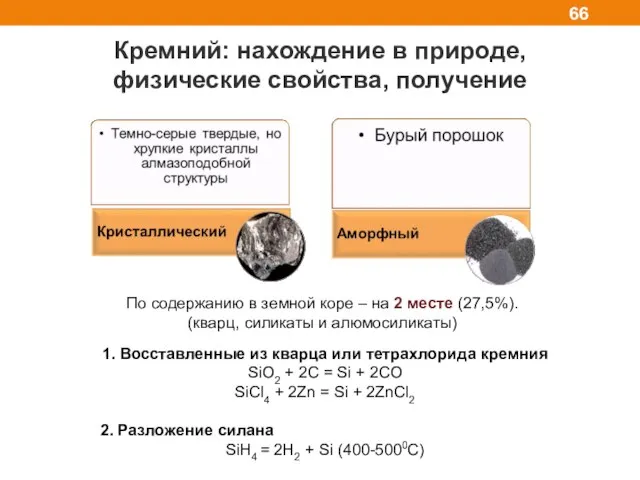
- 66. Кремний: нахождение в природе, физические свойства, получение По содержанию в земной коре – на 2 месте
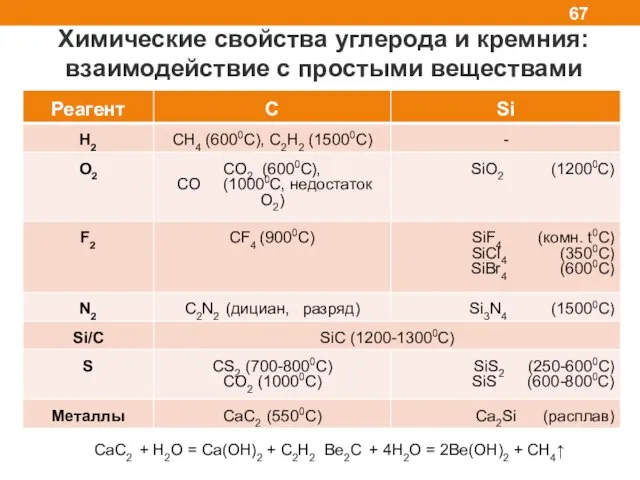
- 67. Химические свойства углерода и кремния: взаимодействие с простыми веществами CaC2 + H2O = Ca(OH)2 + C2H2
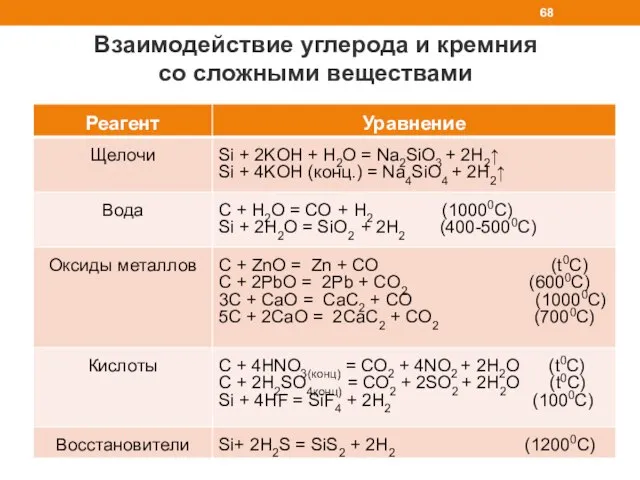
- 68. Взаимодействие углерода и кремния со сложными веществами
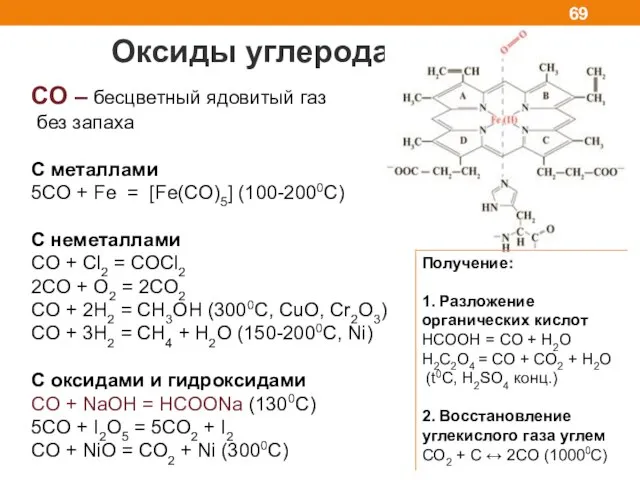
- 69. Оксиды углерода CO – бесцветный ядовитый газ без запаха C металлами 5CO + Fe = [Fe(CO)5]
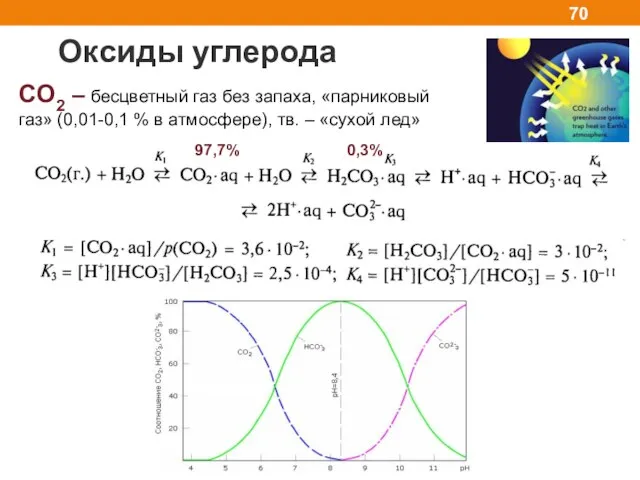
- 70. Оксиды углерода CO2 – бесцветный газ без запаха, «парниковый газ» (0,01-0,1 % в атмосфере), тв. –
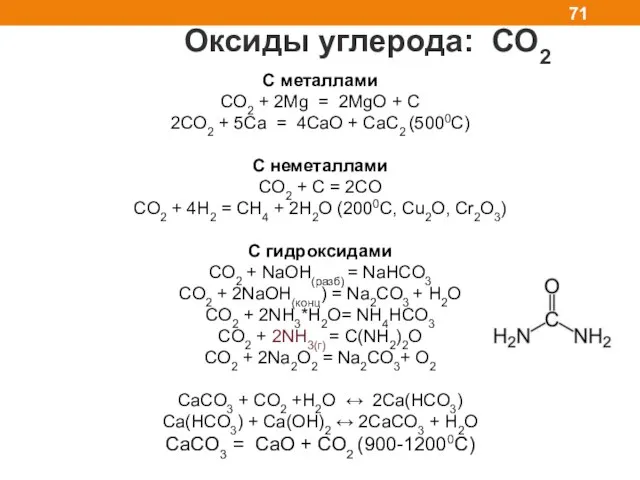
- 71. Оксиды углерода: СО2 C металлами CO2 + 2Mg = 2MgO + C 2CO2 + 5Сa =
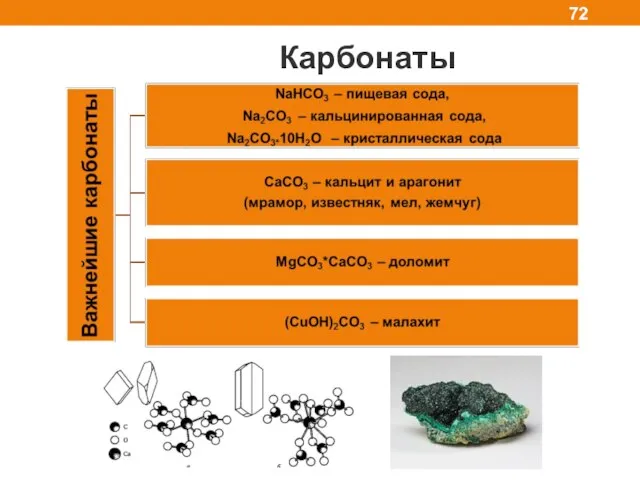
- 72. Карбонаты
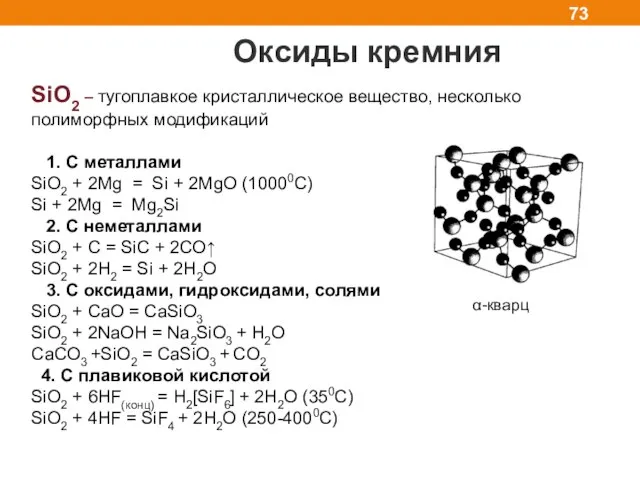
- 73. Оксиды кремния SiO2 – тугоплавкое кристаллическое вещество, несколько полиморфных модификаций 1. C металлами SiO2 + 2Mg
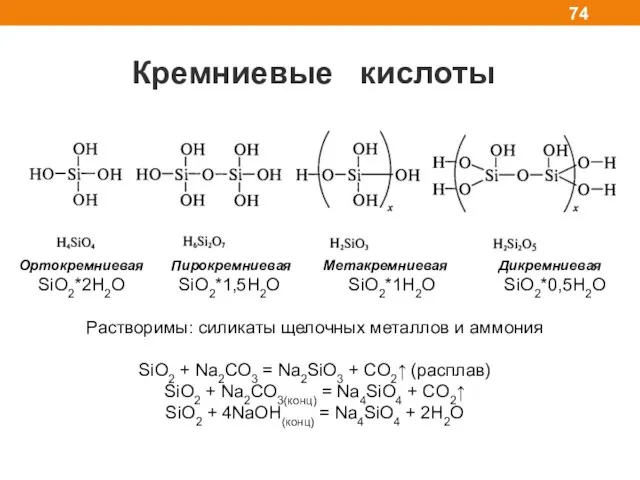
- 74. Кремниевые кислоты Ортокремниевая Пирокремниевая Метакремниевая Дикремниевая SiO2*2H2O SiO2*1,5H2O SiO2*1H2O SiO2*0,5H2O Растворимы: силикаты щелочных металлов и аммония
- 76. Скачать презентацию





































 Хімічні добавки. Е-числа
Хімічні добавки. Е-числа Тотығу-тотықсыздану реакциялары Атырау ХББ НЗМ Косанов Р.П. Химия пәні мұғалімі
Тотығу-тотықсыздану реакциялары Атырау ХББ НЗМ Косанов Р.П. Химия пәні мұғалімі Карбоновые кислоты. Изомерия. Физические, химические свойства. Получение, применение
Карбоновые кислоты. Изомерия. Физические, химические свойства. Получение, применение Пластичний обмін
Пластичний обмін  Основания LiOH - гидроксид лития
Основания LiOH - гидроксид лития Презентация по Химии "Уравнения окислительно- восстановительных реакций" - скачать смотреть
Презентация по Химии "Уравнения окислительно- восстановительных реакций" - скачать смотреть  Биохимия нервной ткани. Биологические мембраны
Биохимия нервной ткани. Биологические мембраны амины 10 класс
амины 10 класс Поверхневі явища. Адсорбція
Поверхневі явища. Адсорбція Водородные соединения неметаллов
Водородные соединения неметаллов Аттестационная работа: Сравнение показателей качества меда разных производителей
Аттестационная работа: Сравнение показателей качества меда разных производителей Уравнение температурного режима реактора
Уравнение температурного режима реактора Хімія і медицина
Хімія і медицина  Предельные углеводороды и их галогенопроизводные. Спирты, эфиры, альдегиды и их производные
Предельные углеводороды и их галогенопроизводные. Спирты, эфиры, альдегиды и их производные Окислительно-восстановительные реакции Миронова Елена Анатольевна учитель химии МБОУ СОШ №7 г. Дубна Московской области 2013 го
Окислительно-восстановительные реакции Миронова Елена Анатольевна учитель химии МБОУ СОШ №7 г. Дубна Московской области 2013 го Физические и химические свойства алмаза. Алмазная промышленность в России
Физические и химические свойства алмаза. Алмазная промышленность в России Производные фенола: танины
Производные фенола: танины Ферменты (энзимы). (Тема 4)
Ферменты (энзимы). (Тема 4) ПОЧЕМУ СОЛИ СОЛЕНЫЕ ?
ПОЧЕМУ СОЛИ СОЛЕНЫЕ ? Весь курс химии. Кратко
Весь курс химии. Кратко Проект: жило-было мыло
Проект: жило-было мыло Происхождение химических элементов
Происхождение химических элементов Распределительная хроматография
Распределительная хроматография Кислоты и основания
Кислоты и основания Технологии повышения конструкционной прочности сталей
Технологии повышения конструкционной прочности сталей Современные проблемы геологии. Изотопный взгляд на проблему
Современные проблемы геологии. Изотопный взгляд на проблему Гравиметрические методы анализа
Гравиметрические методы анализа Химическая организация клетки
Химическая организация клетки