Содержание
- 2. Причем атака нуклеофила по электронодефицитному (электрофильному) центру может завершаться присоединением реагента (AdN) или замещением уходящей группы
- 3. Мономолекулярный механизм SN1. Реализуется как диссоциативный процесс, протекающий с образованием трехкоординированного переходного комплекса: Его можно рассматривать
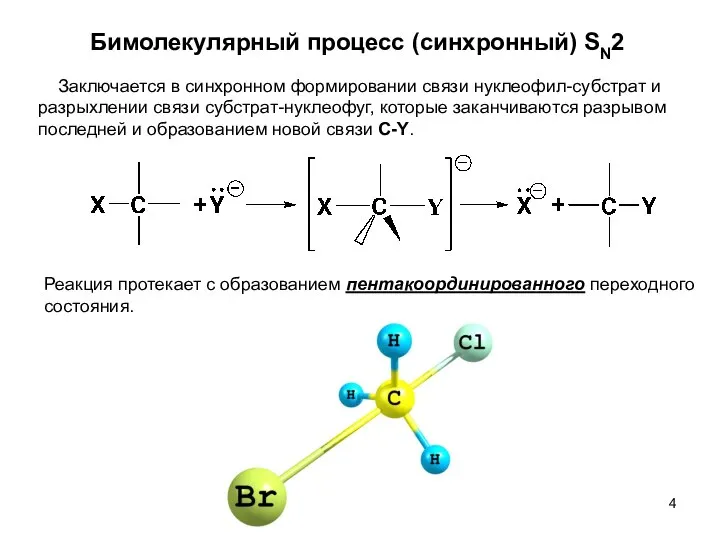
- 4. Бимолекулярный процесс (синхронный) SN2 Реакция протекает с образованием пентакоординированного переходного состояния. Заключается в синхронном формировании связи
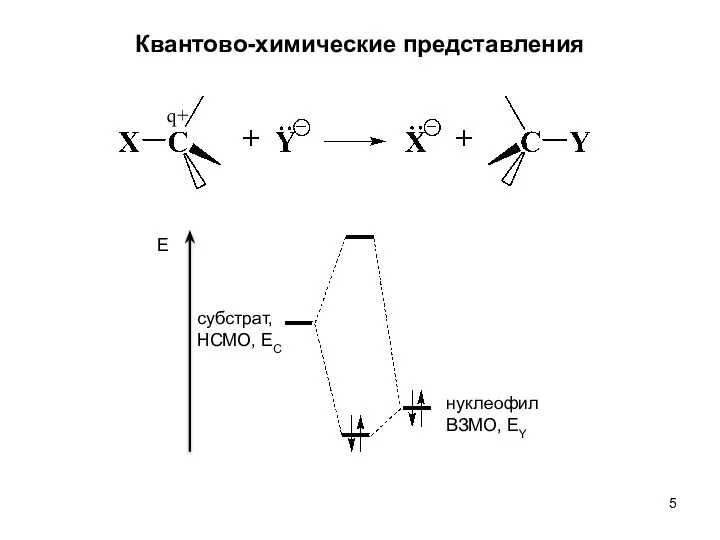
- 5. Квантово-химические представления q+ субстрат, НСМО, EC нуклеофил ВЗМО, EY Е
- 6. где qY и qС – заряды на реакционном центре нуклеофила Y (нуклеофильный центр) и атоме углерода
- 7. В том случае, когда доминирует вклад первой составляющей, говорят, что реакция идет при зарядовом контроле. Так,
- 8. Присутствие ЭА заместителей в молекуле субстрата увеличивает положительный заряд на его электрофильном центре, что сопровождается повышением
- 9. Реакции SN1 в алифатических соединениях На первом этапе происходит диссоциация молекулы субстрата с образованием карбокатиона: Затем
- 10. Факторы, стабилизирующие образующийся карбокатион, должны приводить к ускорению SN1. В связи с этим скорость реакции должна
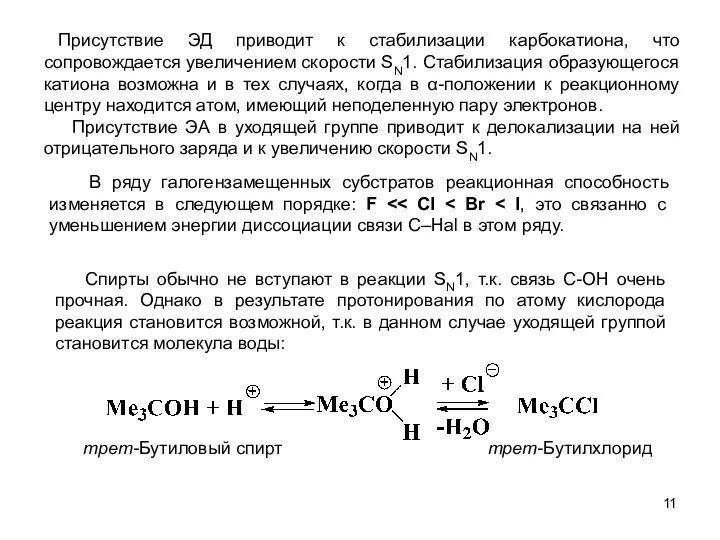
- 11. Присутствие ЭД приводит к стабилизации карбокатиона, что сопровождается увеличением скорости SN1. Стабилизация образующегося катиона возможна и
- 12. Влияние стерических факторов В TS, которое является карбокатионом, центральный атом углерода имеет sр2 гибридизацию: связи расположены
- 13. Участие соседних групп. Анхимерное содействие Присутствие в молекуле субстрата группировок, способных стабилизировать образующийся карбокатион за счет
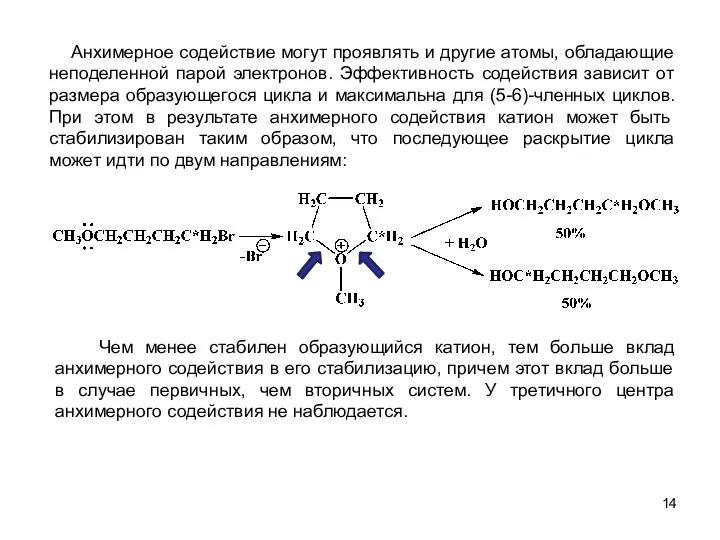
- 14. Анхимерное содействие могут проявлять и другие атомы, обладающие неподеленной парой электронов. Эффективность содействия зависит от размера
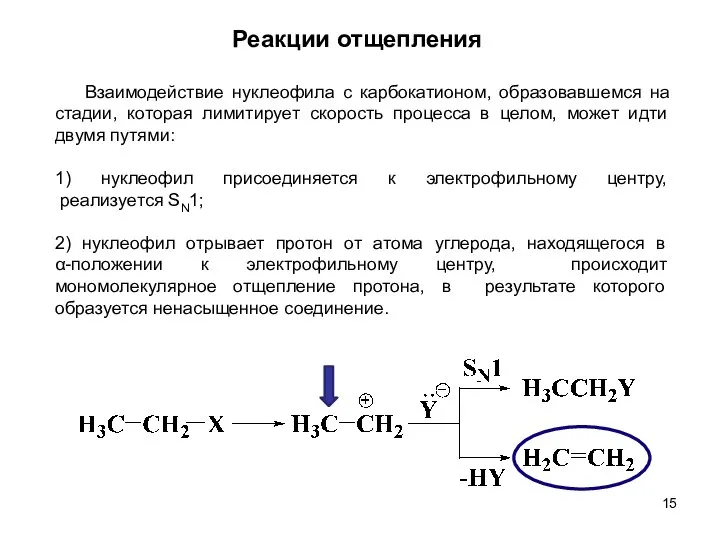
- 15. Реакции отщепления Взаимодействие нуклеофила с карбокатионом, образовавшемся на стадии, которая лимитирует скорость процесса в целом, может
- 17. Скачать презентацию









 Золь. Свойства золи
Золь. Свойства золи Теоретические основы химической технологии
Теоретические основы химической технологии Альдегиды. Формальдегид и его свойства. Получение, применение
Альдегиды. Формальдегид и его свойства. Получение, применение Экстракционные методы выделения продуктов микробиологического синтеза
Экстракционные методы выделения продуктов микробиологического синтеза Амфотерные оксиды и гидроксиды
Амфотерные оксиды и гидроксиды Мое любимое химическое вещество: Серебро
Мое любимое химическое вещество: Серебро Реакционная способность твердых тел и способы ее регулирования
Реакционная способность твердых тел и способы ее регулирования Синтез олиголактозаминов – лигандов галектинов
Синтез олиголактозаминов – лигандов галектинов Углерод и его оксиды Презентацию составила учитель МОУ «Ягринская гимназия» г.Северодвинска Шапошникова Т.С.
Углерод и его оксиды Презентацию составила учитель МОУ «Ягринская гимназия» г.Северодвинска Шапошникова Т.С.  Эксперимент. Качественная реакция на крахмал
Эксперимент. Качественная реакция на крахмал Химический состав клетки. Неорганические вещества
Химический состав клетки. Неорганические вещества Метод кислотноосновного титрования (Метод нейтрализации)
Метод кислотноосновного титрования (Метод нейтрализации) Класифікація розчинів. Осмос. Осмотичний тиск
Класифікація розчинів. Осмос. Осмотичний тиск Идеи и прогнозы Д. И. Менделеева в области улучшения плодородия почв.
Идеи и прогнозы Д. И. Менделеева в области улучшения плодородия почв. Углерод и его свойства
Углерод и его свойства Презентация по Химии "Ферменты" - скачать смотреть
Презентация по Химии "Ферменты" - скачать смотреть  Наноструктурированные тонкие пленки суперсплавов Mo, W и Re с 3d6-8 металлами
Наноструктурированные тонкие пленки суперсплавов Mo, W и Re с 3d6-8 металлами Партитуру химии надо не просто исполнить, ее надо сочинить! Жан-Мари Лен
Партитуру химии надо не просто исполнить, ее надо сочинить! Жан-Мари Лен Общая и неорганическая химия. Введение
Общая и неорганическая химия. Введение Воздух. Кислород. Горение. Работа выполнена: Учителем химии ГБОУ СОШ № 118 Выборгского района Санкт - Петербурга Тихомировой
Воздух. Кислород. Горение. Работа выполнена: Учителем химии ГБОУ СОШ № 118 Выборгского района Санкт - Петербурга Тихомировой Дисперсные системы. Поверхностная энергия
Дисперсные системы. Поверхностная энергия Основные понятия и законы химии
Основные понятия и законы химии Положение в ПСХЭ Д.И.Менделеева и строение атома
Положение в ПСХЭ Д.И.Менделеева и строение атома Аминокислоты и их производные
Аминокислоты и их производные Алканы. Пропан
Алканы. Пропан Белки - 4. Обмен сложных белков. Нуклеопротеиды
Белки - 4. Обмен сложных белков. Нуклеопротеиды Кальций хлорид
Кальций хлорид  Вибрационное устройство для выпуска связных, липких и слеживающихся материалов
Вибрационное устройство для выпуска связных, липких и слеживающихся материалов