Содержание
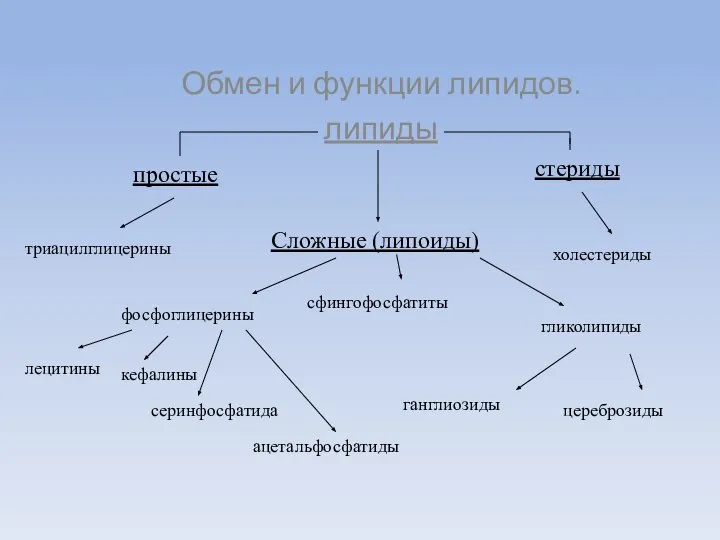
- 2. Обмен и функции липидов. липиды Сложные (липоиды) простые стериды холестериды триацилглицерины гликолипиды цереброзиды ганглиозиды сфингофосфатиты фосфоглицерины
- 3. Биологические функции липидов Липиды являются энергетическим материалом, выполняют защитные, пластические, транспортные и регуляторные функции. По физиологическому
- 4. Транспортные липиды Транспортные липиды - это липиды, находящиеся в комплексе с белками и доставляемые экстрацелюлярными жидкостными
- 5. Хиломикроны (ХМ) Хиломикроны (ХМ) формируются в стенке кишечника и отличаются от других транспортных липопротеинов самым высоким
- 6. ЛПОНП или пре-β-липопротеины ЛПОНП или пре-β-липопротеины, формируются в печени и частично в эпителиальных клетках тонкого кишечника.
- 7. ЛПНП или β- липопротеины ЛПНП или β- липопротеины образуются в крови из ЛПОНП и являются главной
- 8. ЛПВП или α-липопротеины ЛПВП или α-липопротеины, формируются в гепатоцитах и характеризуются высоким содержанием фосфолипидов (25-27%), холестеридов
- 9. Липиды кожи человека Большое количество разветвленных жирных кислот, как свободных, так и связанных присутствует среди многочисленных
- 10. Переваривание и всасывание продуктов переваривания липидов Содержание и разновидность липидов в пище зависит от употребляемых пищевых
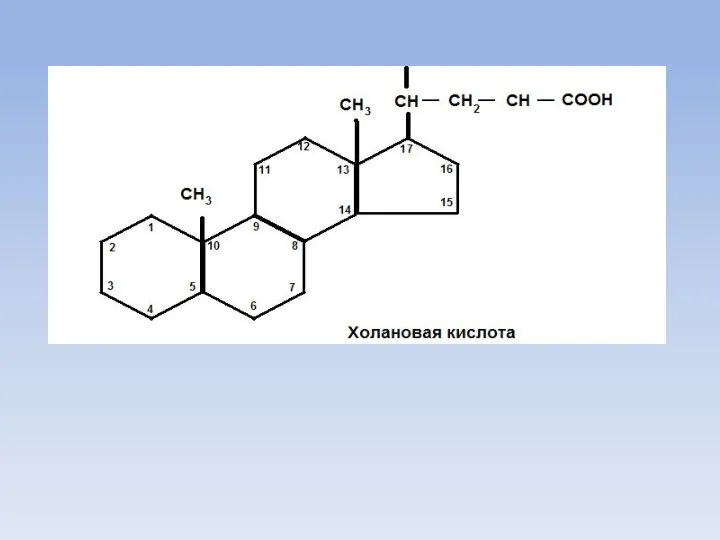
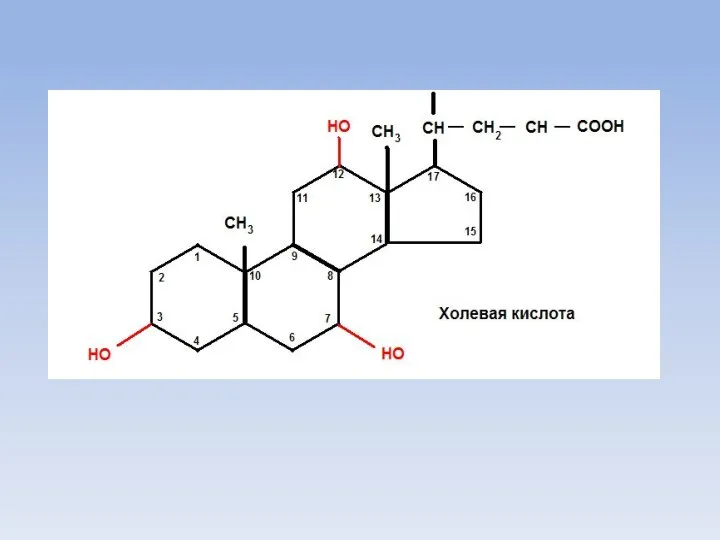
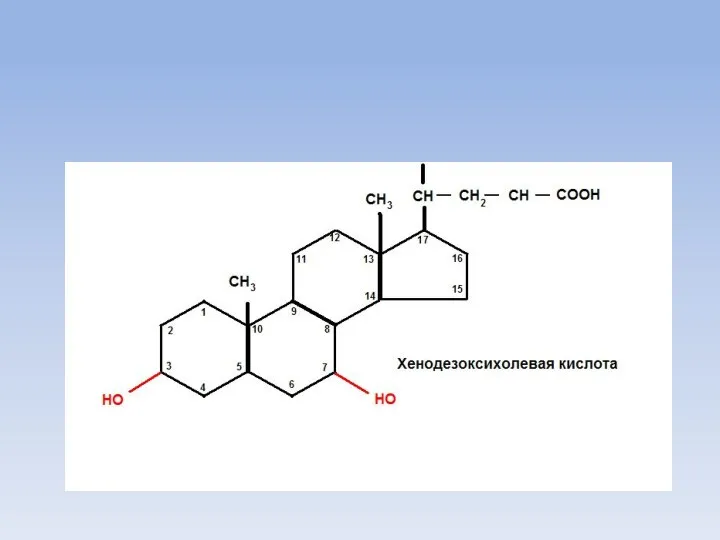
- 11. Желчные кислоты Обязательным условием для переваривания жиров является перевод их эмульгированное состояние с помощью желчных кислот.
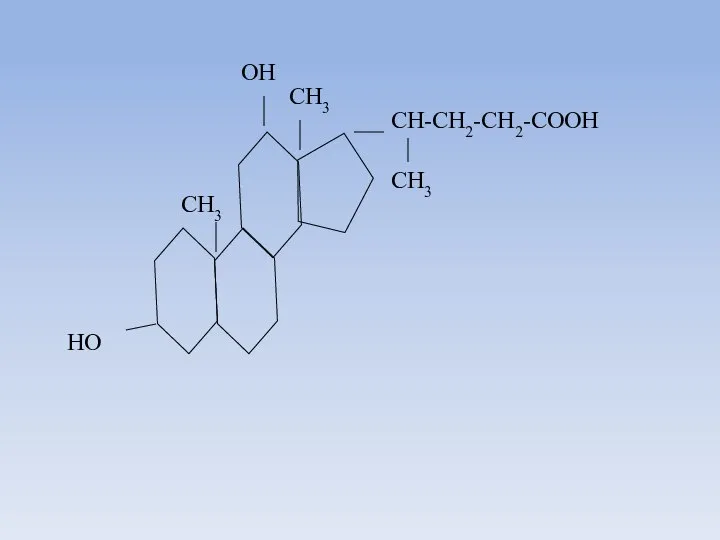
- 15. OH CH3 CH3 HO CH-CH2-CH2-COOH CH3
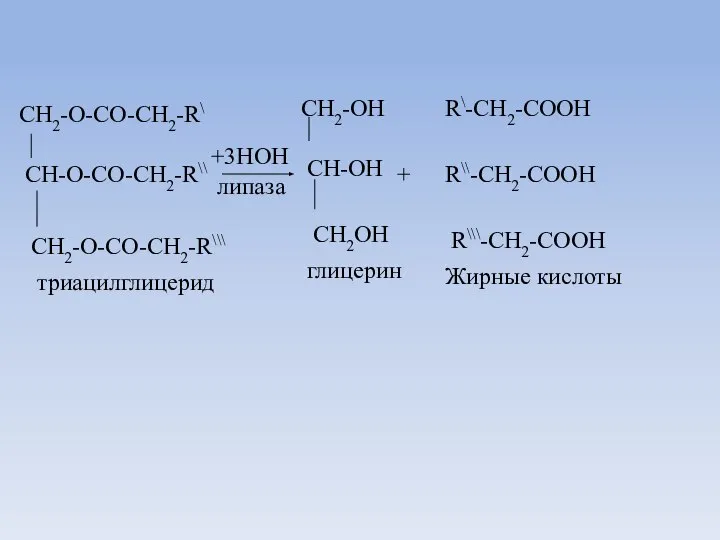
- 16. Переваривание триацилглицеридов
- 17. CH2-O-CO-CH2-R\ CH-O-CO-CH2-R\\ CH2-O-CO-CH2-R\\\ +3HOH липаза CH2-OH CH-OH CH2OH триацилглицерид глицерин + R\-CH2-COOH R\\-CH2-COOH R\\\-CH2-COOH Жирные кислоты
- 18. Переваривание фосфолипидов
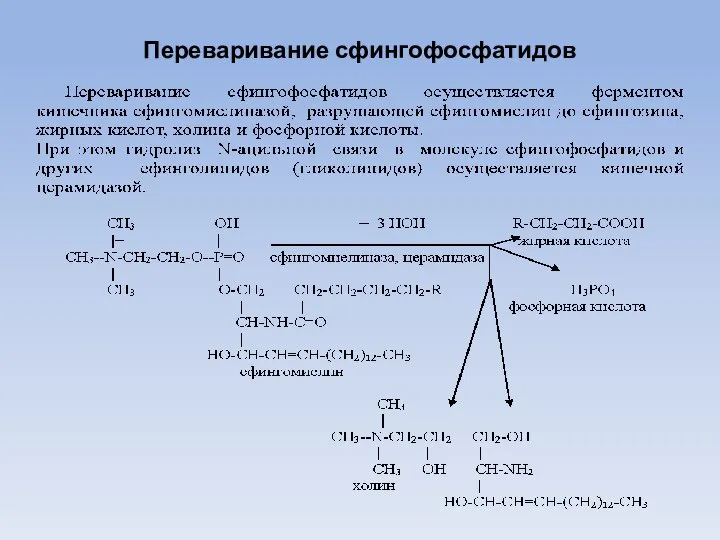
- 19. Переваривание сфингофосфатидов
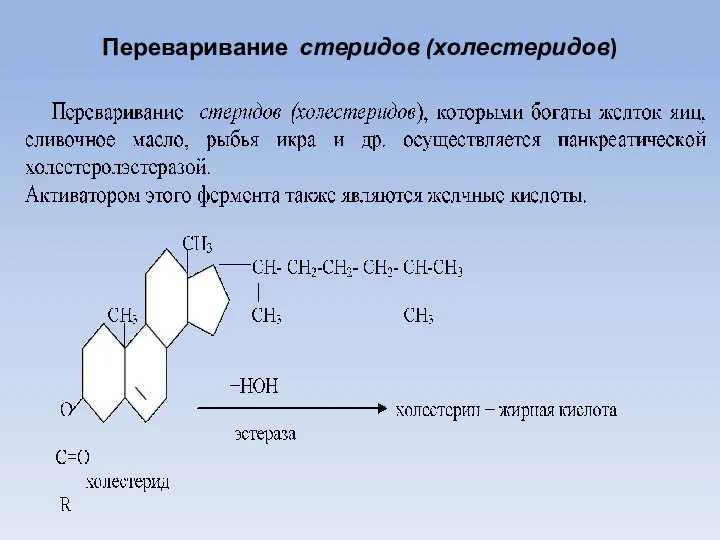
- 20. Переваривание стеридов (холестеридов)
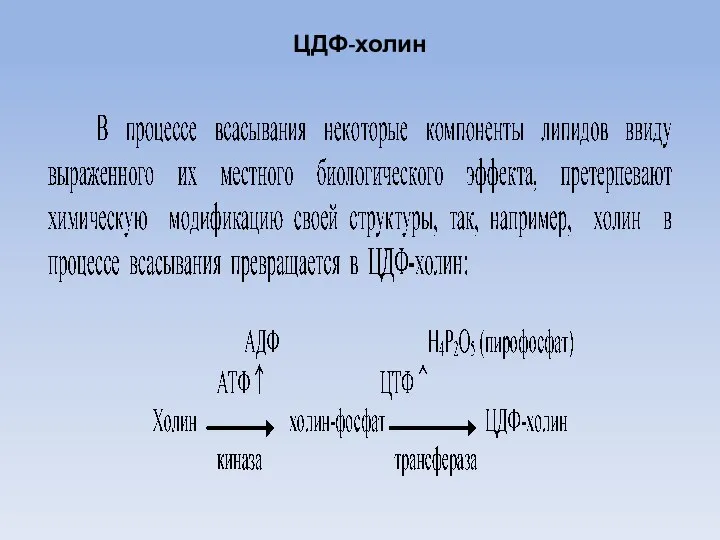
- 21. ЦДФ-холин
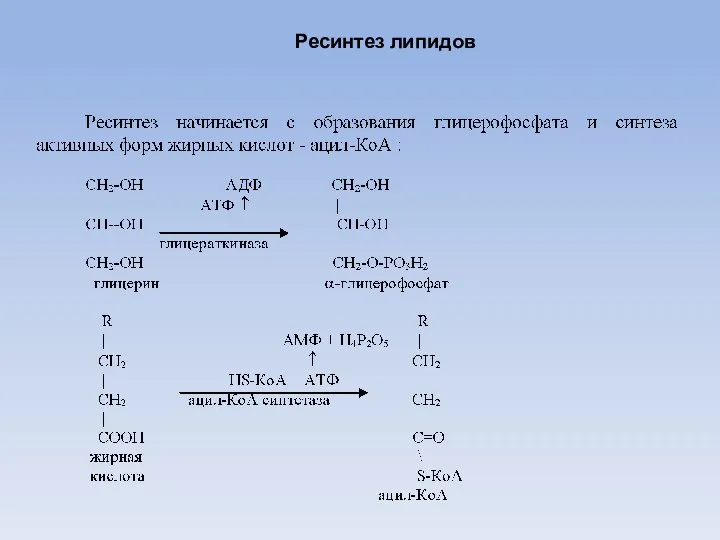
- 22. Ресинтез липидов
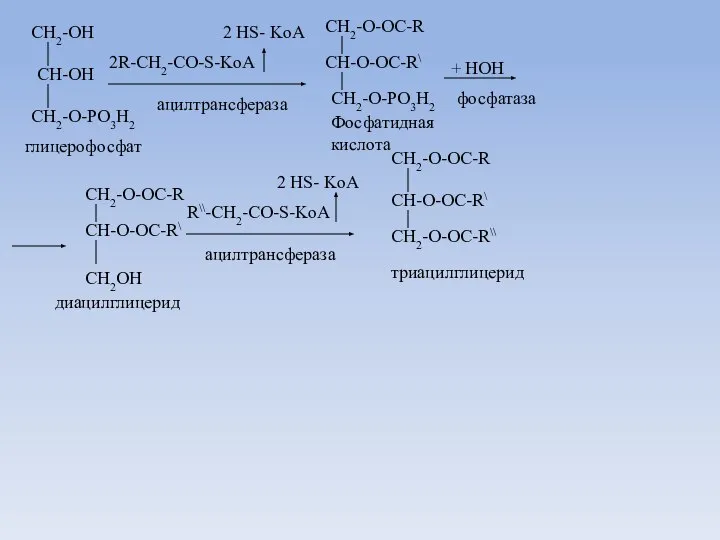
- 23. CH2-OH CH-OH CH2-O-PO3H2 глицерофосфат 2R-CH2-CO-S-KoA 2 HS- KoA CH2-O-OC-R CH-O-OC-R\ CH2-O-PO3H2 + HOH CH2-O-OC-R CH-O-OC-R\ CH2OH
- 24. Синтез фосфолипидов
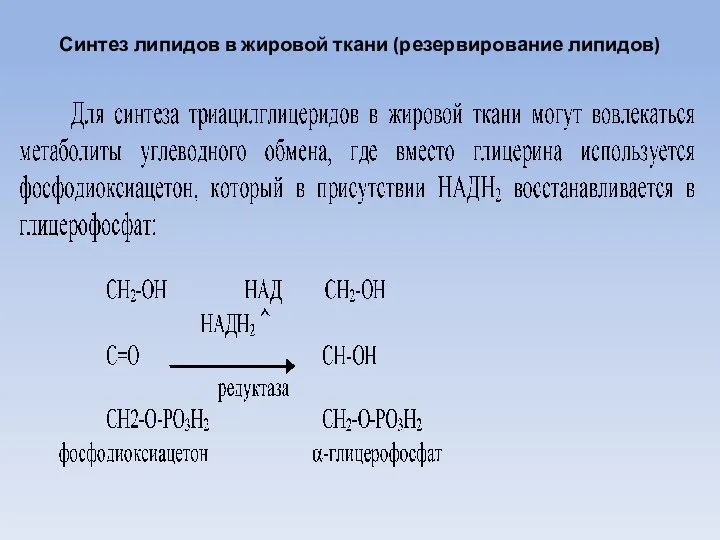
- 25. Синтез липидов в жировой ткани (резервирование липидов)
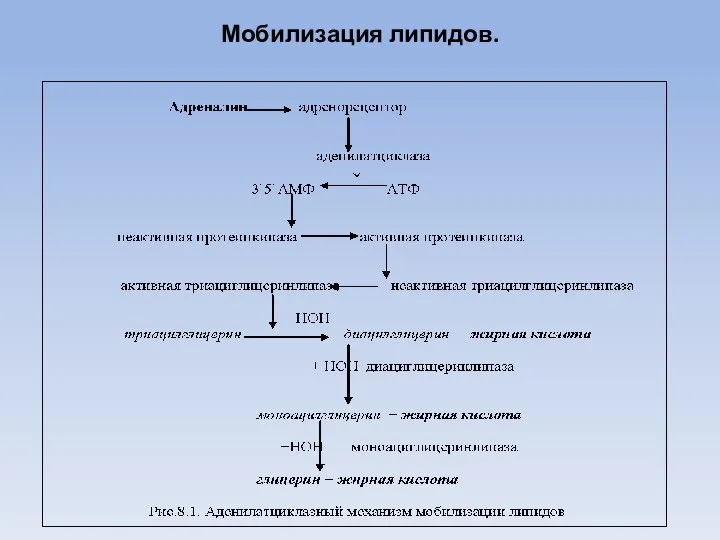
- 26. Мобилизация липидов.
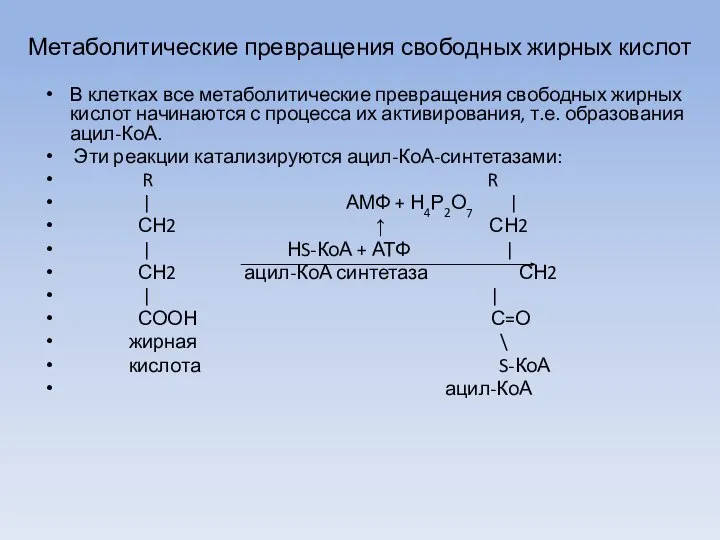
- 27. Метаболитические превращения свободных жирных кислот В клетках все метаболитические превращения свободных жирных кислот начинаются с процесса
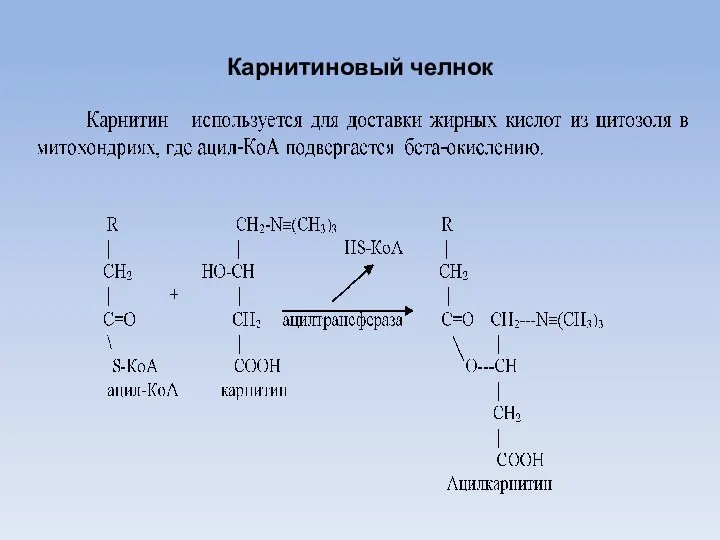
- 28. Карнитиновый челнок
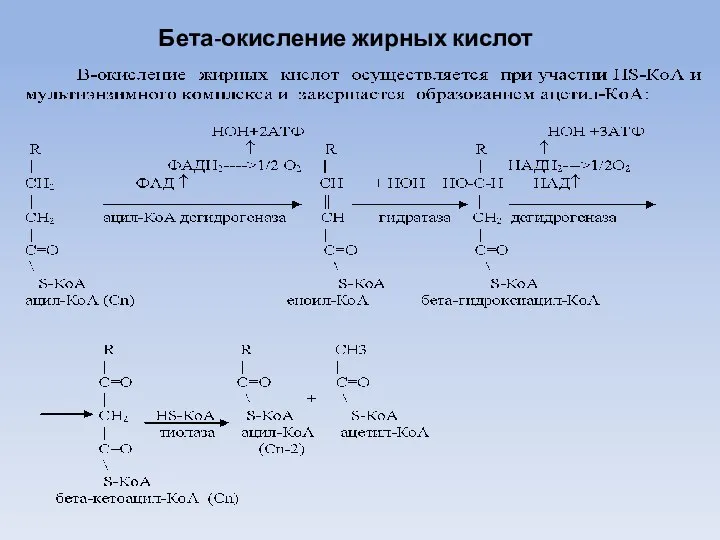
- 29. Бета-окисление жирных кислот
- 30. Далее окисляется укороченная на два углеродных атома молекула ацил-КоА
- 31. Биоэнергетика процесса бета-окисления Биоэнергетика процесса бета-окисления жирных кислот складывается из произведения числа циклов бета-окисления на число
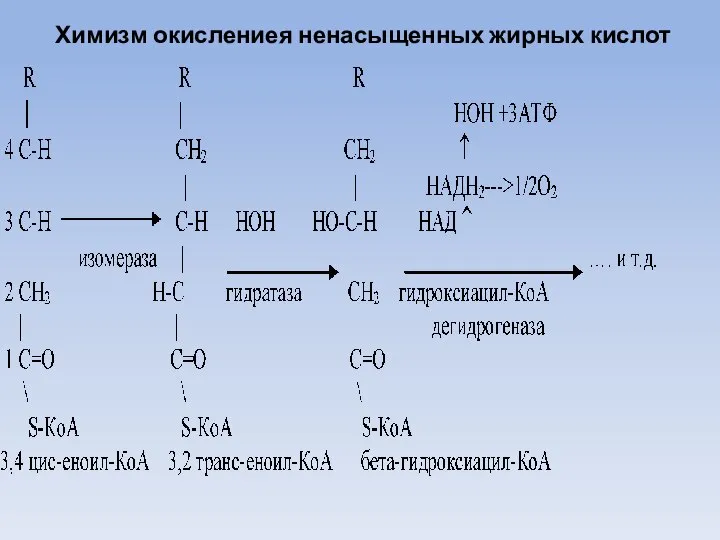
- 32. Оксиление ненасыщенных жирных кислот Природные ненасыщенные жирные кислоты имеют цис-конфигурацию, тогда как при окислении насыщенных жирных
- 33. Химизм окислениея ненасыщенных жирных кислот
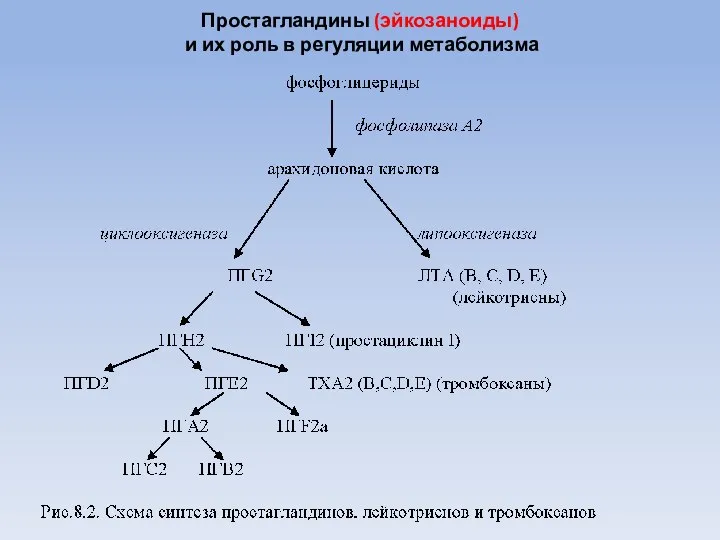
- 34. Простагландины (эйкозаноиды) и их роль в регуляции метаболизма
- 35. Синтез простагландинов Арахидоновая кислота как источник простагландинов подвергается действию фермента циклооксигеназы, входящей в состав полиферментного комплекса
- 36. В большинстве тканей из ПГН2 синтезируются простагландины типа ПГЕ2, ПГF2a, ПГА2, ПГD2 и тромбоксаны. При изомеризации
- 37. Биологическое действие простагландинов Повышая уровень цАМФ в эндокринных железах, простагландины стимулируют образование и секрецию гормонов (стероидных
- 38. Простациклины (ПГI2) и ПГЕ2 вызывают сосудорасширяющий эффект и падение давления, увеличивают мочевыведение и выведение с мочей
- 39. Биологические эффекты простагландинов Аллергическая и анафилактическая реакции организма связаны с ускоренным образованием в легочной ткани простагландинов
- 40. Простагландин Е2 (динопростон, простин Е2) применяют для купирования приступов спазма бронхов, гипертонии и язвенной болезни. Простациклин
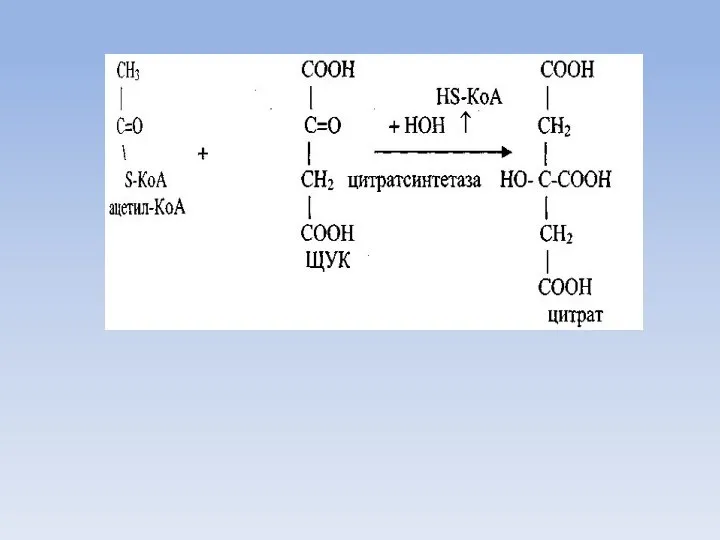
- 41. Биосинтез жирных кислот Источником для синтеза жирных кислот служит малонил-КоА, образующийся из ацетил-КоА. Ацетил-КоА доставляется к
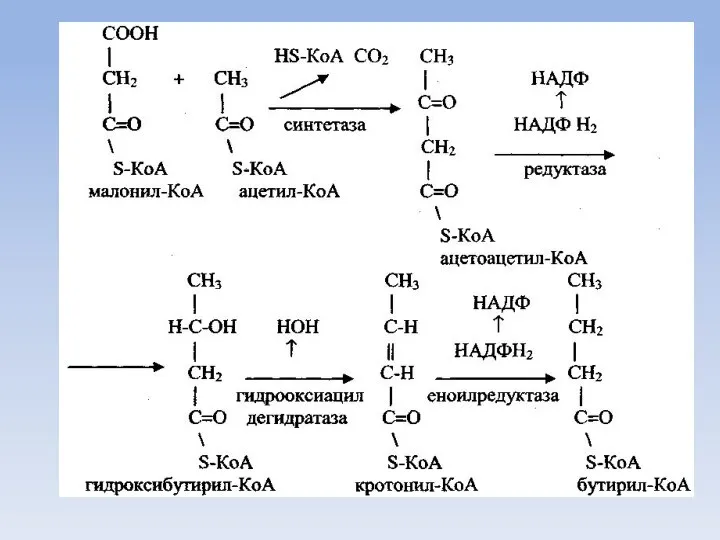
- 43. Синтез малонил КоА
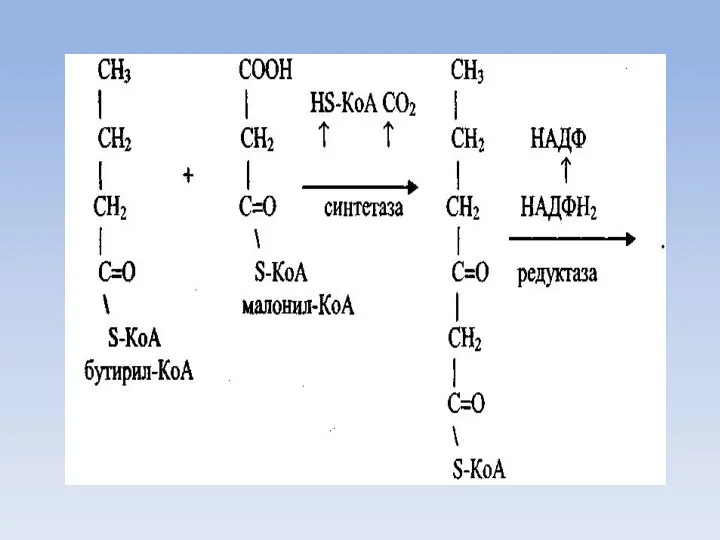
- 46. Синтез пальмитиновой кислоты Для синтеза пальмитиновой кислоты нужно семь таких циклов, соответственно требуется семь остатков малонила
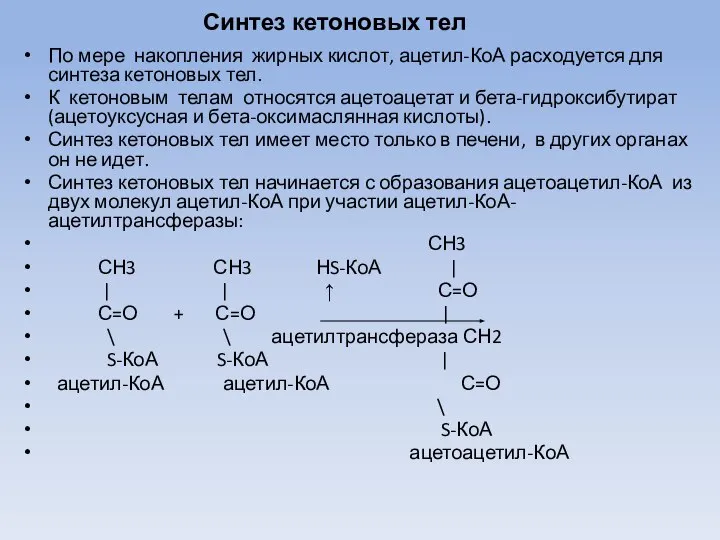
- 47. Синтез кетоновых тел По мере накопления жирных кислот, ацетил-КоА расходуется для синтеза кетоновых тел. К кетоновым
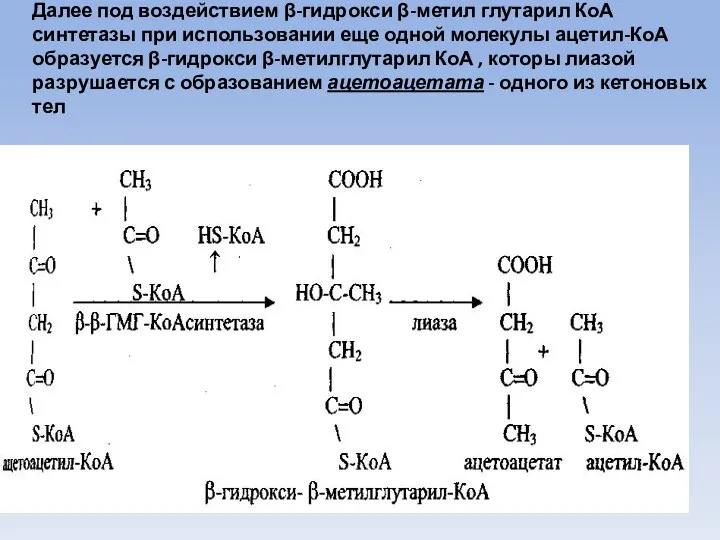
- 48. Далее под воздействием β-гидрокси β-метил глутарил КоА синтетазы при использовании еще одной молекулы ацетил-КоА образуется β-гидрокси
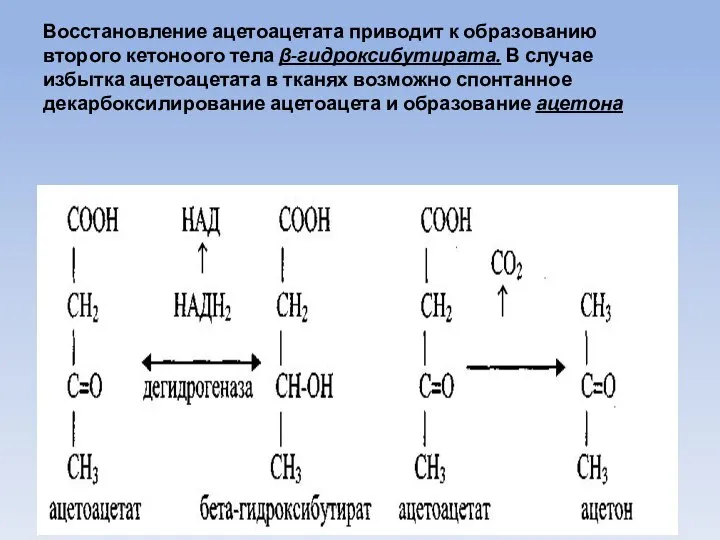
- 49. Восстановление ацетоацетата приводит к образованию второго кетоноого тела β-гидроксибутирата. В случае избытка ацетоацетата в тканях возможно
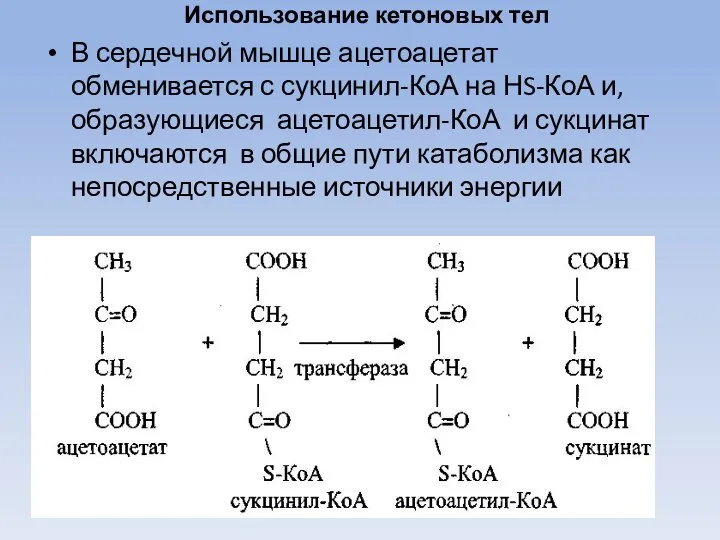
- 50. Использование кетоновых тел В сердечной мышце ацетоацетат обменивается с сукцинил-КоА на НS-КоА и, образующиеся ацетоацетил-КоА и
- 51. В норме в крови уровень кетоновых тел 0,1-0,6 ммоль/л. Повышение их уровня (гиперкетонемия) наблюдается при сахарном
- 52. Тема №7: Обмен липидов. Цель: Дать представление о катаболических и анаболических путях превращение липоидов и их
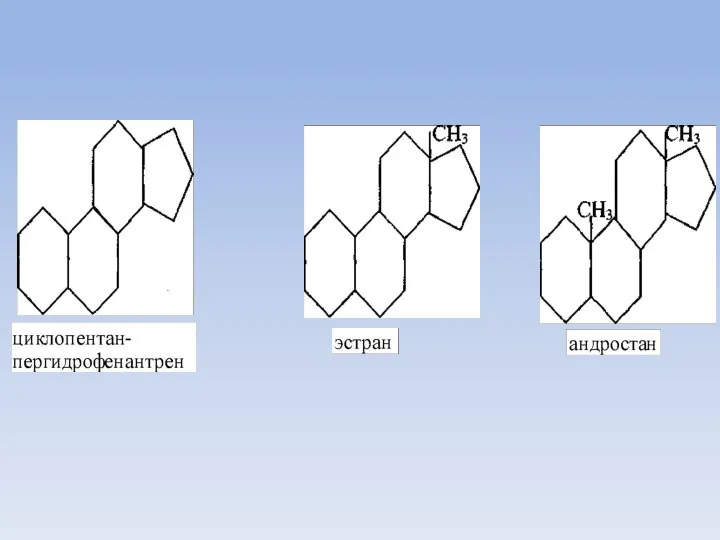
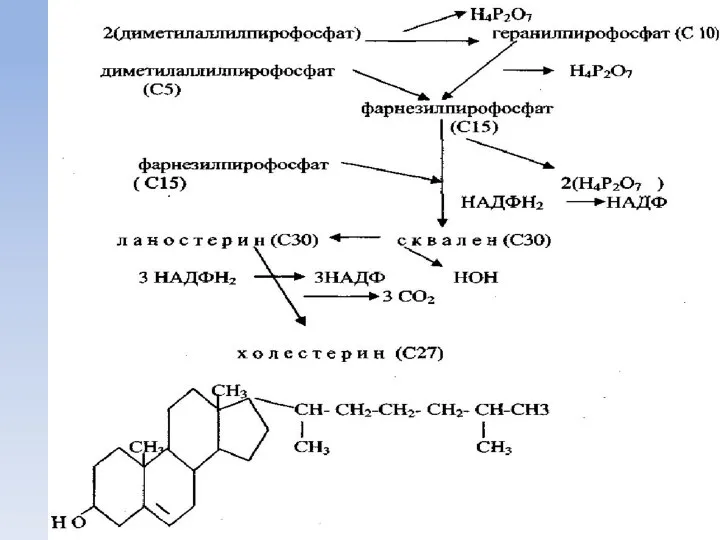
- 53. Биосинтез холестерина К стероидам относятся углеводороды производные циклопентан-пергидро-фенантрена, метилированные в положении 13 (эстран) или в положениях
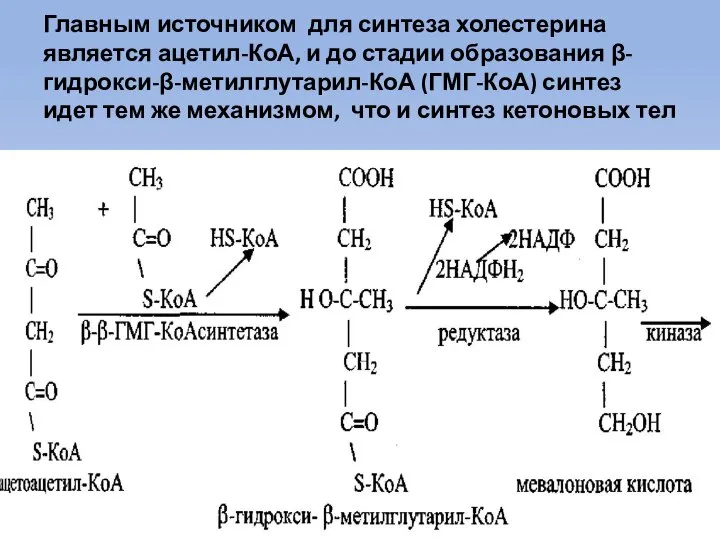
- 55. Главным источником для синтеза холестерина является ацетил-КоА, и до стадии образования β-гидрокси-β-метилглутарил-КоА (ГМГ-КоА) синтез идет тем
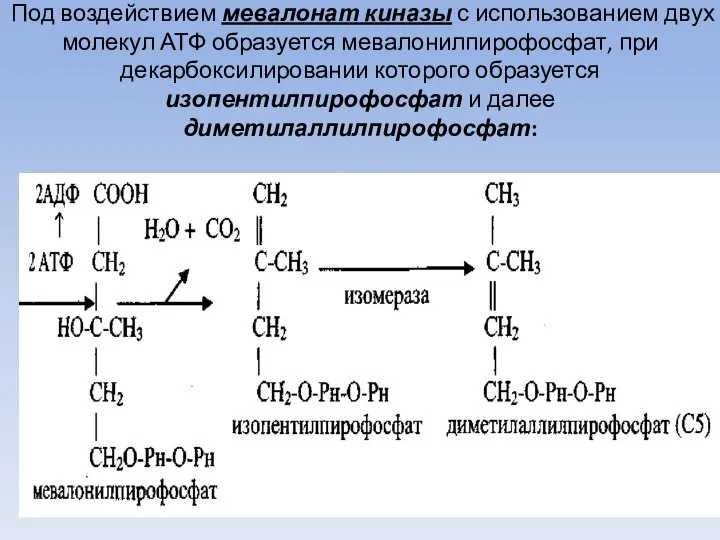
- 56. Под воздействием мевалонат киназы с использованием двух молекул АТФ образуется мевалонилпирофосфат, при декарбоксилировании которого образуется изопентилпирофосфат
- 58. Синтез фосфолипидов и гликолипидов Для синтеза фосфолипидов и гликолипидов - главных структурных компонентов мембран клетки, кроме
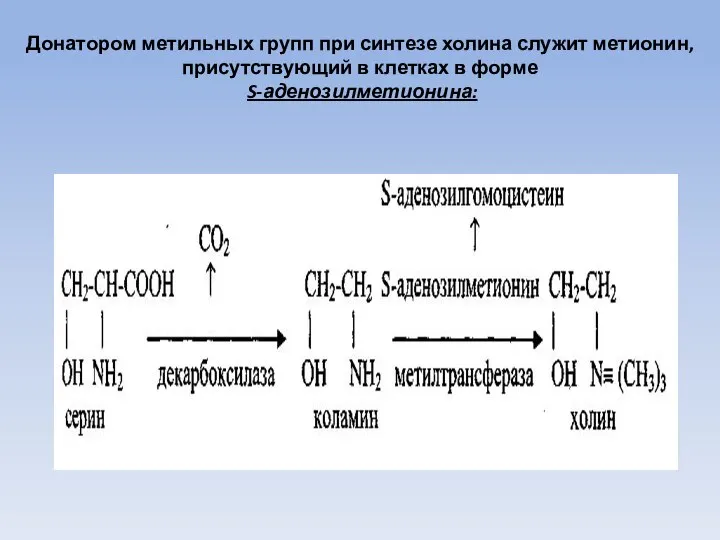
- 59. Донатором метильных групп при синтезе холина служит метионин, присутствующий в клетках в форме S-аденозилметионина:
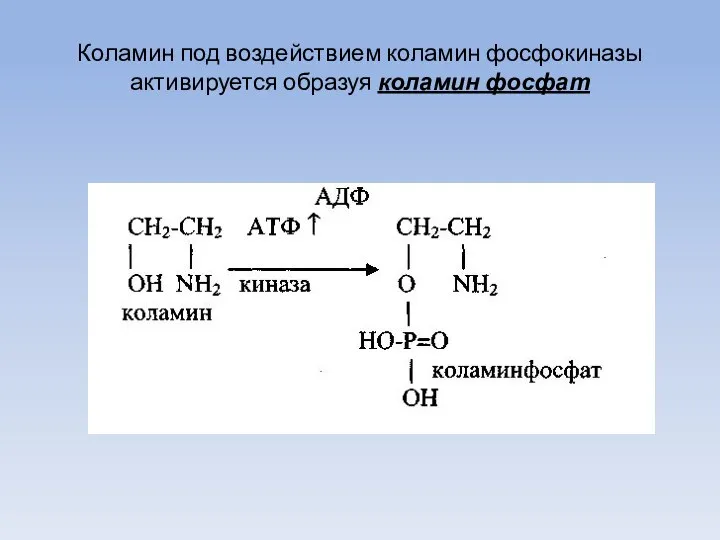
- 60. Коламин под воздействием коламин фосфокиназы активируется образуя коламин фосфат
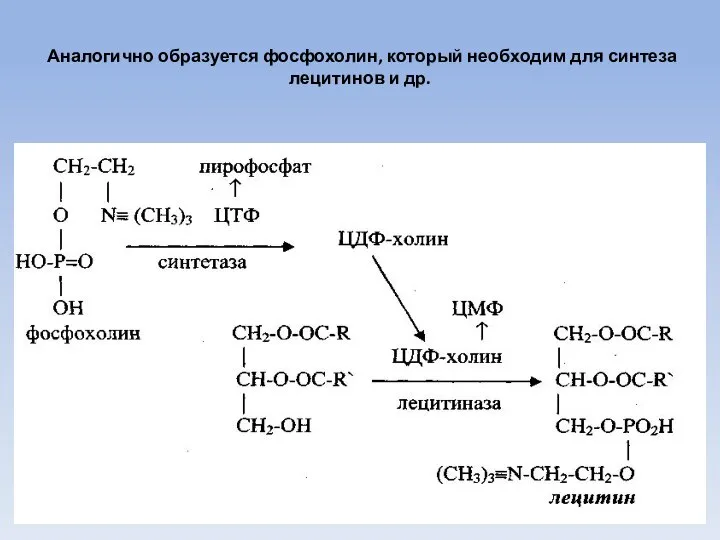
- 61. Аналогично образуется фосфохолин, который необходим для синтеза лецитинов и др.
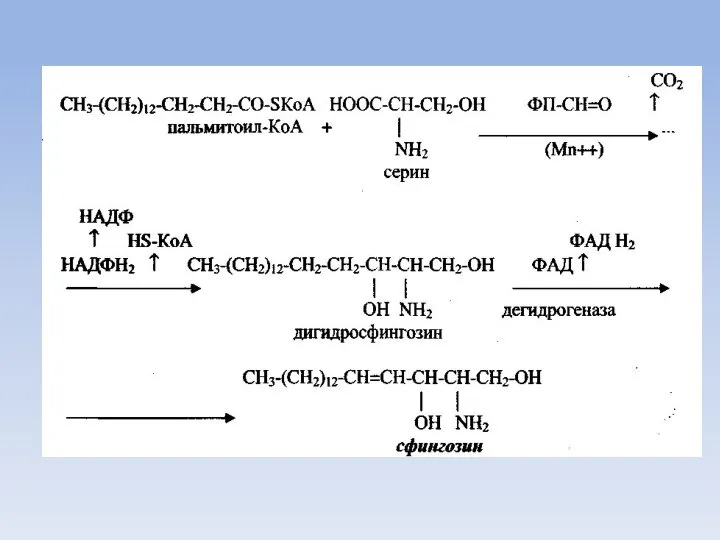
- 62. Аналогично образуется фосфохолин и далее его активная транспортная форма ЦДФ-холин, который лецитиназой присоединяется к диглицериду образуя
- 63. Синтез гликолипидов Синтез гликолипидов идет на мембранах эндоплазматического ретикулума, Образовавшиеся гликолипиды размещаются на поверхности мембраны, выстилающей
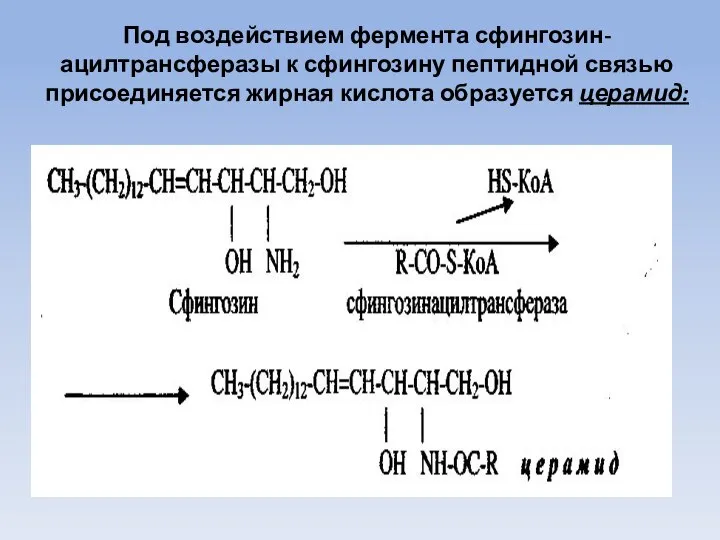
- 65. Под воздействием фермента сфингозин-ацилтрансферазы к сфингозину пептидной связью присоединяется жирная кислота образуется церамид:
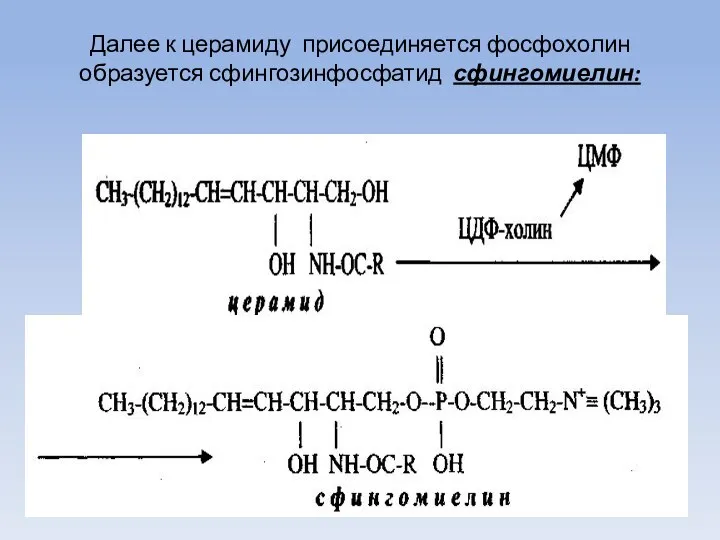
- 66. Далее к церамиду присоединяется фосфохолин образуется сфингозинфосфатид сфингомиелин:
- 67. Синтез гликолипидов Синтез гликолипидов также происходит с использованием церамидов. При синтезе цереброзидов к церамиду присоединяются гликозидной
- 68. Цереброзиды могут синтезироваться по альтернативаному пути. Вначале образуется производное сфингозина и галактозы называемое психозин: сфингозин +
- 69. Синтез ганглиозидов Ганглиозиды - гликолипиды мембран нейронов синтезируются либо из церамидов, к которым последовательно присоединяются остатки
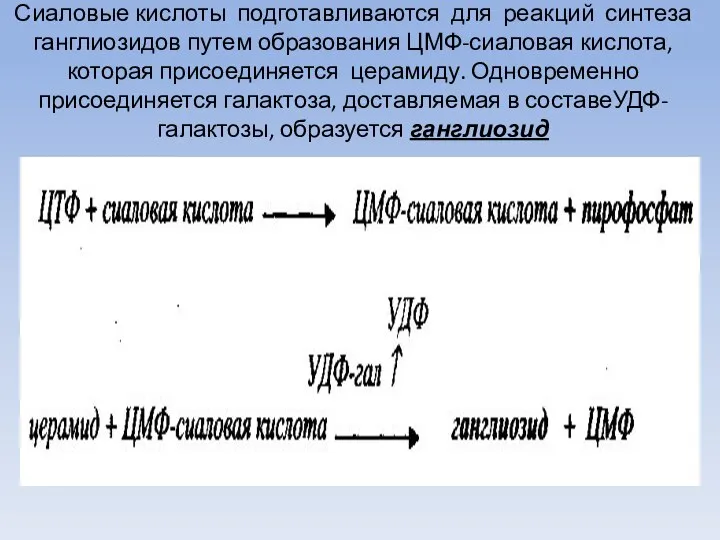
- 70. Сиаловые кислоты подготавливаются для реакций синтеза ганглиозидов путем образования ЦМФ-сиаловая кислота, которая присоединяется церамиду. Одновременно присоединяется
- 71. Катаболизм гликолипидов - сфинголипидозы Катаболизм гликолипидов обеспечивается группой специфических ферментов находящихся в лизосомах. Это сфингомиелиназа, бета-глюктозидаза,
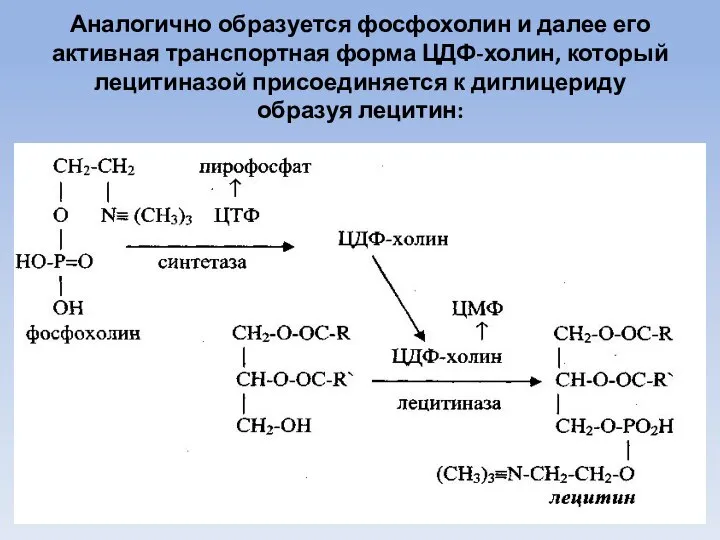
- 72. Гликолипидозы При болезни Фабри (Fabri) имеет место дефект сцепленного с Х-хромосомой гена, транскрибирующего синтез фермента альфа-галактозидазы.
- 74. Скачать презентацию


































 Основные законы химии
Основные законы химии Природный газ
Природный газ Карбонильные соединения. (Лекция 10)
Карбонильные соединения. (Лекция 10) Аттестационная работа. Развитие творческих возможностей учащихся через организацию исследовательской работы по химии
Аттестационная работа. Развитие творческих возможностей учащихся через организацию исследовательской работы по химии Соли
Соли The ideal gas equation
The ideal gas equation Диагностические свойства минералов. Занятие 3-4
Диагностические свойства минералов. Занятие 3-4 Презентация по химии Химия
Презентация по химии Химия Методы осаждения. Аналитическая химия
Методы осаждения. Аналитическая химия Никель – тяжелый металл
Никель – тяжелый металл Введение в общую химию. Основные понятия химии
Введение в общую химию. Основные понятия химии Презентация по Химии "Косметичні засоби" - скачать смотреть бесплатно
Презентация по Химии "Косметичні засоби" - скачать смотреть бесплатно Значение органической химии Кондрашов Алексей | 9 А класс
Значение органической химии Кондрашов Алексей | 9 А класс  Chemical bonding and Molecular Structure
Chemical bonding and Molecular Structure Кислоты. Классификация и роль кислот в жизнедеятельности человека
Кислоты. Классификация и роль кислот в жизнедеятельности человека Скорость химической реакции (химическая кинетика )
Скорость химической реакции (химическая кинетика ) Кислородные соединения азота
Кислородные соединения азота Презентація на тему: “Поняття про полімери на прикладі поліетилену”
Презентація на тему: “Поняття про полімери на прикладі поліетилену”  Химический элемент радий
Химический элемент радий Тема проекту: “ЕКОЛОГІЧНІ ПРОБЛЕМИ ЛЮДСТВА - радіоактивне забруднення” «Природа не терпить жартів. Вона завжди спокійна, завжди серйозна, завжди має рацію. Помилок припускається лише людина...» (Й.В.Гете).
Тема проекту: “ЕКОЛОГІЧНІ ПРОБЛЕМИ ЛЮДСТВА - радіоактивне забруднення” «Природа не терпить жартів. Вона завжди спокійна, завжди серйозна, завжди має рацію. Помилок припускається лише людина...» (Й.В.Гете). Гидролиз солей
Гидролиз солей Сера в таблице Д.И. Менделеева
Сера в таблице Д.И. Менделеева Роль химии в нашей жизни
Роль химии в нашей жизни Диктант: название алканов
Диктант: название алканов Тема Основание Гидроксид железа (II)
Тема Основание Гидроксид железа (II) Использование ядерных излучений для получения химической информации. (Лекция 10)
Использование ядерных излучений для получения химической информации. (Лекция 10) Наполненные полимеры. Структура и физико-химические свойства. Введение
Наполненные полимеры. Структура и физико-химические свойства. Введение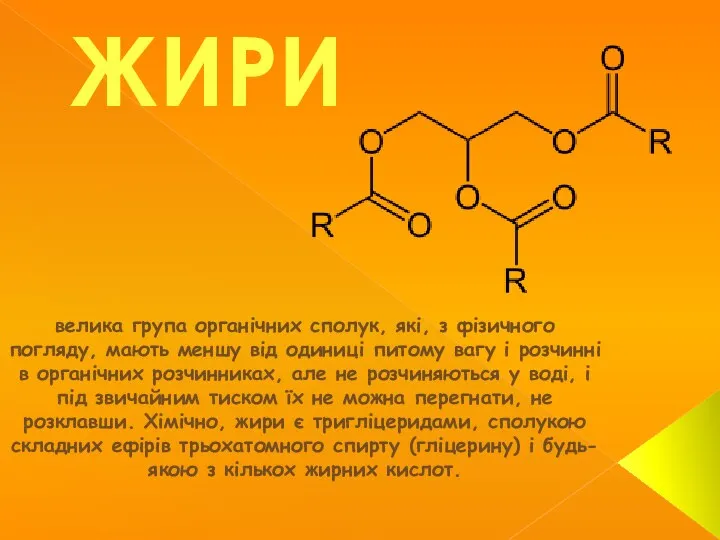 ЖИРИ велика група органічних сполук, які, з фізичного погляду, мають меншу від одиниці питому вагу і розчинні в органічних розч
ЖИРИ велика група органічних сполук, які, з фізичного погляду, мають меншу від одиниці питому вагу і розчинні в органічних розч