Содержание
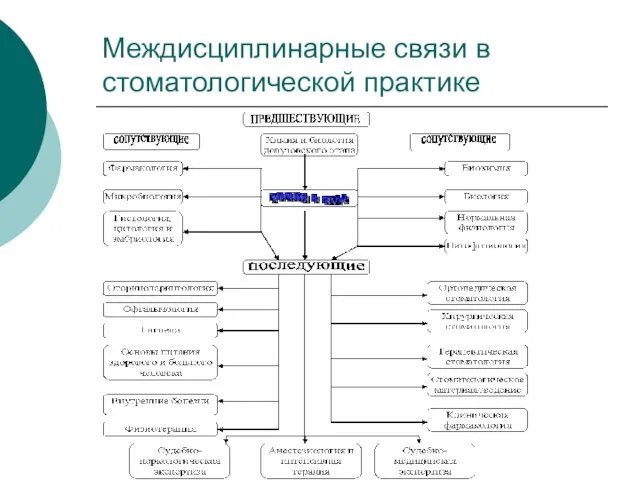
- 2. Междисциплинарные связи в стоматологической практике
- 3. РЕКОМЕНДУЕМАЯ литература: Основная литература Попков, В.А. Общая и биоорганическая химия /В.А.Попков, А.С. Берлянд.– М.: Издательский центр
- 4. Химия и медицина Химия – это фундаментальная наука, занимающая важное место в медицине, т.к. трактовать какие-либо
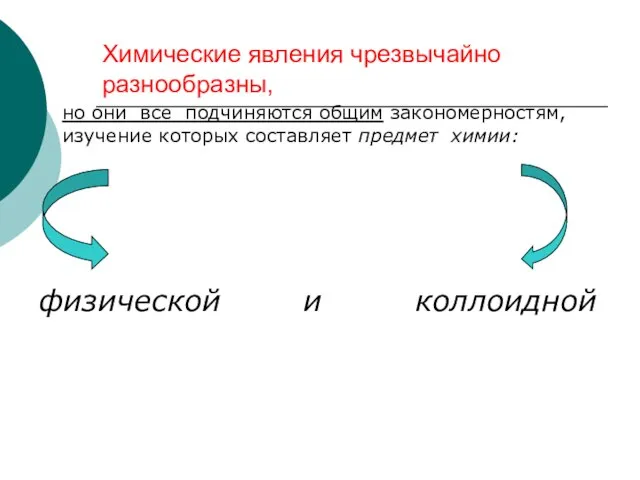
- 5. Химические явления чрезвычайно разнообразны, но они все подчиняются общим закономерностям, изучение которых составляет предмет химии: физической
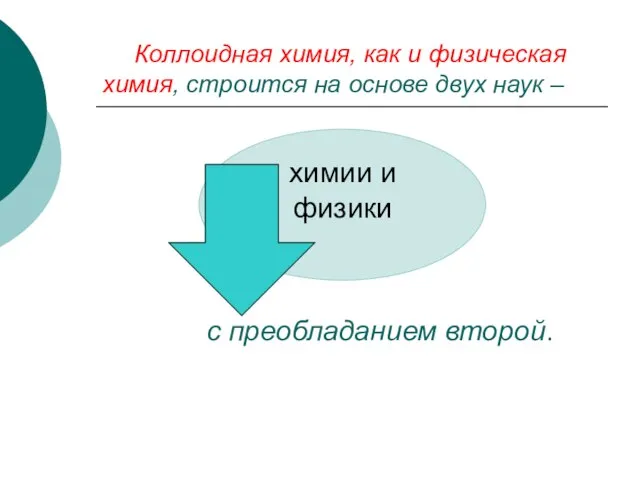
- 6. Коллоидная химия, как и физическая химия, строится на основе двух наук – с преобладанием второй.
- 7. Физическая химия изучает взаимосвязь химических процессов и физических явлений, которые их сопровождают, устанавливает закономерности между химическим
- 8. Коллоидная химия – это наука, изучающая свойства гетерогенных высокодисперсных (сильно раздробленных) систем и протекающих в них
- 9. Основные задачи дисциплины Изучение основных разделов физической химии для более глубокого понимания не только теоретических основ
- 10. 3. Изучение механизмов образования основного неорганического вещества костной ткани и зубной эмали, кислотно-основные свойства биожидкостей организма.
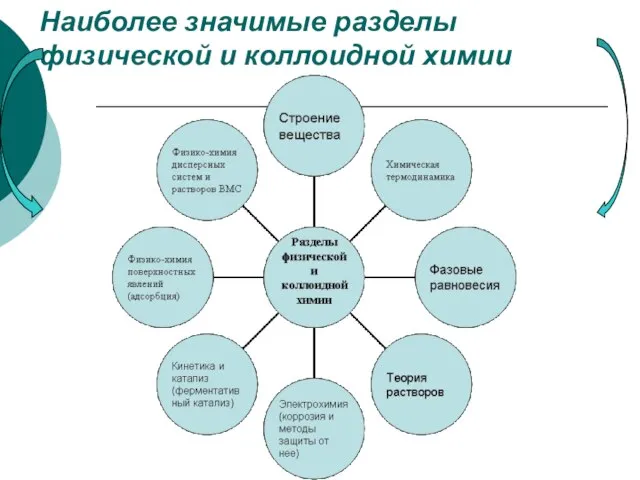
- 11. Наиболее значимые разделы физической и коллоидной химии
- 12. ТЕРМОДИНАМИЧЕСКИЕ ХАРАКТЕРИСТИКИ ХИМИЧЕСКИХ И БИОХИМИЧЕСКИХ ПРОЦЕССОВ Термодинамика – это наука, изучающая законы энергетических превращений, сопровождающих физические,
- 13. Системой называется
- 14. Классификация систем В зависимости от способности системы к обмену энергией и веществом с окружающей средой различают:
- 15. Термодинамические параметры и функции Изменение свойств системы определяется 1) термодинамическими параметрами (давлением, концентрацией, температурой, объемом и
- 16. Например, состояние идеального газа определяется двумя параметрами из трех (р, V, T). Характеристические функции состояния зависят
- 17. Состояние системы Состояние системы– это совокупность параметров, характеризующих систему в данный момент времени. Особого внимания заслуживают
- 18. Последнее характерно для живых систем, а равновесное – для него смерть. При переходе системы из одного
- 19. Внутренняя энергия (U, Дж/моль). Теплота (Q, Дж/моль∙К) и работа (Дж или кДж) Энергетический эффект химической реакции
- 20. Известны 2 формы передачи энергии от одной системы к другой. Упорядоченную (т.е. организованную) форму передачи энергии
- 21. ☞ Обычно в ходе химической реакции теплота
- 22. В любом процессе соблюдается закон сохранения энергии (I закон термодинамики)– запас внутренней энергии изолированной системы остается
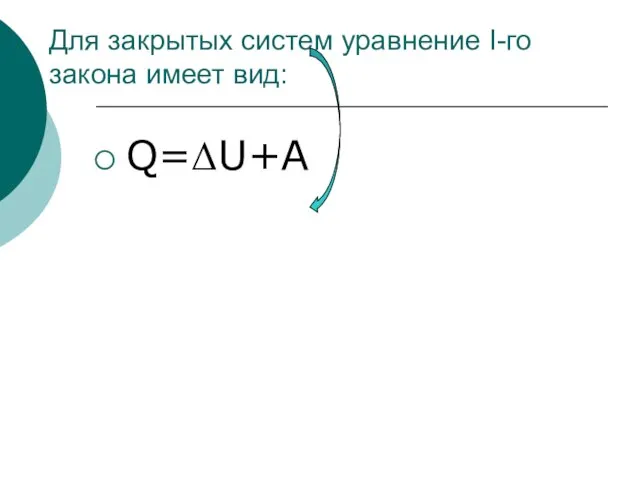
- 23. Для закрытых систем уравнение I-го закона имеет вид: Q=ΔU+A
- 24. Выражения I-го закона термодинамики для изохорного и изобарного процессов Процесс– это переход системы из одного состояния
- 25. В изохорном процессе (V = const) поглощенная системой теплота идет полностью на увеличение запаса внутренней энергии,
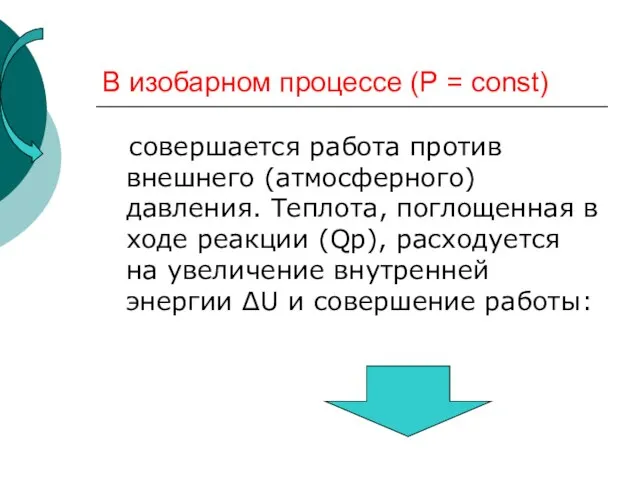
- 26. В изобарном процессе (Р = const) совершается работа против внешнего (атмосферного) давления. Теплота, поглощенная в ходе
- 27. Или Раскроем скобки и сгруппируем члены с одинаковыми индексами:
- 28. Примечание Жизнедеятельность человека протекает при постоянстве температуры и давления, т. е. при изобарно-изотермических условиях (р, Т
- 29. Энтальпия. Тепловые эффекты. Стандартное состояние. Сумму U + PV называют энтальпией системы и обозначают буквой Н.
- 30. Следовательно, Qp = Н2 – Н1 =ΔН, т. е. теплота, поглощенная системой при постоянном давлении, расходуется
- 31. Таким образом, в изохорном процессе тепловой эффект реакции равен изменению внутренней энергии системы, а в изобарном
- 32. Для того чтобы можно было сравнивать тепловые эффекты различных процессов, расчеты обычно относят к 1 молю
- 33. Термохимические уравнения. Закон Гесса В термохимических расчетах используют термохимические уравнения. В них указывают тепловой эффект реакции
- 34. Термохимические расчеты проводят, используя стандартные энтальпии (теплоты) образования веществ. Стандартная энтальпия образования ΔН°обр. - это тепловой
- 35. В основе термохимических расчетов лежит закон Г. И. Гесса (1840): тепловой эффект реакции не зависит от
- 36. 1) тепловой эффект реакции равен разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования
- 37. Реакцию, идущую без воздействия внешних факторов, называют самопроизвольной. Направление, в котором самопроизвольно протекает химическая реакция, определяется
- 38. Мерой первой из этих тенденций для изобарных процессов служит уменьшение энтальпии системы (ΔН Еще в прошлом
- 39. Следовательно, уменьшение энтальпии — не единственный фактор, определяющий возможность протекания реакции. Все приведенные выше самопроизвольные процессы
- 40. ЭНТРОПИЯ Степень беспорядка, или неупорядоченности, в системе характеризуется функцией состояния системы, называемой энтропией. Энтропия является мерой
- 41. где k = R/NA = 1,38 • 10- 23 Дж/К; W - термодинамическая вероятность состояния системы,
- 42. Энтропия имеет размерность энергии, деленной на температуру, обычно ее относят к 1 молю вещества (мольная энтропия)
- 43. В изолированной системе самопроизвольно протекают только те процессы, которые сопровождаются увеличением энтропии — это одна из
- 44. Энтропия возрастает при плавлении, растворении, кипении, диссоциации молекул и т. п. Процессы, в результате которых упорядоченность
- 45. Рассчитывают изменение стандартной энтропии по уравнению Оба фактора - изменения энтальпии и энтропии - объединены в
- 46. Энергию Гиббса образования относят к 1 молю вещества и обычно выражают в кДж/моль; при этом ΔG0
- 47. Все самопроизвольные физические и химические превращения идут в направлении уменьшения энергии Гиббса. Они могут сопровождаться увеличением
- 48. Для нахождения изменения стандартной энергии Гиббса в реакции должны быть известны изменения стандартных энтальпии и энтропии,
- 50. Скачать презентацию









































 Эффект Зеемана
Эффект Зеемана Презентация по Химии "Медь и ее соединения" - скачать смотреть
Презентация по Химии "Медь и ее соединения" - скачать смотреть  Многоатомные Спирты
Многоатомные Спирты  Природный и попутный нефтяные газы
Природный и попутный нефтяные газы Анатомия косметики
Анатомия косметики Алифатические углеводороды. Алканы, их свойства
Алифатические углеводороды. Алканы, их свойства Буферные системы
Буферные системы Олимпиада по фармацевтической химии. Своя игра
Олимпиада по фармацевтической химии. Своя игра Предмет химии. Основные задачи курса
Предмет химии. Основные задачи курса Неон(Ne) химический элемент периодической таблицы Д.И. Менделеева
Неон(Ne) химический элемент периодической таблицы Д.И. Менделеева Презентация по Химии "Моющие и чистящие средства" - скачать смотреть
Презентация по Химии "Моющие и чистящие средства" - скачать смотреть  Аттестационная работа. Образовательная программа (элективный курс) «Решение задач по химии»
Аттестационная работа. Образовательная программа (элективный курс) «Решение задач по химии» Удивительные свойства латекса и его применение
Удивительные свойства латекса и его применение Действующие вещества. Лексикон
Действующие вещества. Лексикон Проект соль
Проект соль Простые вещества – металлы и неметаллы
Простые вещества – металлы и неметаллы Прохладительные напитки. Вред или польза?
Прохладительные напитки. Вред или польза?  Ядро атома (тест)
Ядро атома (тест) Кремний және оның қосылыстары
Кремний және оның қосылыстары Алюминий и его соединения
Алюминий и его соединения Электролиз растворов электролитов урок по химии в 10 классе
Электролиз растворов электролитов урок по химии в 10 классе  Экстракция
Экстракция Молекулы и кристаллы. Химическая связь
Молекулы и кристаллы. Химическая связь Урок № 11 Углекислый газ Цель урока: Систематизировать знания о физических свойствах углекислого газа. Повторить понятия «
Урок № 11 Углекислый газ Цель урока: Систематизировать знания о физических свойствах углекислого газа. Повторить понятия « Презентация по Химии "Нуклеиновые кислоты(НК)." - скачать смотреть бесплатно
Презентация по Химии "Нуклеиновые кислоты(НК)." - скачать смотреть бесплатно Кристаллическое состояние вещества в природе
Кристаллическое состояние вещества в природе Теория химического строения органических веществ А М. Бутлерова
Теория химического строения органических веществ А М. Бутлерова Предмет органической химии. Классификация органических веществ
Предмет органической химии. Классификация органических веществ