Содержание
- 2. До складних відносяться білки, що складаються з білкової частини та небілкового компоненту (простетична група). За хімічним
- 3. Обмін нуклеопротеїнів. Ентеральний обмін. У шлунку: нуклеопротеїни (ДНП, РНП) + HCl → простий білок + нуклеїнова
- 4. Інші відділи тонкого кишечнику: Всмоктування: - ДНК: Аденін (А), Гуанін (Г), Цитозин (Ц), Тимін (Т), дезоксирибоза
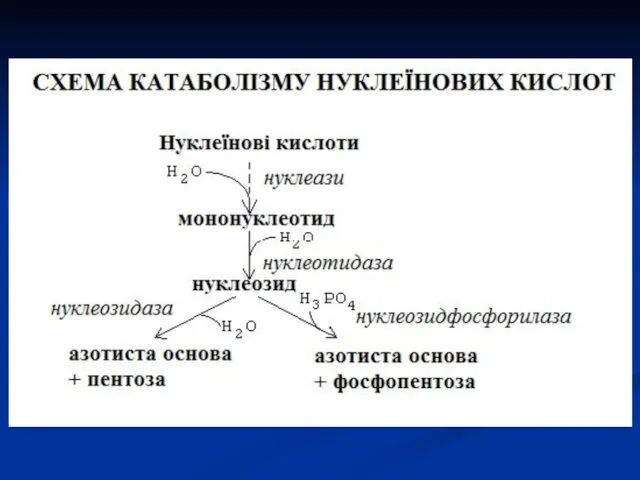
- 6. Катаболізм нуклеопротеїнів В тканинах розпад нуклеопротеїнів відбувається аналогічно їх розпаду в шлунково-кишковому тракті, тільки здійснюється специфічними
- 7. Пентози, які в результаті катаболізму нуклеїнових кислот, окиснюються до СО2 і Н2О, а також використовуються для
- 8. Азотисті основи (пуринові і піримідинові) перетворюються в кінцеві продукти обміну, які виділяються з сечею. Піримідинові азотисті
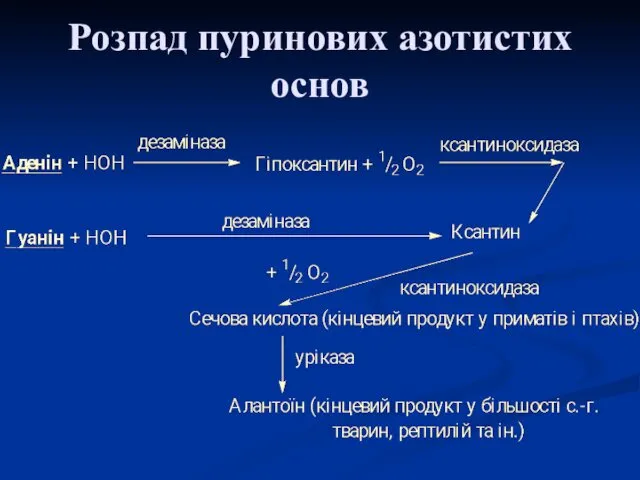
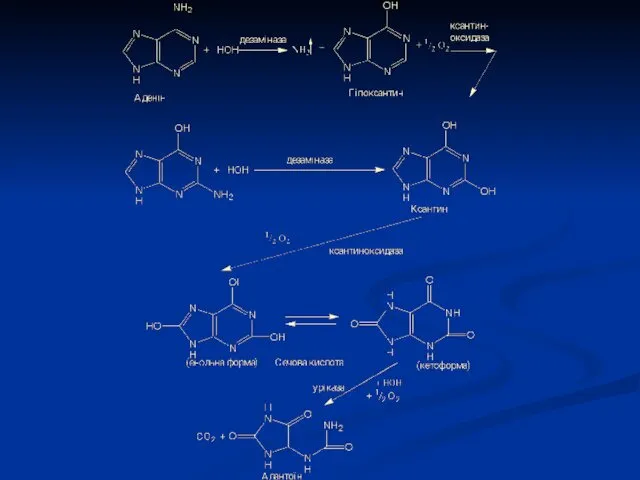
- 9. Розпад пуринових азотистих основ
- 11. Сечова кислота є одним із нормальних компонентів сечі. За добу в організмі утворюється приблизно 1 грам
- 12. Функції сечової кислоти: 1. Є потужним стимулятором центральної нервової системи, бо інгібує фосфодиестеразу, яка є посередником
- 13. Сечова кислота дуже погано розчиняється у воді. При надлишковій кількості або порушенні катаболізму підвищується концентрація сечової
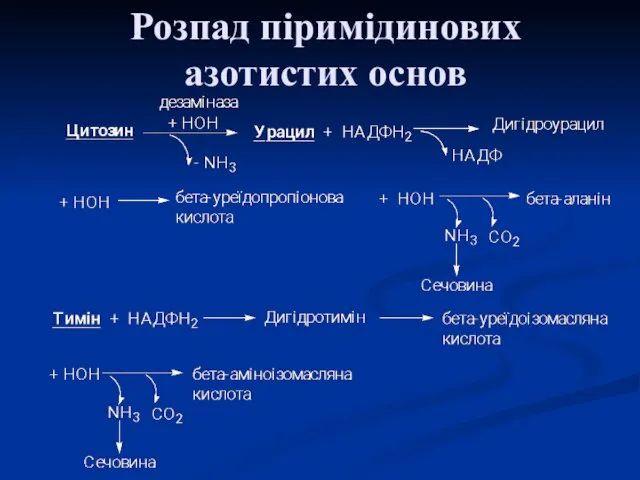
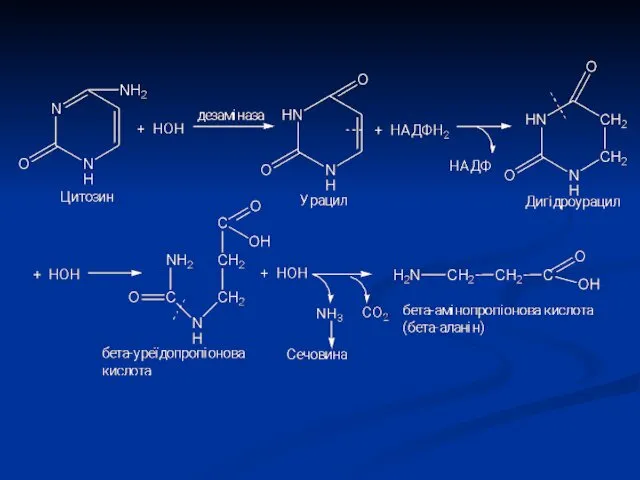
- 14. Розпад піримідинових азотистих основ
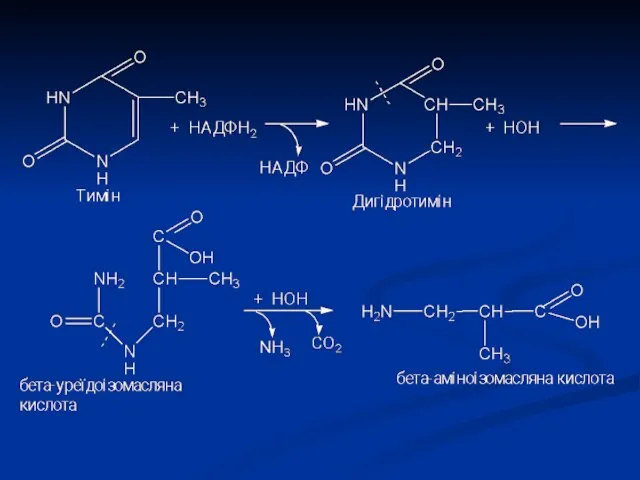
- 16. β-аланін зазвичай розпадається до CO2, H2O і NH3, але іноді може використовуватися для синтезу пептидів карнозину
- 18. Тимін розпадається подібно урацилу, але зберігається CH3-група і замість β-аланіну утворюється β-аміноізобутират (α-метил-β-аланін). Оскільки тимін зустрічається
- 19. СИНТЕЗ МОНОНУКЛЕОТИДОВ Для синтезу мононуклеотидів de novo необхідними є прості речовини: CO2 і рибозо-5-фосфат (продукт 1-го
- 20. ВІДМІННОСТІ В СИНТЕЗІ ПУРИНОВИХ І ПІРИМІДИНОВИХ МОНОНУКЛЕОТИДІВ: Особливістю синтезу пуринових нуклеотидів є те, що циклічна структура
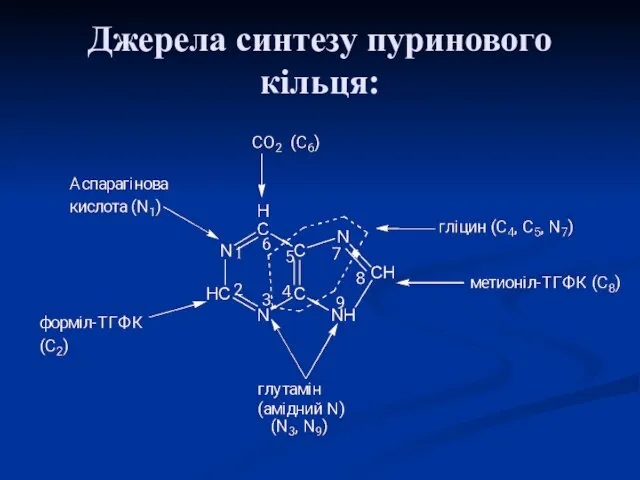
- 21. Джерела синтезу пуринового кільця:
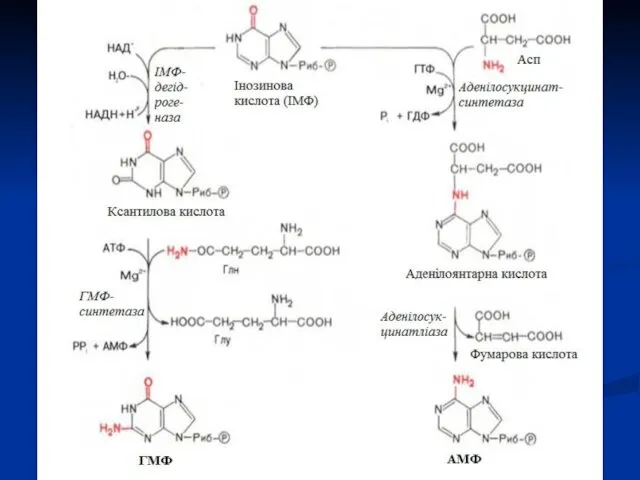
- 22. Існує 10 загальних і 2 специфічних стадії. В результаті загальних реакцій утворюється пуриновий мононуклеотид, який є
- 23. Пуринове кільце будується з СО2, аспарагінової кислоти, глутаміну, гліцину і серину. Ці речовини або повністю включаються
- 25. Далі з НМФ (нуклеотидмонофосфат) утворюються НДФ і НТФ за допомогою АТФ. Витрати АТФ на синтез нуклеотидів
- 26. Ферменти, що каталізують реакції реутилізації, є найбільш активними у клітинах, які швидко діляться (ембріональні тканини, червоний
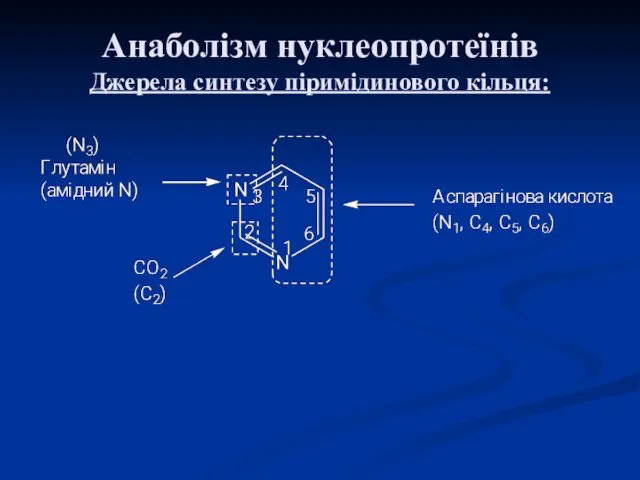
- 27. Анаболізм нуклеопротеїнів Джерела синтезу піримідинового кільця:
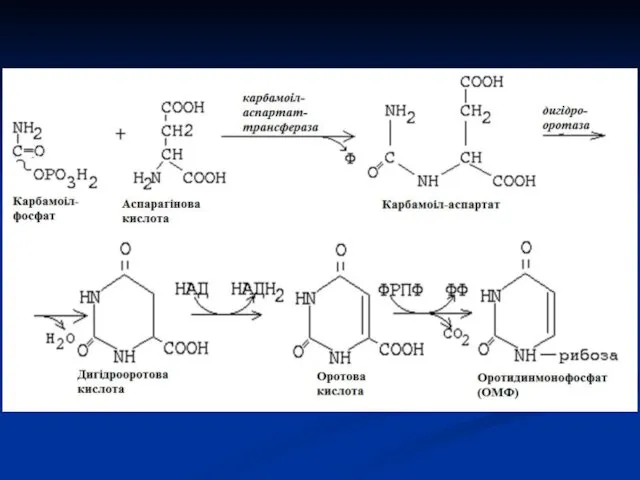
- 28. СИНТЕЗ ПІРИМІДИНОВИХ МОНОНУКЛЕОТИДІВ Процес починається з утворення циклічної структури піримідинової азотистої основи, і тільки потім приєднується
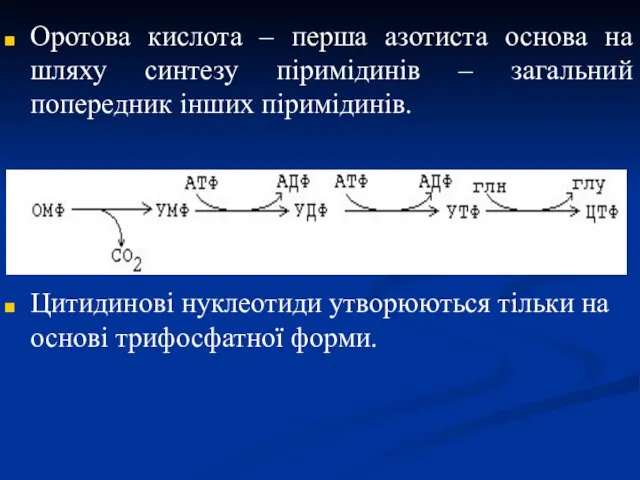
- 30. Оротова кислота – перша азотиста основа на шляху синтезу піримідинів – загальний попередник інших піримідинів. Цитидинові
- 31. СИНТЕЗ НУКЛЕЇНОВИХ КИСЛОТ З МОНОНУКЛЕОТИДІВ Нуклеїнові кислоти є полімерами. Тому їх синтез представляє собою ланцюг реакцій
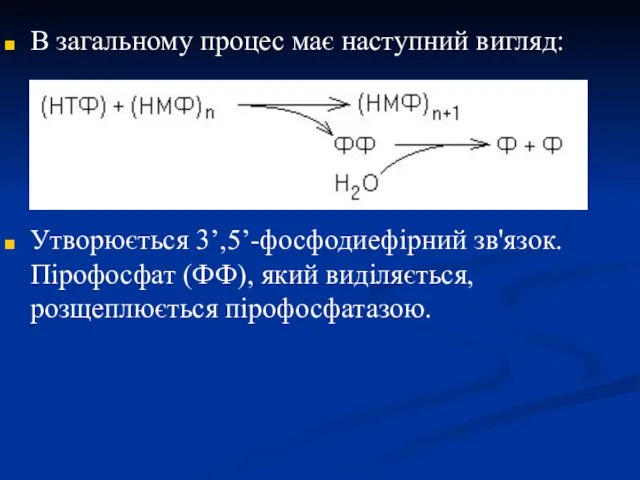
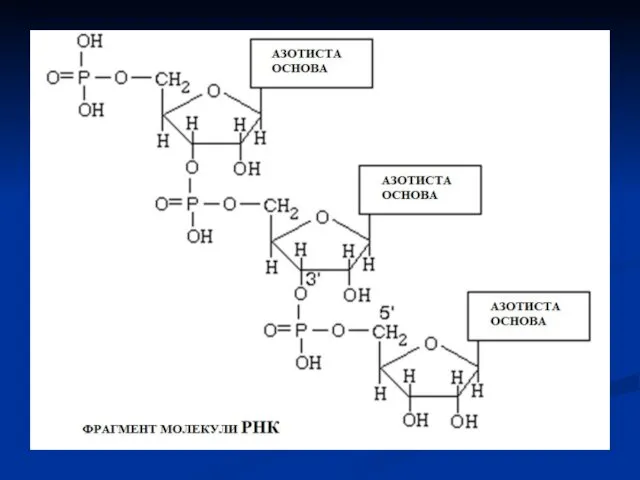
- 32. В загальному процес має наступний вигляд: Утворюється 3’,5’-фосфодиефірний зв'язок. Пірофосфат (ФФ), який виділяється, розщеплюється пірофосфатазою.
- 34. Обмін хромопротеїнів Ентеральний обмін: У шлунку: гемоглобін + НСl → глобін + гем Гем + НСl
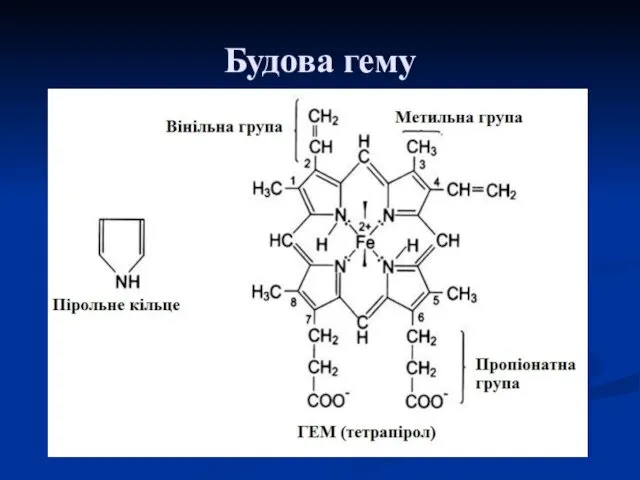
- 35. Будова гему
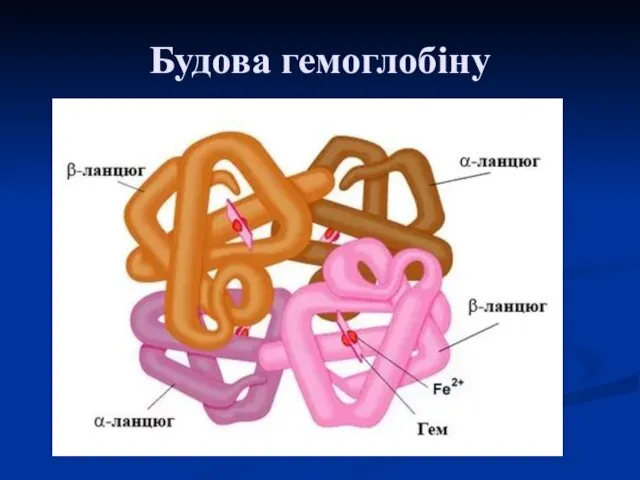
- 36. Будова гемоглобіну
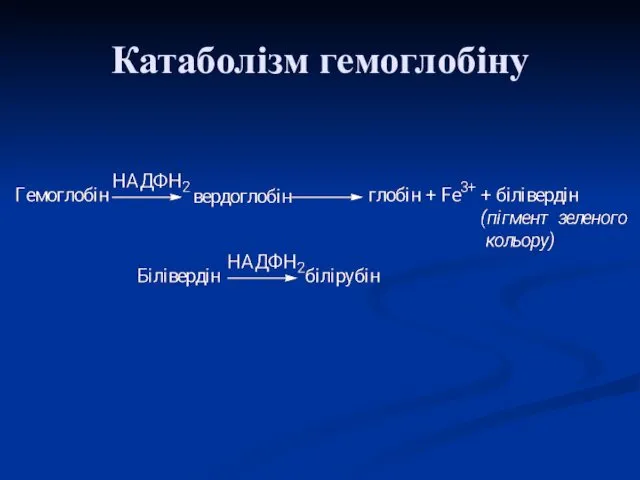
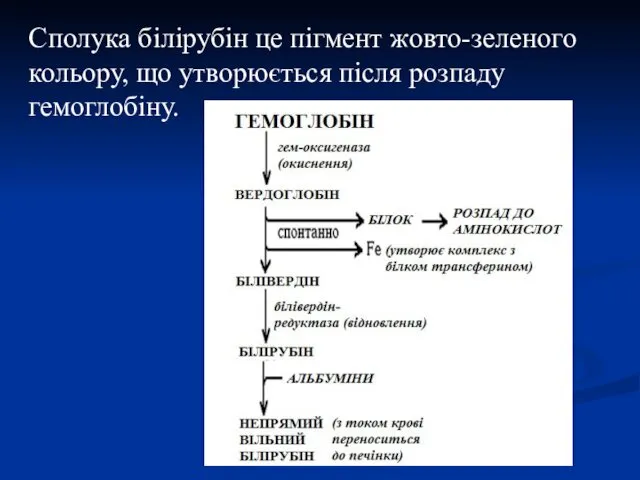
- 37. Деградація гемоглобіну В організмі людини протягом 1 год. руйнується близько 100-200 млн еритроцитів. Розпад починається в
- 38. В подальшому білівердін відновлюється білівердінредуктазою до помаранчевого білірубіну. Ці зміни кольору легко можна спостерігати in vivo
- 39. Катаболізм гемоглобіну
- 40. Сполука білірубін це пігмент жовто-зеленого кольору, що утворюється після розпаду гемоглобіну.
- 41. Метаболізм білірубіну 1. Транспорт білірубіну кров'ю і надходження в паренхімальні клітини печінки. Так як він погано
- 42. 2. Детоксикація білірубіну в клітинах печінки. Після того як білірубін в печінці двічі кон’югується з активованою
- 43. Детоксикація білірубіну в печінці (кон’югація з глюкуроновою кислотою)
- 44. 3. Секреція білірубіну в жовч і виведення з організму. В кишечнику кон’югат білірубіну знову частково розщеплюється
- 45. Секреція білірубіну та виведення з організму
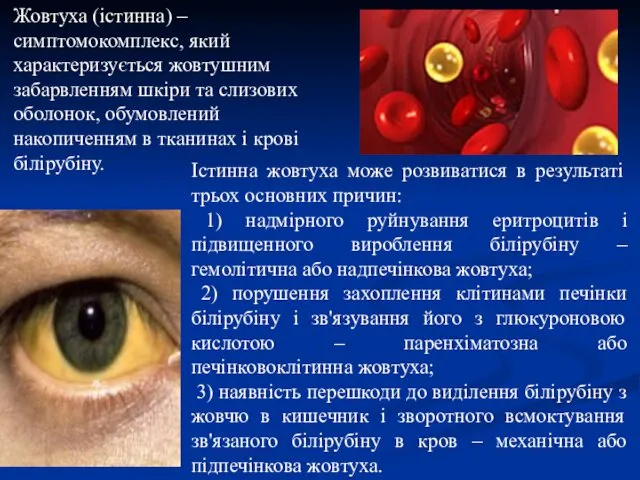
- 46. Жовтуха (істинна) – симптомокомплекс, який характеризується жовтушним забарвленням шкіри та слизових оболонок, обумовлений накопиченням в тканинах
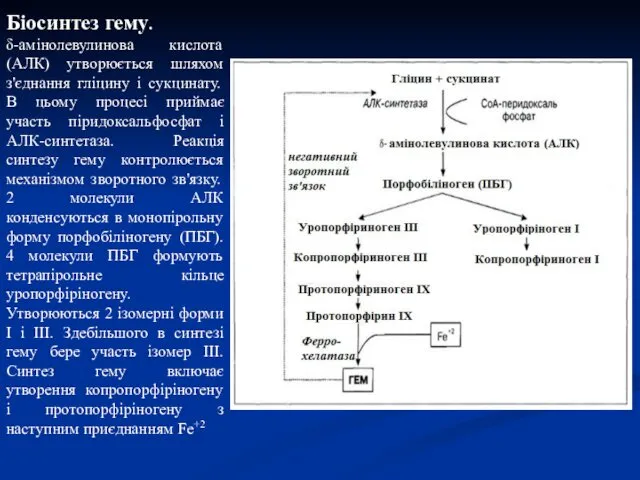
- 47. Біосинтез гему
- 48. Біосинтез гему. δ-амінолевулинова кислота (АЛК) утворюється шляхом з'єднання гліцину і сукцинату. В цьому процесі приймає участь
- 49. Патології Відомо ряд захворювань, причинами яких є спадкові або набуті порушення порфіринового синтезу, так звані порфірії.
- 50. При порфіріях частими є також неврологічні порушення. Можливо, що в основі середньовічних легенд про людей-вампірів (дракул)
- 52. Скачать презентацию






























 Мыс Cu – элементтердің периодтық жүйесінің І-тобындағы химиялық элемент
Мыс Cu – элементтердің периодтық жүйесінің І-тобындағы химиялық элемент Презентация по Химии "Названия элементов" - скачать смотреть бесплатно
Презентация по Химии "Названия элементов" - скачать смотреть бесплатно Группа галогенов в периодической системе
Группа галогенов в периодической системе ПОЛУЧЕНИЕ СИВУШНЫХ МАСЕЛ И СПИРТА ПРИ БРОЖЕНИИ УГЛЕВОДОВ Кейс 2
ПОЛУЧЕНИЕ СИВУШНЫХ МАСЕЛ И СПИРТА ПРИ БРОЖЕНИИ УГЛЕВОДОВ Кейс 2 Общие свойства металлов. Сплавы
Общие свойства металлов. Сплавы Презентация по Химии "Ломоносов Михайло Васильевич" - скачать смотреть
Презентация по Химии "Ломоносов Михайло Васильевич" - скачать смотреть  Реакция Пфитцингера
Реакция Пфитцингера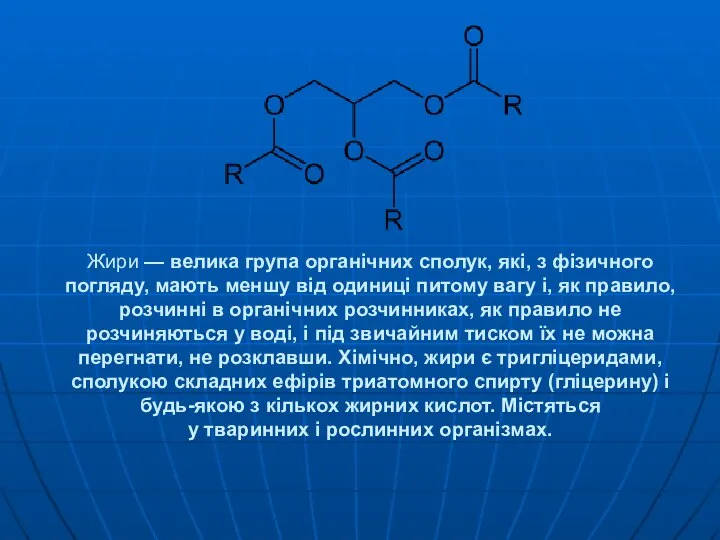 Жири — велика група органічних сполук, які, з фізичного погляду, мають меншу від одиниці питому вагу і, як правило, розчинні в
Жири — велика група органічних сполук, які, з фізичного погляду, мають меншу від одиниці питому вагу і, як правило, розчинні в  Графическое представление газовых процессов. (10 класс)
Графическое представление газовых процессов. (10 класс) Мило. Синтетичні миючі засоби.
Мило. Синтетичні миючі засоби.  Степень окисления. Ряд напряжений. (Лекция 2.1)
Степень окисления. Ряд напряжений. (Лекция 2.1) Геохимическая классификация элементов
Геохимическая классификация элементов Несколько слов о химии
Несколько слов о химии Физические и химические свойства кислот
Физические и химические свойства кислот Практическая работа по химии. Строение пламени
Практическая работа по химии. Строение пламени Физическая технология топлива. Направления переработки нефти. Классификация нефтепродуктов
Физическая технология топлива. Направления переработки нефти. Классификация нефтепродуктов Викторина по биологии и химии (вопросы)
Викторина по биологии и химии (вопросы) Спирты: классификация, изомерия, номенклатура Подготовила учитель химии Несмеянова М.В. МОУ «Сытьковская СОШ»Рузский район М
Спирты: классификация, изомерия, номенклатура Подготовила учитель химии Несмеянова М.В. МОУ «Сытьковская СОШ»Рузский район М ГИА по химии
ГИА по химии Развитие российской нефтепереработки и нефтехимии
Развитие российской нефтепереработки и нефтехимии Мир зеркал
Мир зеркал Планетарная модель атома и его строение
Планетарная модель атома и его строение Гидролиз
Гидролиз Углеводороды нефти и газа. Тема 1. Алканы нефти и газа
Углеводороды нефти и газа. Тема 1. Алканы нефти и газа Классификация электрохимических методов анализа
Классификация электрохимических методов анализа Современная нефтехимия
Современная нефтехимия «Углерод». Презентация к открытому уроку химии 9 класс. Выполнила: Отряскина Т. А.
«Углерод». Презентация к открытому уроку химии 9 класс. Выполнила: Отряскина Т. А.  Сера и ее соединения
Сера и ее соединения