Содержание
- 2. Окислительно-восстановительные процессы Окислительно-восстановительными реакциями называются реакции, в ходе которых изменяются степени окисления элементов, входящих в состав
- 3. Окислители и восстановители О В Окислители — это частицы (атомы, молекулы или ионы), которые принимают электроны
- 4. Степень окисления
- 5. Поскольку молекулы веществ электро-нейтральны, алгебраическая сумма степеней окисления атомов в молекуле равна нулю. Сумма степеней окисления
- 6. Определите степени окисления всех элементов в веществах и ионах: а) Ca(ClO2)2 д) (P2O4)4- б) NH4Cl е)
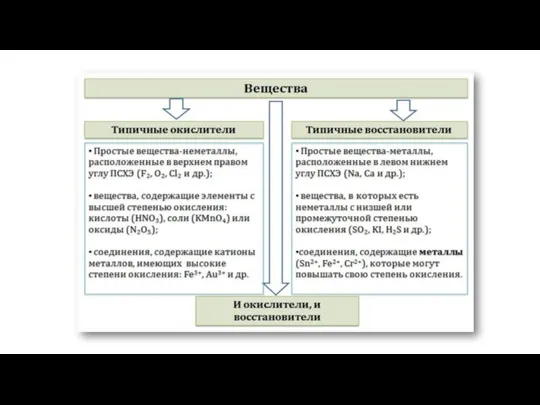
- 8. К типичным окислителям относят: простые вещества-неметаллы с наиболее сильными окислительными свойствами (фтор F2, кислород O2, хлор
- 9. Типичные восстановители – это, как правило: простые вещества-металлы (восстановительные способности металлов определяются рядом электрохимической активности); сложные
- 12. В лабораторной практике наиболее часто используются следующие окислители: перманганат калия (KMnO4); дихромат калия (K2Cr2O7); азотная кислота
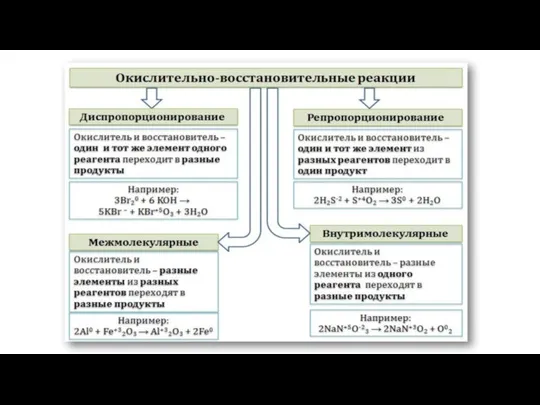
- 13. Классификация окислительно-восстановительных реакций Межмолекулярные реакции протекают с изменением степени окисления разных элементов из разных реагентов. При
- 15. Основные правила составления окислительно-восстановительных реакций Окислительно-восстановительные реакции сопровождаются процессами окисления и восстановления: Окисление — это процесс
- 16. Метод электронного баланса
- 19. Общие закономерности протекания окислительно-восстановительных реакций Продукты окислительно-восстановительных реакций зачастую зависят от условий проведения процесса. Рассмотрим основные
- 20. Среда протекания реакции позволяет определить состав и форму существования остальных продуктов ОВР. Основной принцип — продукты
- 21. Также на направление протекания ОВР влияет природа реагирующих веществ. Например, при взаимодействии азотной кислоты HNO3 с
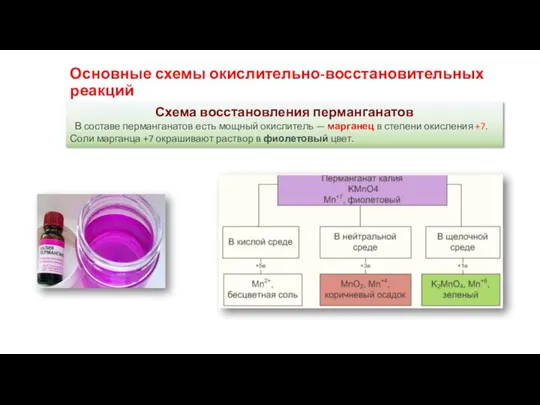
- 22. Основные схемы окислительно-восстановительных реакций Схема восстановления перманганатов В составе перманганатов есть мощный окислитель — марганец в
- 23. Рассмотрим взаимодействие перманганата калия KMnO4 с сульфидом калия в кислой, нейтральной и щелочной средах. В этих
- 24. Схема восстановления хроматов/бихроматов Особенностью хрома с валентностью VI является то, что он образует 2 типа солей
- 25. Соединения хрома VI окисляют: неметаллы в отрицательной степени окисления до простых веществ (со степенью окисления 0),
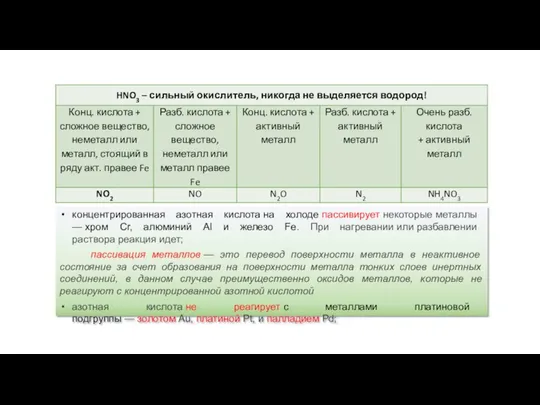
- 26. Окислительные свойства азотной кислоты Азотная кислота HNO3 при взаимодействии с металлами практически никогда не образует водород,
- 27. концентрированная азотная кислота на холоде пассивирует некоторые металлы — хром Cr, алюминий Al и железо Fe.
- 28. Взаимодействие металлов с серной кислотой Разбавленная серная кислота взаимодействует с металлами, как обычная минеральная кислота. Т.е.
- 29. Основные принципы взаимодействия концентрированной серной кислоты с металлами 1. Концентрированная серная кислота пассивирует алюминий, хром, железо
- 32. Скачать презентацию

























 Атом. Будова атома
Атом. Будова атома ЛЕКЦИЯ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЙ и КЛЕТОЧНЫЙ УРОВНИ ОРГАНИЗАЦИИ ЖИЗНИ. ГЕНЕТИЧЕСКИЙ МАТЕРИАЛ и его ХАРАКТЕРИСТИКИ. РЕПЛИКАЦИ
ЛЕКЦИЯ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЙ и КЛЕТОЧНЫЙ УРОВНИ ОРГАНИЗАЦИИ ЖИЗНИ. ГЕНЕТИЧЕСКИЙ МАТЕРИАЛ и его ХАРАКТЕРИСТИКИ. РЕПЛИКАЦИ Склероглюкан
Склероглюкан Биотехнологии Генная инженерия
Биотехнологии Генная инженерия  Полимерные реагенты в бурении
Полимерные реагенты в бурении Керамика
Керамика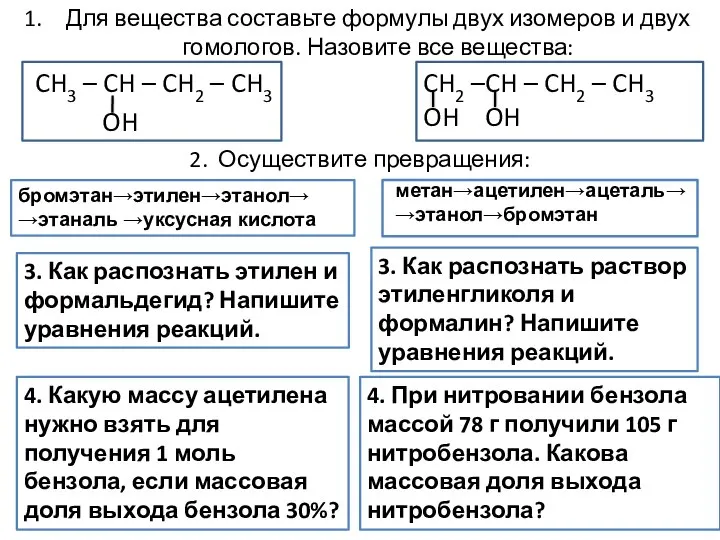 Формулы двух изомеров и двух гомологов
Формулы двух изомеров и двух гомологов Полимеры. Строение, способ образования, особенности, применение полимеров
Полимеры. Строение, способ образования, особенности, применение полимеров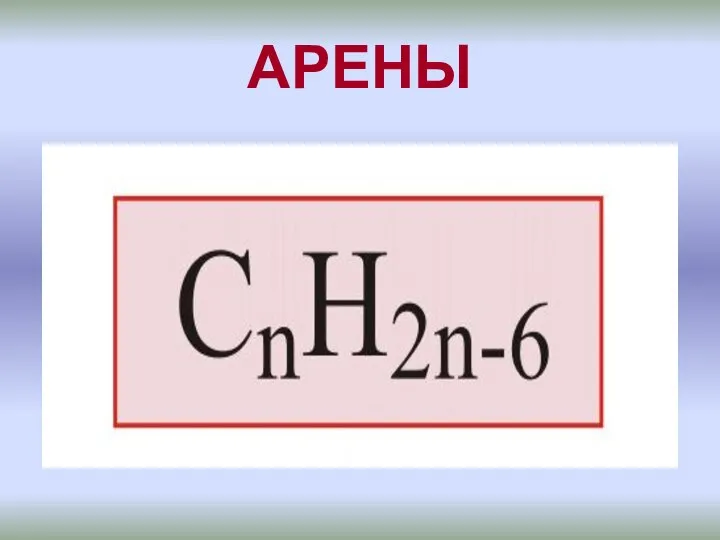 Бензоидные ароматические углеводороды - арены
Бензоидные ароматические углеводороды - арены Виконала: Учениця 11-Б класу Санницька Юля Хімічний та фізичний склад та використання нафти
Виконала: Учениця 11-Б класу Санницька Юля Хімічний та фізичний склад та використання нафти  Готовимся к ЕГЭ Окислительно-восстановительные реакции
Готовимся к ЕГЭ Окислительно-восстановительные реакции Платина. Знаходження в періодичній системі і основні характеристики
Платина. Знаходження в періодичній системі і основні характеристики Презентация по Химии "Синтетические лекарственные средства" - скачать смотреть бесплатно
Презентация по Химии "Синтетические лекарственные средства" - скачать смотреть бесплатно Производство метанола и этанола
Производство метанола и этанола Заттың сұйық фазадағы ерітілген концентрациясының беттік тартылысқа тәуелділігі. Беттік керілу. Дәріс 5
Заттың сұйық фазадағы ерітілген концентрациясының беттік тартылысқа тәуелділігі. Беттік керілу. Дәріс 5 Дисперсные системы. Лиофобные дисперсные системы (часть 1)
Дисперсные системы. Лиофобные дисперсные системы (часть 1) Выполнил: ученики 9 класса Проверил: учитель химии Санеева Л.П.
Выполнил: ученики 9 класса Проверил: учитель химии Санеева Л.П.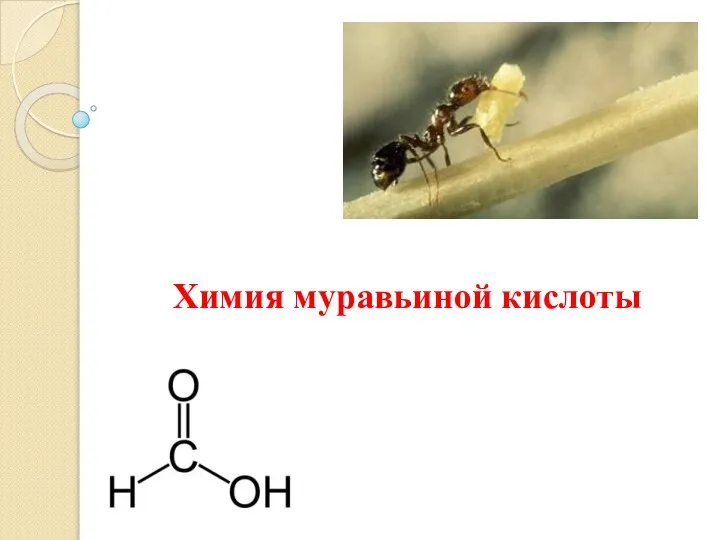 Химия муравьиной кислоты
Химия муравьиной кислоты Органическая химия
Органическая химия Бинарный урок. Минеральные удобрения. (9 класс)
Бинарный урок. Минеральные удобрения. (9 класс) Аскорбиновая кислота. Глютаминовая кислота. Кислота аминокапроновая
Аскорбиновая кислота. Глютаминовая кислота. Кислота аминокапроновая Скорость химических реакций. Катализ. Химическое равновесие
Скорость химических реакций. Катализ. Химическое равновесие Система микросомального окисления
Система микросомального окисления Бензол и его свойства
Бензол и его свойства Липиды. Классификация, строение, свойства, биологическая роль
Липиды. Классификация, строение, свойства, биологическая роль Биоэнергетика. Современное представление о биологическом окислении
Биоэнергетика. Современное представление о биологическом окислении Липиды. Классификация липидов
Липиды. Классификация липидов Хлор. Состав. Строение
Хлор. Состав. Строение