Слайд 3

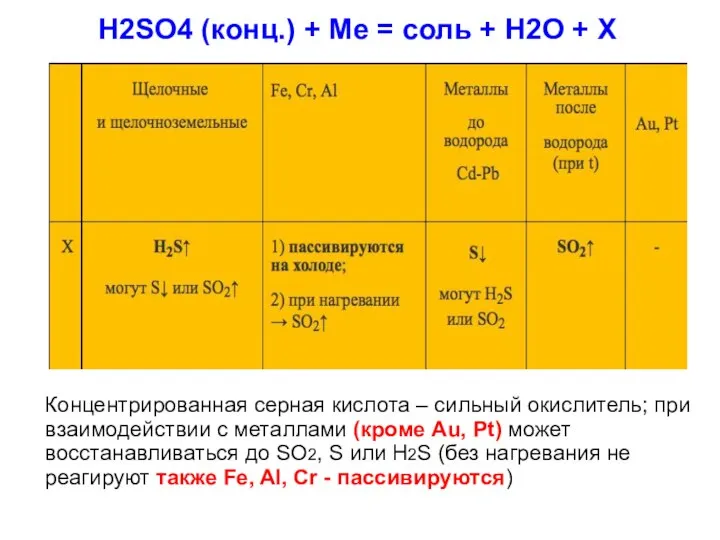
2. Взаимодействие серной кислоты с металлами:
Разбавленная серная кислота ведет себя, как
обычная кислота. Активные металлы, стоящие в ряду напряжений левее водорода
Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au
вытесняют водород из разбавленной серной кислоты. Мы видим пузырьки водорода при добавлении разбавленной серной кислоты в пробирку с цинком.
H2SO4 + Zn = Zn SO4 + H2 ↑
Медь стоит в ряду напряжений после водорода – поэтому разбавленная серная кислота не действует на медь.



 Эволюция антропогенных загрязнений в окружающей среде. Роль физико-химических явлений
Эволюция антропогенных загрязнений в окружающей среде. Роль физико-химических явлений Альдегиды и кетоны
Альдегиды и кетоны Полимеры. Протезы трахеи
Полимеры. Протезы трахеи Непредельные углеводороды: этилен
Непредельные углеводороды: этилен Природній газ
Природній газ  Неметаллические конструкционные материалы
Неметаллические конструкционные материалы Пептиды. Белки
Пептиды. Белки Мышьяк. Висмут. Сурьма
Мышьяк. Висмут. Сурьма Основные задачи токсикологической химии в аналитической диагностике наркотических и психотропных веществ
Основные задачи токсикологической химии в аналитической диагностике наркотических и психотропных веществ Гликогенді және кетогенді аминқышқылдары. Биологиялық рөлі
Гликогенді және кетогенді аминқышқылдары. Биологиялық рөлі Солі амонію
Солі амонію  Химическая связь
Химическая связь Классификация химических реакций
Классификация химических реакций Биоэнергетика. Современное представление о биологическом окислении
Биоэнергетика. Современное представление о биологическом окислении Определение концентрации хлорид – ионов в питьевой воде
Определение концентрации хлорид – ионов в питьевой воде Альдегиды и кетоны
Альдегиды и кетоны Дисахариды Ширяева София ХБ-4 г.Липецк 2012
Дисахариды Ширяева София ХБ-4 г.Липецк 2012 Типы химических реакций
Типы химических реакций Сульфат меди
Сульфат меди Кислородсодержащие. Углеводы. Подготовка к ЕГЭ
Кислородсодержащие. Углеводы. Подготовка к ЕГЭ ЖЕЛЕЗО – элемент побочной подгруппы
ЖЕЛЕЗО – элемент побочной подгруппы Чугуны и стали
Чугуны и стали Ситуационная задача по биохимии
Ситуационная задача по биохимии Кинетика химических реакций. Основные понятия и законы химической кинетики
Кинетика химических реакций. Основные понятия и законы химической кинетики Химические формулы. 8 класс
Химические формулы. 8 класс Химические свойства хрома
Химические свойства хрома Обмен липидов
Обмен липидов Процессы сульфирования в промышленности
Процессы сульфирования в промышленности