Содержание
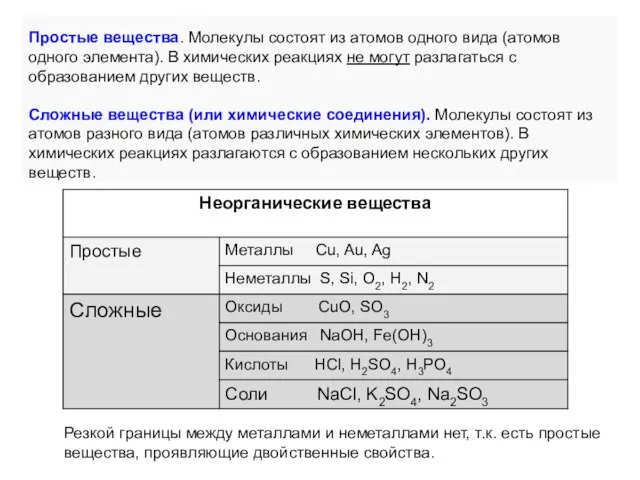
- 2. Простые вещества. Молекулы состоят из атомов одного вида (атомов одного элемента). В химических реакциях не могут
- 3. это бинарные соединения, состоящие из атомов химического элемента и кислорода ( в степени окисления -2). Общая
- 4. Номенклатура оксидов В настоящее время общепринятой является международная номенклатура оксидов. ОКСИД + Э(русское название, род. падеж)
- 5. Получение оксидов 1. Взаимодействие простых и сложных веществ с кислородом: CH4 + 2O2 = CO2 +
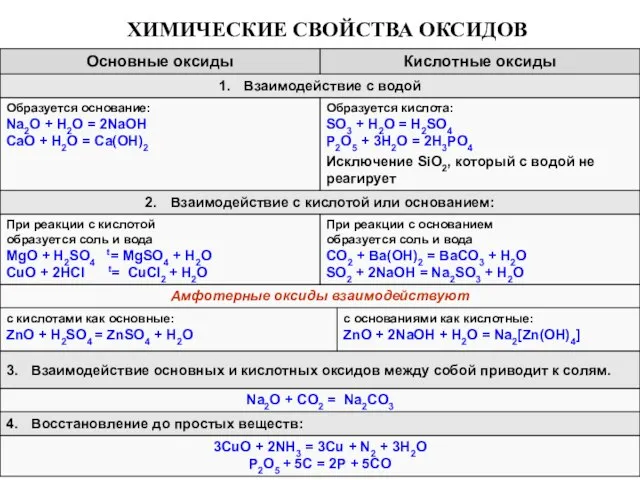
- 6. ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВ
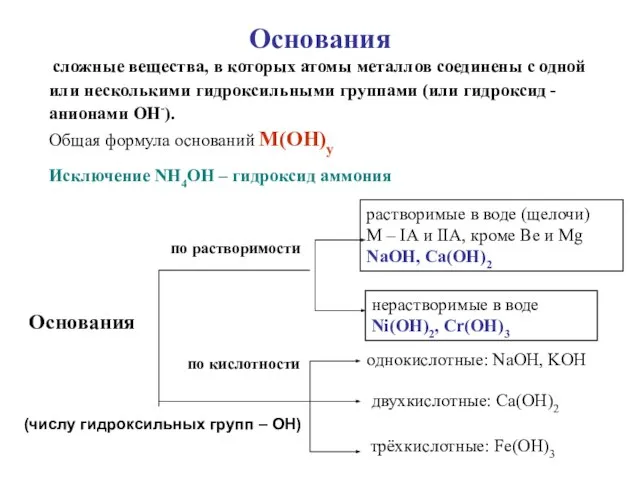
- 7. Основания сложные вещества, в которых атомы металлов соединены с одной или несколькими гидроксильными группами (или гидроксид
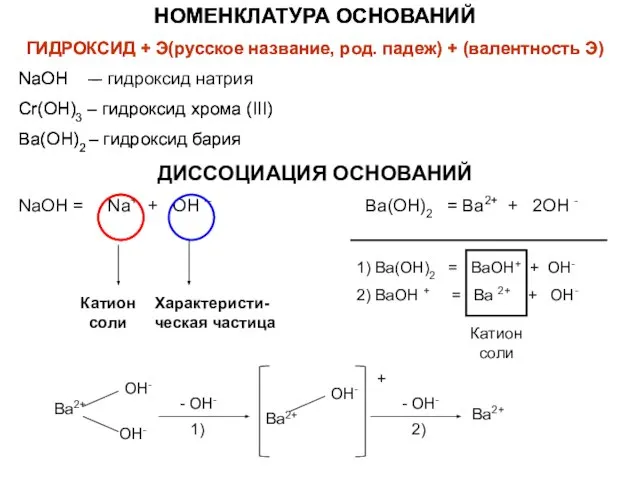
- 8. НОМЕНКЛАТУРА ОСНОВАНИЙ ГИДРОКСИД + Э(русское название, род. падеж) + (валентность Э) NaOH – гидроксид натрия Cr(OH)3
- 9. Получение оснований 1. Реакции активных металлов ( щелочных и щелочноземельных металлов) с водой: 2Na + 2H2O
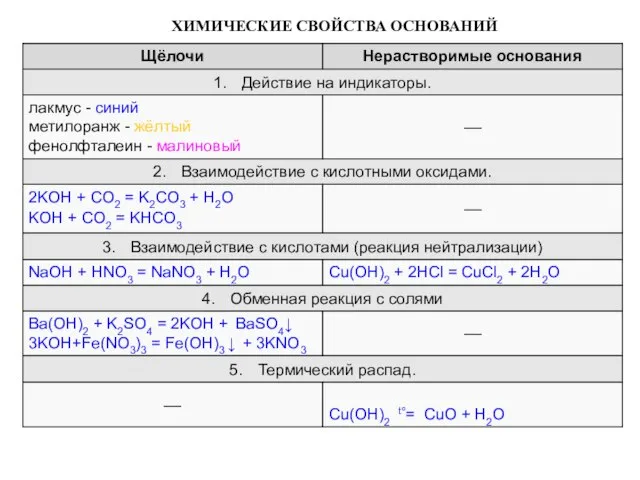
- 10. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ
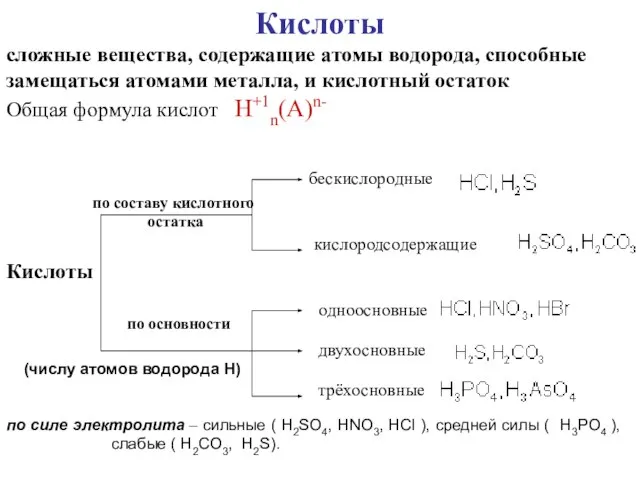
- 11. Кислоты сложные вещества, содержащие атомы водорода, способные замещаться атомами металла, и кислотный остаток Общая формула кислот
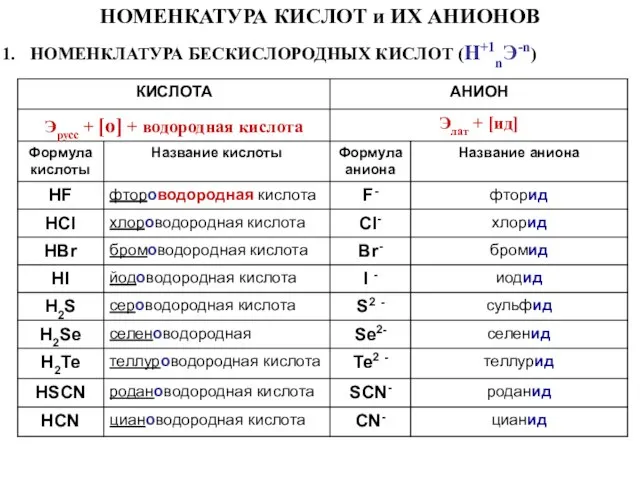
- 12. НОМЕНКАТУРА КИСЛОТ и ИХ АНИОНОВ НОМЕНКЛАТУРА БЕСКИСЛОРОДНЫХ КИСЛОТ (Н+1nЭ-n)
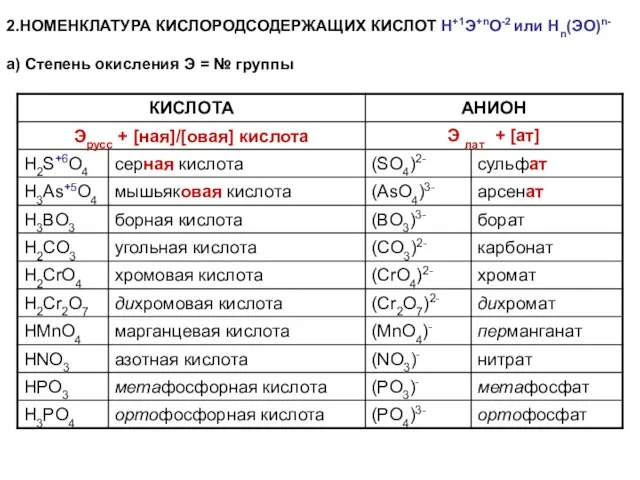
- 13. 2.НОМЕНКЛАТУРА КИСЛОРОДСОДЕРЖАЩИХ КИСЛОТ Н+1Э+nО-2 или Нn(ЭО)n- а) Степень окисления Э = № группы
- 14. б) Степень окисления Э ЗАДАНИЕ: Выучить все кислоты и их анионы (формулы и названия) по задачнику
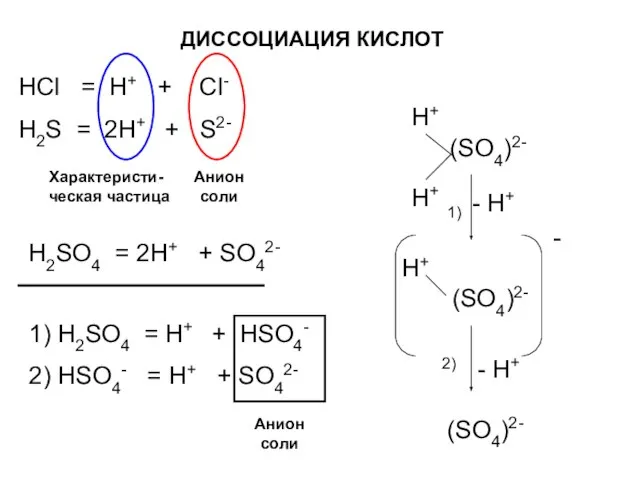
- 15. ДИССОЦИАЦИЯ КИСЛОТ HCl = H+ + Cl- H2S = 2H+ + S2- Анион соли Характеристи-ческая частица
- 16. Получение кислот 1. Взаимодействие кислотного оксида с водой (для кислородсодержащих кислот): SO3 + H2O = H2SO4
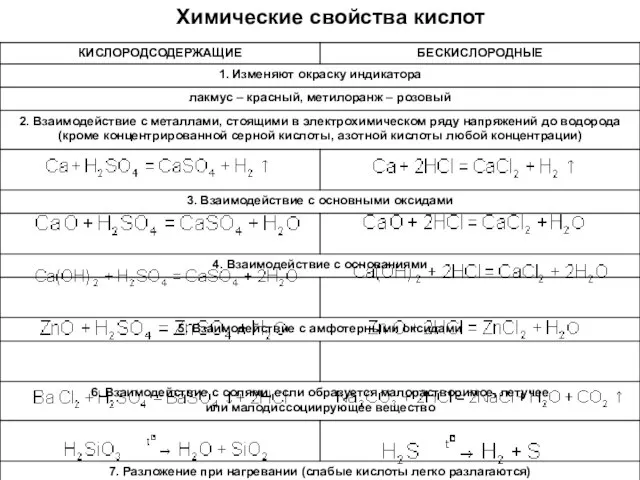
- 17. Химические свойства кислот
- 18. СОЛИ сложные вещества, которые являются продуктами замещения атомов водорода в молекулах кислот атомами металла Общая формула
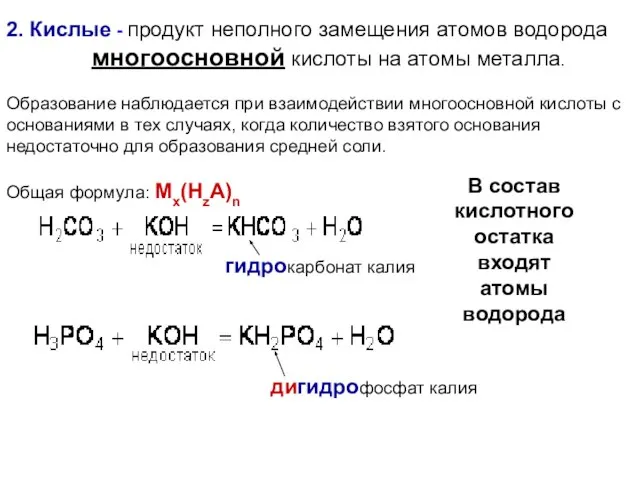
- 19. 2. Кислые - продукт неполного замещения атомов водорода многоосновной кислоты на атомы металла. Образование наблюдается при
- 20. ОБЩЕЕ КОЛИЧЕСТВО КИСЛЫХ СОЛЕЙ рассчитывается по КИСЛОТЕ: ОСНОВНОСТЬ КИСЛОТЫ - 1 Для H2SO4 общее количество кислых
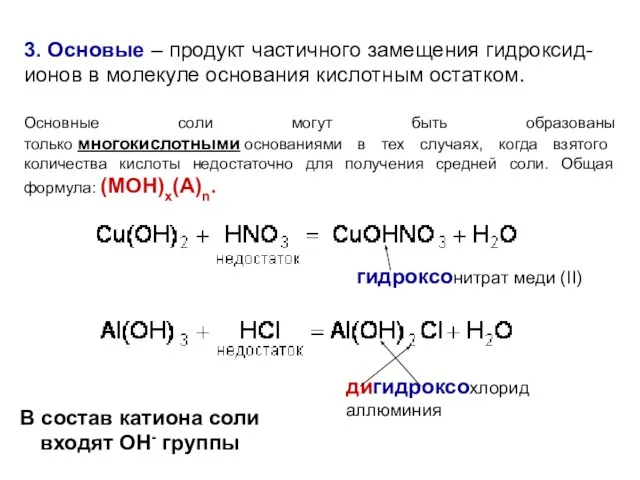
- 21. 3. Основые – продукт частичного замещения гидроксид-ионов в молекуле основания кислотным остатком. Основные соли могут быть
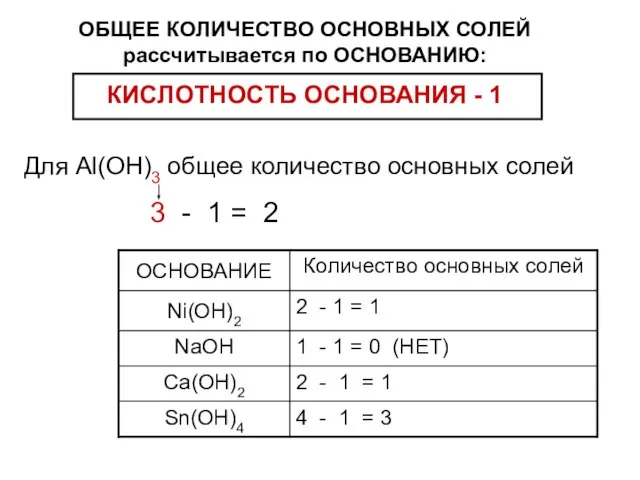
- 22. Для Al(ОH)3 общее количество основных солей 3 - 1 = 2 ОБЩЕЕ КОЛИЧЕСТВО ОСНОВНЫХ СОЛЕЙ рассчитывается
- 23. 4. Двойные соли состоят из ионов двух разных металлов и кислотного остатка. KNaCO3 – карбонат натрия
- 24. ПОЛУЧЕНИЕ СРЕДНИХ СОЛЕЙ
- 25. Химические свойства средних солей Ряд активности металлов (электрохимический ряд напряжения металлов) Li K Ba Sr Ca
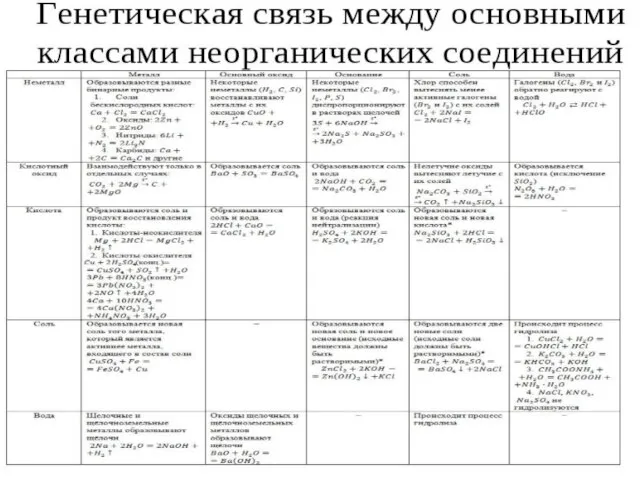
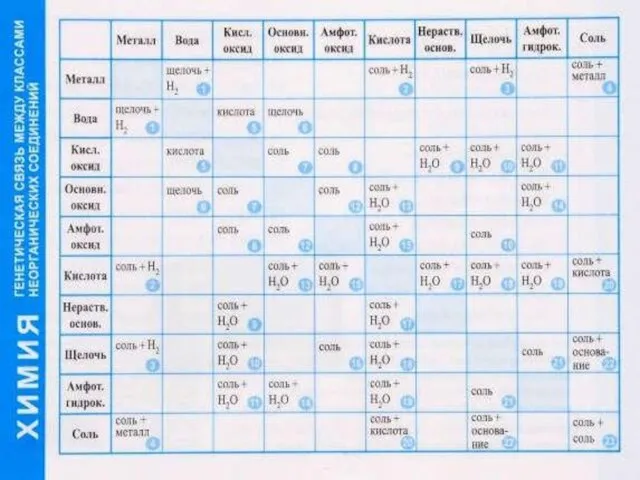
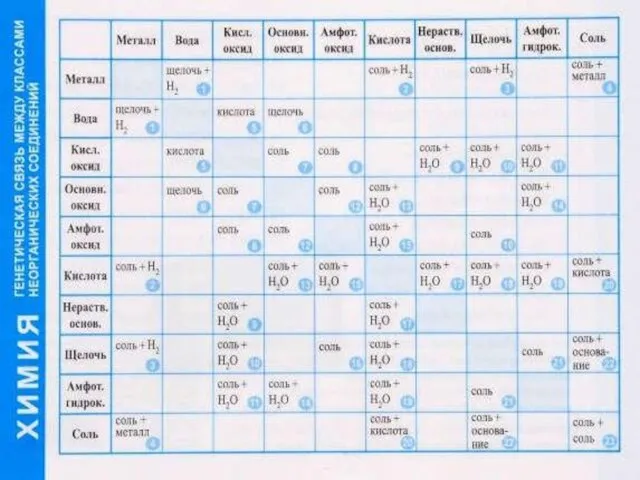
- 26. Между классами неорганических соединений существует тесная генетическая связь.
- 27. Генетические связи - это связи между разными классами, основанные на их взаимопревращениях. Зная классы неорганических веществ,
- 28. Среди неметаллов также можно выделить две разновидности рядов: Генетический ряд неметаллов, где в качестве звена ряда
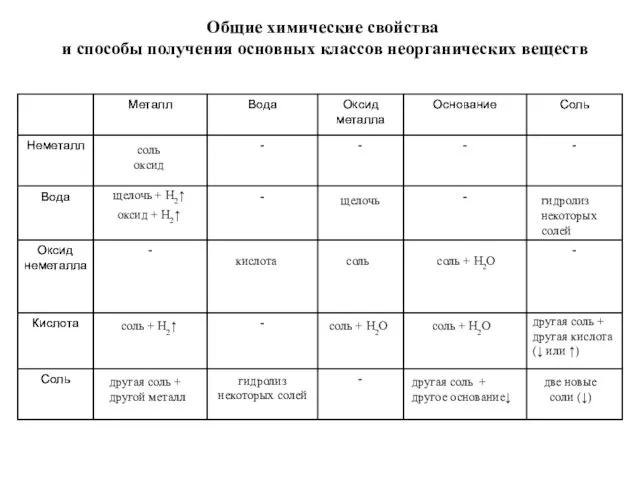
- 29. Общие химические свойства и способы получения основных классов неорганических веществ
- 33. Задача №1: Какие степени окисления проявляет хлор в ряду соединений: HCl, Cl2O7, HClO и вещества каких
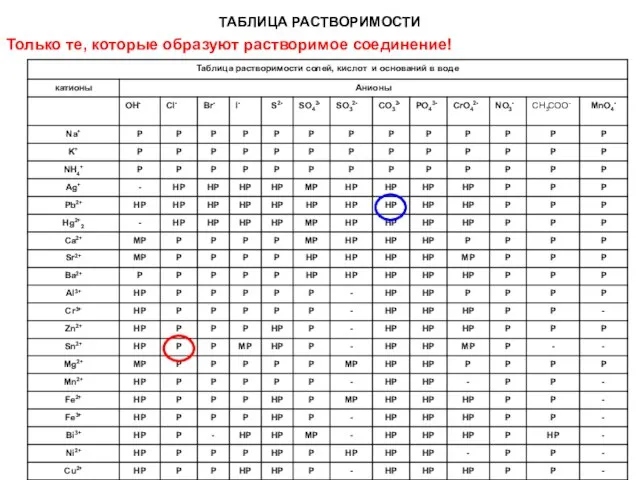
- 34. ТАБЛИЦА РАСТВОРИМОСТИ Только те, которые образуют растворимое соединение!
- 35. Задача №3: Написать реакции, соответствующие следующей цепочке превращений, назвать все продукты реакций (решение по таблице генетической
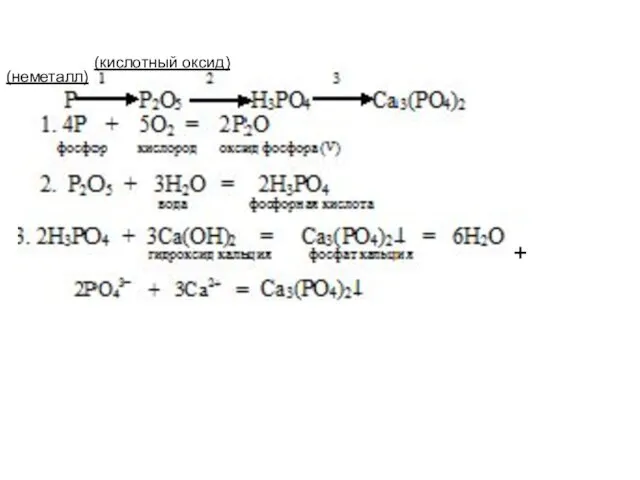
- 37. + (кислотный оксид) (неметалл)
- 39. Скачать презентацию

















 Лекция 2. Строение атома и Периодический закон Д.И. Менделеева
Лекция 2. Строение атома и Периодический закон Д.И. Менделеева Органическая химия. Фенолы
Органическая химия. Фенолы Автометаморфизм
Автометаморфизм Синтез метилового эфира цинкофорина
Синтез метилового эфира цинкофорина Презентация по химии Электролиз
Презентация по химии Электролиз  Пластмассы, резины и композиционные материалы
Пластмассы, резины и композиционные материалы Элементы группы VII B
Элементы группы VII B Основания. Классификация оснований
Основания. Классификация оснований Аминокислоты
Аминокислоты Роль ученых в становлении органической химии
Роль ученых в становлении органической химии Изготовление водных растворов. Частные случаи растворения
Изготовление водных растворов. Частные случаи растворения Химические элементы. Типы связей
Химические элементы. Типы связей Воздух. Состав воздуха. Реакция горения
Воздух. Состав воздуха. Реакция горения Соединения терпеноидной структуры. Тема № 3
Соединения терпеноидной структуры. Тема № 3 Титрування. Хімічний посуд в титриметричному аналізі
Титрування. Хімічний посуд в титриметричному аналізі Элементтер-органогендер. «өмір металдары». Көміртек – органикалық қосылыстардың негізін құраушы
Элементтер-органогендер. «өмір металдары». Көміртек – органикалық қосылыстардың негізін құраушы Презентация по Химии "мінеральні добрива." - скачать смотреть бесплатно_
Презентация по Химии "мінеральні добрива." - скачать смотреть бесплатно_ Презентация по Химии "Металлы. Общая характеристика металлов (нахождение в природе и физические свойства)" - скачать смотреть
Презентация по Химии "Металлы. Общая характеристика металлов (нахождение в природе и физические свойства)" - скачать смотреть  Вода и другие макронутриенты (органические кислоты, дубильные вещества, пигменты и фитонциды)
Вода и другие макронутриенты (органические кислоты, дубильные вещества, пигменты и фитонциды) Информирование медицинских работников о лекарственном препарате Золпидем
Информирование медицинских работников о лекарственном препарате Золпидем Химическая организация клетки
Химическая организация клетки Биохимия, наука о химических основах жизнедеятельности
Биохимия, наука о химических основах жизнедеятельности Выращивание кристаллов. Итоговый индивидуальный проект по химии
Выращивание кристаллов. Итоговый индивидуальный проект по химии Получение металлов. Металлы в природе
Получение металлов. Металлы в природе Дисперстік жүйелердің тұрақтылығы. ДЛФО теориясы
Дисперстік жүйелердің тұрақтылығы. ДЛФО теориясы Химический элемент
Химический элемент Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады)
Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады) Комплексные соединения
Комплексные соединения