Техника безопасности при проведении практических работ
В опытах используются концентрированные растворы кислот,
сильные окислители, едкие и ядовитые вещества – нельзя допустить их попадания на кожу и внутрь.
Каждый опыт проводить только с указанными количествами реагентов – не более! Нарушение может вызвать химические ожоги, повреждение имущества и отравления.
В случае опасности отравления галогенами или летучими кислотами необходимо использовать р-р аммиака для нейтрализации воздействия.
Используйте стаканы для сливов и стаканы для нейтрализации, чтобы избежать скопления потенциально опасных веществ в пробирках в штативе.




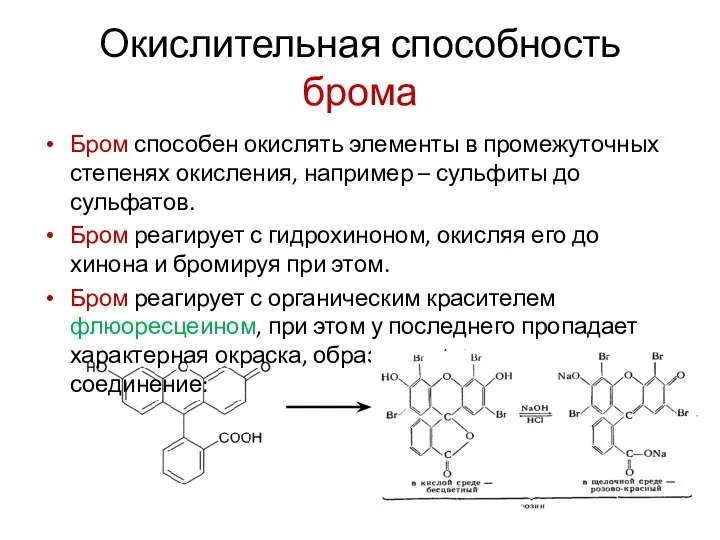


 Применение алкинов
Применение алкинов Кристаллография. Кристаллическое состояние
Кристаллография. Кристаллическое состояние Углеводы. Классификация углеводов
Углеводы. Классификация углеводов Основные классы неорганических веществ
Основные классы неорганических веществ Кислоты
Кислоты Inert metals
Inert metals Неметаллы. Положение неметаллов в ПСХЭ Д.И. Менделеева. Галогены
Неметаллы. Положение неметаллов в ПСХЭ Д.И. Менделеева. Галогены Химия переходных элементов. Триада железа и металлы платиновой группы
Химия переходных элементов. Триада железа и металлы платиновой группы Пищевые кислоты Выполнил: Черепнин Евгений Группа: ТХ-921
Пищевые кислоты Выполнил: Черепнин Евгений Группа: ТХ-921  Последствия применения удобрений в сельском хозяйстве
Последствия применения удобрений в сельском хозяйстве Задача №7. По щам! Команда Карбораны
Задача №7. По щам! Команда Карбораны Азот
Азот V и III группы периодической системы элементов Д.И. Менделеева
V и III группы периодической системы элементов Д.И. Менделеева Установка гидрокрекинга в составе завода глубокой переработки нефти ООО Кинеф
Установка гидрокрекинга в составе завода глубокой переработки нефти ООО Кинеф Фосфор
Фосфор Спиртовое, масляное и кисломолочное брожение
Спиртовое, масляное и кисломолочное брожение Сера
Сера Химические свойства металлов Урок химии в 11 классе
Химические свойства металлов Урок химии в 11 классе Фосфориты. Добыча фосфоритов
Фосфориты. Добыча фосфоритов Гидролиз солей
Гидролиз солей Роль взаимодействия серотонин- и дофаминергической систем в иммуномодуляции
Роль взаимодействия серотонин- и дофаминергической систем в иммуномодуляции Кислоты и их свойства
Кислоты и их свойства Минералогическая шкала твёрдости Мооса
Минералогическая шкала твёрдости Мооса Мельхіор, Нейзильбер, застосування і склад інших сплавів для приборів в ТВКП
Мельхіор, Нейзильбер, застосування і склад інших сплавів для приборів в ТВКП ГИА. Вопрос А2. ПЗ и ПСХЭ
ГИА. Вопрос А2. ПЗ и ПСХЭ Строение атома и атомного ядра
Строение атома и атомного ядра Строение атома. Периодическая таблица Менделеева. Химическая связь
Строение атома. Периодическая таблица Менделеева. Химическая связь Презентация по Химии "Органические вещества. Нуклеиновые кислоты" - скачать смотреть
Презентация по Химии "Органические вещества. Нуклеиновые кислоты" - скачать смотреть