Содержание
- 2. Амины Амины – органические соединения, которые можно рассматривать как производные аммиака, в котором атомы водорода (один
- 3. Амины бывают алифатические, ароматические, алициклические и гетероциклические. Они подразделяются на первичные, вторичные и третичные. Например, первичный:
- 4. Физические свойства аминов Простейшие алифатические амины при нормальных условиях представляют собой газы или жидкости с низкой
- 5. Способы получения аминов Нагревание алкилгалогенидов с аммиаком под давлением: Например, CH3Cl + NH3 CH3NH2 + HCl
- 6. 2. Восстановление нитросоединений (ароматические амины): Например, C6H5NO2 + 6[H] C6H5NH2 + 2H2O
- 7. 3. Пропускание смеси спирта и аммиака над поверхностью катализатора (низшие амины): Например, Al2O3 CH3OH + NH3
- 8. Химические свойства аминов Основные свойства: CH3NH2 + H2SO4 [CH3NH3]HSO4 C6H5NH2 + HCl [C6H5NH3]Cl 2. Горение: 4C2H5NH2
- 9. 3. Реакции с азотистой кислотой: а) первичные алифатические: R-NH2 + NaNO2 + HCl R-OH + N2
- 10. Анилин – важнейший представитель аминов Качественное обнаружение анилина: NH2 NH2 Br Br + 3Br2 + 3HBr
- 11. Аминокислоты Аминокислоты – это органические соединения, в состав которых входят карбоксильная группа – COOH и аминогруппа
- 12. Основные группы природных аминокислот: Алифатические предельные аминокислоты (глицин, аланин); Серосодержащие аминокислоты (цистеин); Аминокислоты с алифатической гидроксильной
- 13. Физические свойства аминокислот Твёрдые кристаллические вещества, хорошо растворимые в воде и мало растворимые в органических растворителях.
- 14. Способы получения аминокислот: Гидролиз белковых веществ. Замещение галогена на аминогруппу в соответствующих галогенокислотах: -HCl R-CH-COOH +
- 15. Химические свойства аминокислот 1. Аминокислоты – амфотерные соединения, они реагируют как с кислотами, так и с
- 16. 3. Взаимодействие со спиртами: HCl H2N-CH(R)- COOH + R’OH H2N-CH(R)-COOR’ + H2O
- 17. Пептиды Важнейшее свойство аминокислот – их способность к конденсации с образованием пептидов. R O R’ O
- 18. Качественные реакции на аминокислоты Все аминокислоты окисляются нингидрином с образованием продуктов, окрашенных в сине-фиолетовый цвет. При
- 20. Скачать презентацию



![2. Восстановление нитросоединений (ароматические амины): Например, C6H5NO2 + 6[H] C6H5NH2 + 2H2O](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1187797/slide-5.jpg)

![Химические свойства аминов Основные свойства: CH3NH2 + H2SO4 [CH3NH3]HSO4 C6H5NH2 +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1187797/slide-7.jpg)










 Биологическая химия с основами физической и коллоидной химии
Биологическая химия с основами физической и коллоидной химии Разноцветные кристаллы
Разноцветные кристаллы Гидролиз. Методы его получения и применения
Гидролиз. Методы его получения и применения Йод. Положение в периодической системе
Йод. Положение в периодической системе Формирование ключевых и предметных компетенций учащихся при изучении темы “Металлы”
Формирование ключевых и предметных компетенций учащихся при изучении темы “Металлы” Химиялық формула
Химиялық формула Омский государственный медицинский университет. Кафедра химии. Консультация. Дисциплина «Биоорганическая химия"
Омский государственный медицинский университет. Кафедра химии. Консультация. Дисциплина «Биоорганическая химия" Природные соединения кремния
Природные соединения кремния Химия и косметика Выполнили: Бертова Ольга, Хромова Екатерина 11 кл.
Химия и косметика Выполнили: Бертова Ольга, Хромова Екатерина 11 кл. Общие методические приемы в оценке качества лекарственных форм
Общие методические приемы в оценке качества лекарственных форм :Химиялық реакциялардың кинетикалық жіктелуі.Ферментті катализ.Ферменттердің әсер ету ерекшеліктері
:Химиялық реакциялардың кинетикалық жіктелуі.Ферментті катализ.Ферменттердің әсер ету ерекшеліктері Matter - Its Properties and Measurement
Matter - Its Properties and Measurement 10 класс семинар-написание формул органических веществ
10 класс семинар-написание формул органических веществ Углеводы
Углеводы Химиялық термодинамиканың негіздері. Негізгі түсініктері мен зандары. Термохимиялық есептеулер
Химиялық термодинамиканың негіздері. Негізгі түсініктері мен зандары. Термохимиялық есептеулер Целлюлоза. Ее физические и химические свойства
Целлюлоза. Ее физические и химические свойства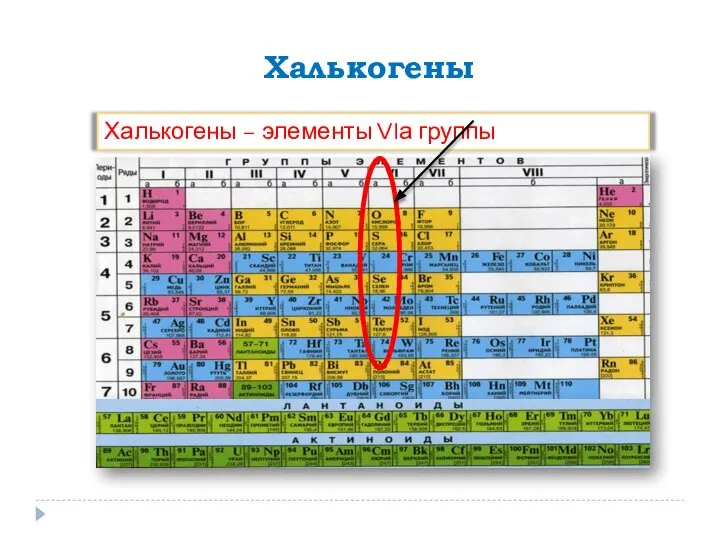 Кислород. Сера
Кислород. Сера Презентация по Химии "Спирти. Хімічні та фізичні властивості спиртів." - скачать смотреть бесплатно
Презентация по Химии "Спирти. Хімічні та фізичні властивості спиртів." - скачать смотреть бесплатно Происхождение химичесих элементов
Происхождение химичесих элементов Карбоновые кислоты
Карбоновые кислоты Резиновая краска
Резиновая краска Биохимия и молекулярная биология. (Лекция 1)
Биохимия и молекулярная биология. (Лекция 1) Катализ теориясы
Катализ теориясы Radical Approach to the Chiral Quaternary Center in Asperaculin A: Synthesis of 9‑Deoxyasperaculin A
Radical Approach to the Chiral Quaternary Center in Asperaculin A: Synthesis of 9‑Deoxyasperaculin A Презентация по Химии "Металлическая связь" - скачать смотреть
Презентация по Химии "Металлическая связь" - скачать смотреть  Free Radical Polymerization
Free Radical Polymerization Химия и физика полимеров. Классификация полимеров
Химия и физика полимеров. Классификация полимеров Классификация химических реакций
Классификация химических реакций