Содержание
- 3. План характеристики: Открытие кремния Получение кремния Строение и свойства атомов Физические свойства кремния Химические свойства кремния
- 4. Открытие кремния Кремний был впервые открыт в 1811 году Гей-Люссаком и Тенаром. Он является одним из
- 5. Входит также в состав растений и животных. Анализ образцов лунного грунта показал наличие SiO2 в количестве
- 8. Получение кремния SiF4+4K=4KF+Si Лабораторный способ: SiO2+2Mg=Si+2MgO Промышленный способ: SiO2+2C=2CO+Si
- 9. Строение и свойства атомов
- 10. Физические свойства кремния Кремний – кристаллическое вещество темно-серого цвета с металлическим блеском. Кристаллическая решетка кремния напоминает
- 11. Химические свойства кремния Si+O2=SiO2 2) Si+NaOH+H2O=Na2SiO3+2H2↑ 3) Si+C=SiC 4) Si+2Mg=Mg2Si 1) Mg2Si+H2O=2Mg(OH)2+SiH4 2) SiH4+2O2=SiO2+2H2O
- 12. Соединение кремния
- 14. Кремний его 26% в природе по распространению в земной коре занимает 2-е место образует оксиды с
- 16. Скачать презентацию













 Ферменты и гормоны Урок химии в 10 (11) классе Автор: учитель химии Ким Н.В. МОУ СОШ №6 г. Нягани ХМАО-Югры Тюменской области
Ферменты и гормоны Урок химии в 10 (11) классе Автор: учитель химии Ким Н.В. МОУ СОШ №6 г. Нягани ХМАО-Югры Тюменской области Квалификация химических реактивов, принятая в РФ
Квалификация химических реактивов, принятая в РФ Стратегії дослідження хімічних сполук з використанням сучасних фізичних методів (частина перша)
Стратегії дослідження хімічних сполук з використанням сучасних фізичних методів (частина перша) Получение, собирание и распознавание водорода
Получение, собирание и распознавание водорода Розчини
Розчини Зелёные камни
Зелёные камни Гормоны. Виды и классификация гормонов
Гормоны. Виды и классификация гормонов Анодные реакции коррозионного процесса
Анодные реакции коррозионного процесса Электрохимические процессы
Электрохимические процессы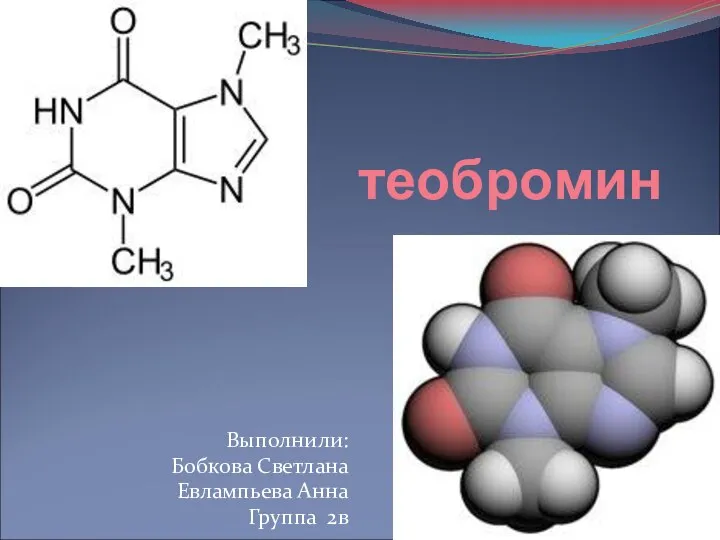 Теобромин
Теобромин Карбо́новые кисло́ты
Карбо́новые кисло́ты Строение атома
Строение атома Смесители. Пропеллерная мешалка
Смесители. Пропеллерная мешалка Презентация по Химии "Применение электролиза" - скачать смотреть
Презентация по Химии "Применение электролиза" - скачать смотреть  Перевариваемые полисахариды злаковых, бобовых, овощей, ягод и фруктов. Крахмал (амилоза, амилопектин), фруктаны (инулин)
Перевариваемые полисахариды злаковых, бобовых, овощей, ягод и фруктов. Крахмал (амилоза, амилопектин), фруктаны (инулин) Р-элементы IV группы: C, Si, Ge, Sn, Pb
Р-элементы IV группы: C, Si, Ge, Sn, Pb Задача №9. Глицерин. Команда Карбораны
Задача №9. Глицерин. Команда Карбораны ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Элективный специальный курс углублённого изучения темы для учащихся 11 классов естеств
ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Элективный специальный курс углублённого изучения темы для учащихся 11 классов естеств Презентация по Химии "Насичені одноатомні спирти" - скачать смотреть бесплатно
Презентация по Химии "Насичені одноатомні спирти" - скачать смотреть бесплатно К 180-летию со дня рождения Д.И. Менделеева
К 180-летию со дня рождения Д.И. Менделеева Пегматитовые месторождения
Пегматитовые месторождения Chemical bonding and Molecular Structure
Chemical bonding and Molecular Structure Обобщающий урок –игра Звездный час по теме Подгруппа кислорода
Обобщающий урок –игра Звездный час по теме Подгруппа кислорода Распределение примесей в процессе выращивания мультикристаллического кремния
Распределение примесей в процессе выращивания мультикристаллического кремния Комплексные соединения
Комплексные соединения Типы химических реакций на примере свойств воды
Типы химических реакций на примере свойств воды  Алкилирование изобутана олефинами
Алкилирование изобутана олефинами Гигиенические нормативы. Химические факторы окружающей среды
Гигиенические нормативы. Химические факторы окружающей среды