Презентация по Химии "Теории кислот и оснований. Классификация реакций и реагентов" - скачать смотреть
Содержание
- 2. В истории развитии любой науки наступает момент, когда накопленный фактический материал нуждается в некой систематизации и
- 3. Результат органических реакций часто объясняют с позиции кислотно-основных свойств органических соединений Теория кислот и оснований имеет
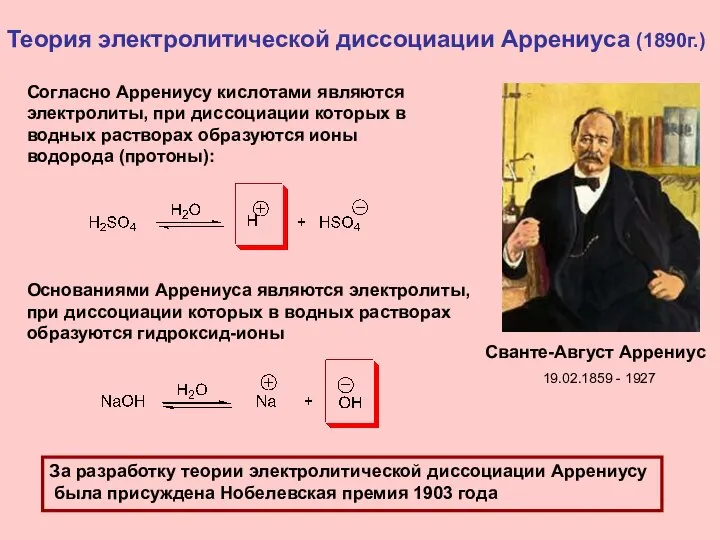
- 4. Теория электролитической диссоциации Аррениуса (1890г.) Сванте-Август Аррениус За разработку теории электролитической диссоциации Аррениусу была присуждена Нобелевская
- 5. Протонная теория, или теория кислот и оснований Бренстеда (1923) Йоханнес-Николаус Брёнстед Согласно теории Бренстеда кислота является
- 6. Протонная теория, или теория кислот и оснований Бренстеда Поскольку взаимодействие между кислотой и основанием является очень
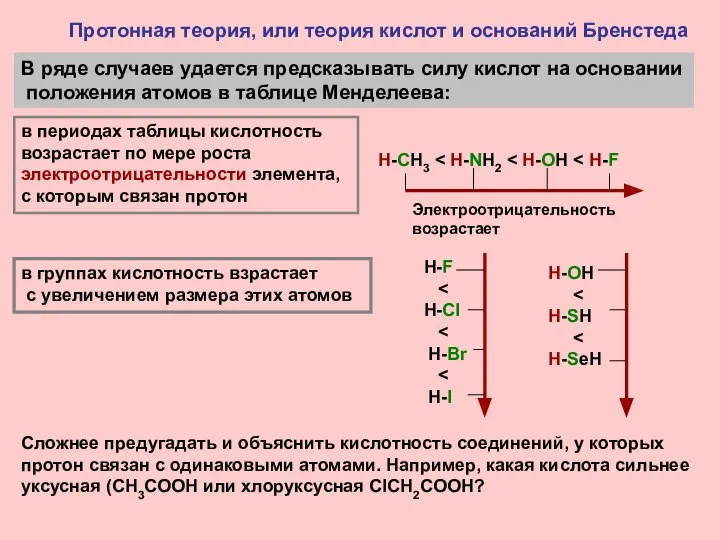
- 7. Протонная теория, или теория кислот и оснований Бренстеда В ряде случаев удается предсказывать силу кислот на
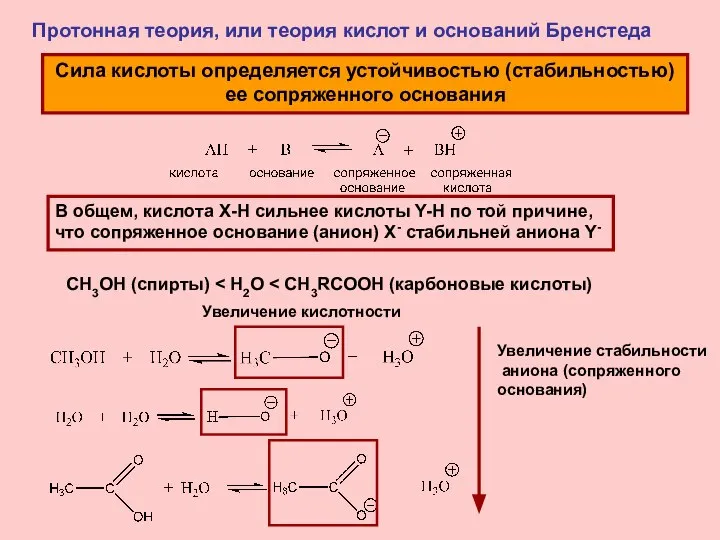
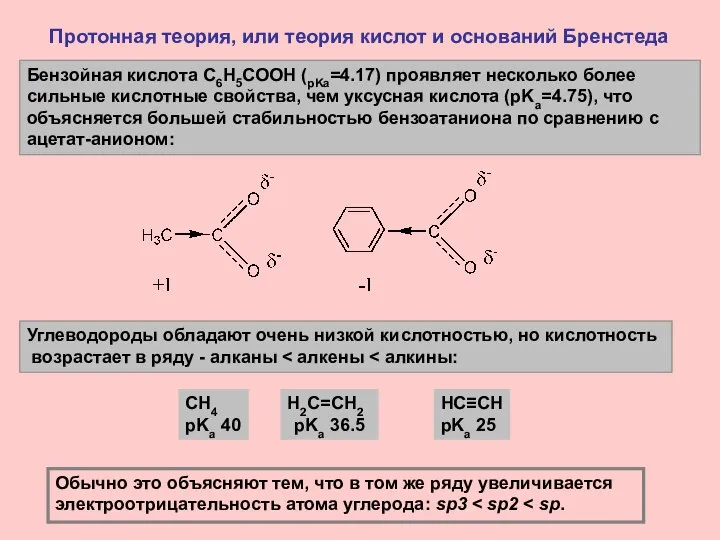
- 8. Протонная теория, или теория кислот и оснований Бренстеда Сила кислоты определяется устойчивостью (стабильностью) ее сопряженного основания
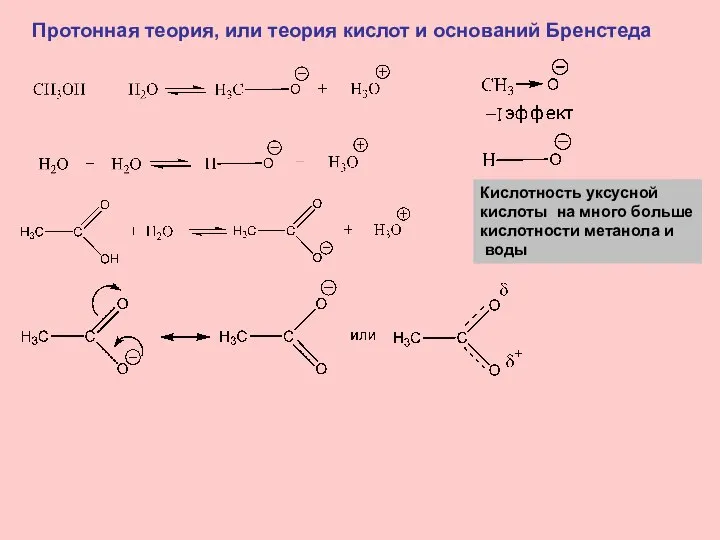
- 9. Протонная теория, или теория кислот и оснований Бренстеда Кислотность уксусной кислоты на много больше кислотности метанола
- 10. Протонная теория, или теория кислот и оснований Бренстеда Углеводороды обладают очень низкой кислотностью, но кислотность возрастает
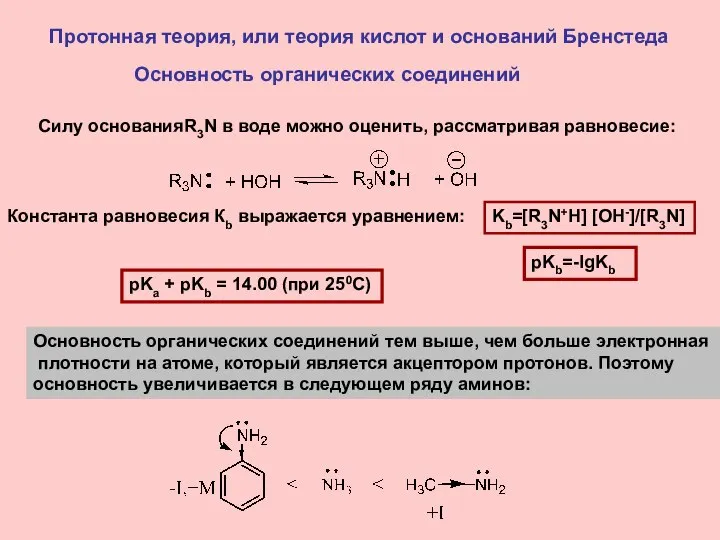
- 11. Протонная теория, или теория кислот и оснований Бренстеда Основность органических соединений Основность органических соединений тем выше,
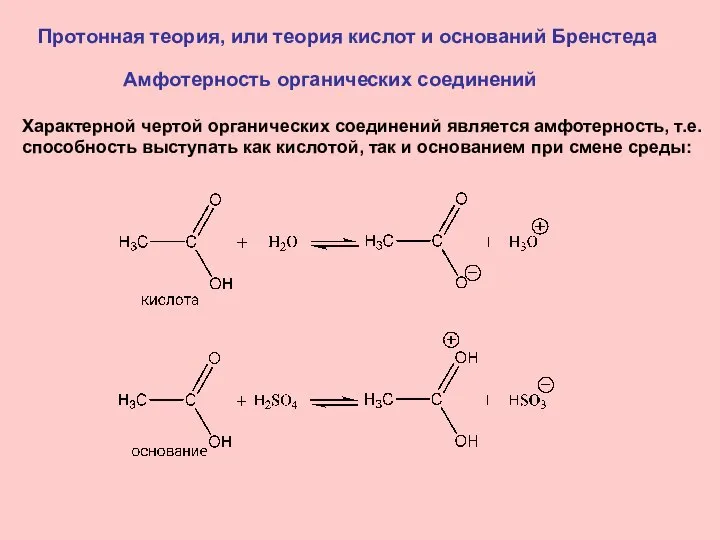
- 12. Протонная теория, или теория кислот и оснований Бренстеда Амфотерность органических соединений Характерной чертой органических соединений является
- 13. Электронная теория кислот и оснований, или Теория Льиса (1926) Джилберт Ньютон Льюис 23 октября 1875 г.
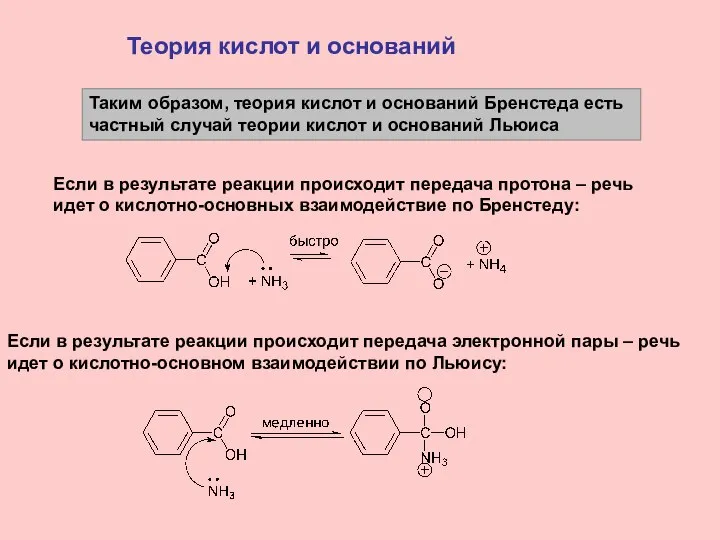
- 14. Теория кислот и оснований Таким образом, теория кислот и оснований Бренстеда есть частный случай теории кислот
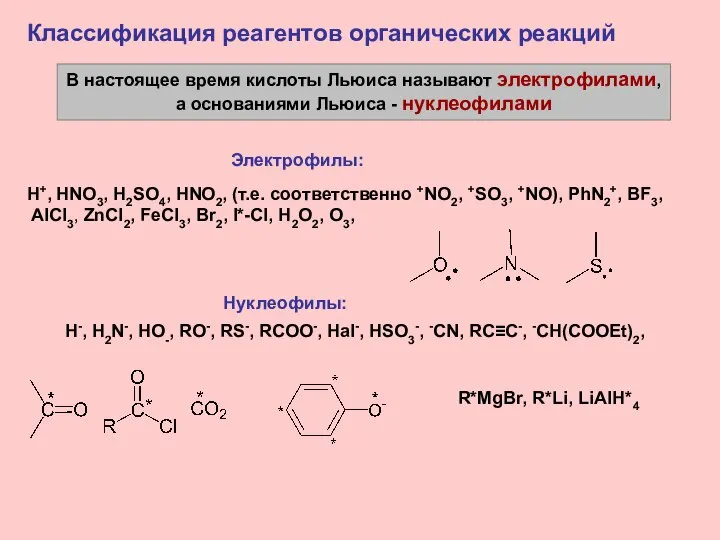
- 15. В настоящее время кислоты Льюиса называют электрофилами, а основаниями Льюиса - нуклеофилами Классификация реагентов органических реакций
- 16. Классификация органических реакций Все многообразие органических реакций можно разделить всего на пять классов по типу превращений
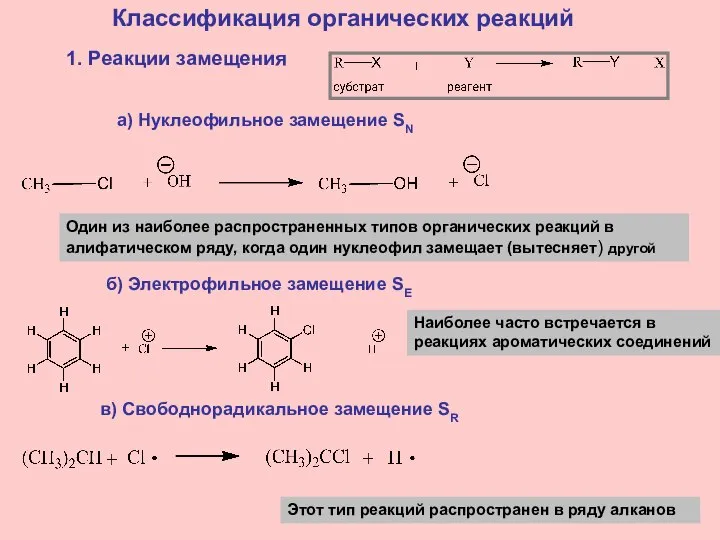
- 17. Классификация органических реакций 1. Реакции замещения а) Нуклеофильное замещение SN Один из наиболее распространенных типов органических
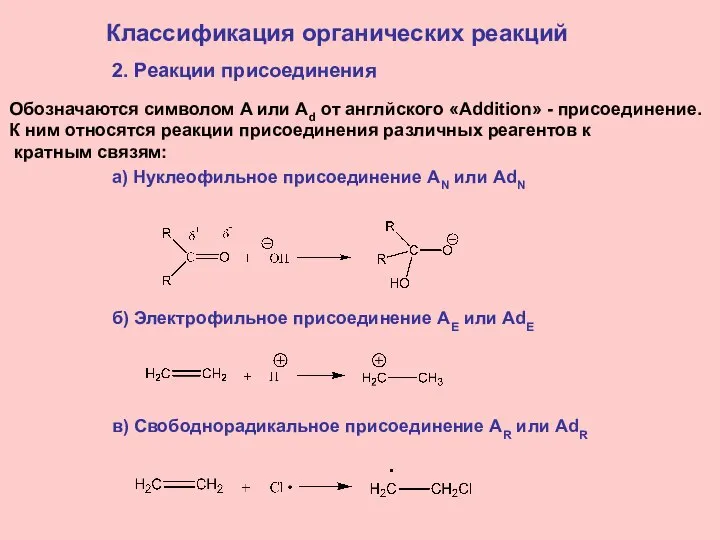
- 18. Классификация органических реакций 2. Реакции присоединения Обозначаются символом A или Ad от англйского «Addition» - присоединение.
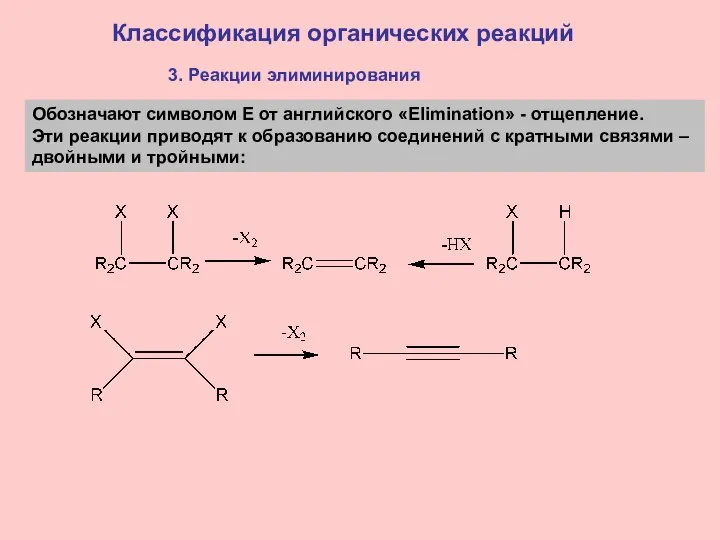
- 19. Классификация органических реакций 3. Реакции элиминирования Обозначают символом E от английского «Elimination» - отщепление. Эти реакции
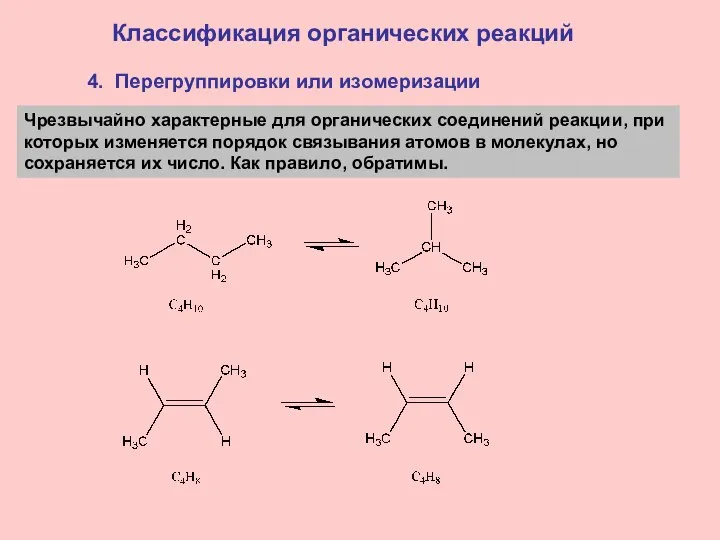
- 20. 4. Перегруппировки или изомеризации Классификация органических реакций Чрезвычайно характерные для органических соединений реакции, при которых изменяется
- 22. Скачать презентацию






 Сера в природе. Применение серы. Сероводород и сульфиды
Сера в природе. Применение серы. Сероводород и сульфиды Органическая химия. Непредельные углеводороды
Органическая химия. Непредельные углеводороды Хром. Основні характеристики
Хром. Основні характеристики В мире криссталлов
В мире криссталлов Органическая химия. Лекция - Гидроксикислоты
Органическая химия. Лекция - Гидроксикислоты Ионный обмен или сорбция
Ионный обмен или сорбция Вольфрам және молибден
Вольфрам және молибден Развивающие занятия в ГПД «Поделочные камни»
Развивающие занятия в ГПД «Поделочные камни» Исследование равновесия в системе газ-жидкость
Исследование равновесия в системе газ-жидкость Технологическое использование конденсированных ВВ. Компактирование порошков. Ударные волны в дисперсной среде. (Раздел 3.12)
Технологическое использование конденсированных ВВ. Компактирование порошков. Ударные волны в дисперсной среде. (Раздел 3.12) Непредельные углеводороды: алкены
Непредельные углеводороды: алкены Масс-спектрометрия в органической химии
Масс-спектрометрия в органической химии Солеобразующие оксиды
Солеобразующие оксиды Обобщение и систематизация знаний по теме Спирты и фенолы
Обобщение и систематизация знаний по теме Спирты и фенолы Лекарственные средства, производные конденсированных гетероциклических систем. (Тема 5)
Лекарственные средства, производные конденсированных гетероциклических систем. (Тема 5) Барометр – анероид. Атмосферное давление на различных высотах. Манометры
Барометр – анероид. Атмосферное давление на различных высотах. Манометры Химический элемент цинк
Химический элемент цинк Пищевые добавки
Пищевые добавки Производство аммиачной селитры под атмосферным давлением
Производство аммиачной селитры под атмосферным давлением История создания термометра: как придумали первый градусник?
История создания термометра: как придумали первый градусник? Муниципальное бюджетное общеобразовательное учреждение «Средняя общеобразовательная школа №9 с углубленным изучением отдельн
Муниципальное бюджетное общеобразовательное учреждение «Средняя общеобразовательная школа №9 с углубленным изучением отдельн Низкомолекулярные органические соединения витамины
Низкомолекулярные органические соединения витамины Cкорость химической реакции
Cкорость химической реакции Растворы. Способы выражения концентрации растворенного вещества
Растворы. Способы выражения концентрации растворенного вещества Кровь. Клеточный состав, функции, физико-химические константы и свойства. (Лекция 21)
Кровь. Клеточный состав, функции, физико-химические константы и свойства. (Лекция 21) Производные пиразола
Производные пиразола Химия углеводородов. Часть 2
Химия углеводородов. Часть 2 Применение химических реакций в быту
Применение химических реакций в быту