Презентация по химии Теоретические основы аналитической химии Химическое равновесие в гомогенной системе
Содержание
- 2. Скорость химической реакции и химическое равновесие Скоростью химической реакции называется изменение концентрации веществ в ходе реакции
- 3. Основные положения теории растворов электролитов. Процесс электролитической диссоциации изображают химическими уравнениями, например: Степень электролитической диссоциации По
- 4. Константа диссоциации слабого электролита Константа равновесия, отвечающая диссоциации слабого электролита, называется константой диссоциации
- 5. Закон разбавления Оствальда При разбавлении степень диссоциации увеличивается – активность данного иона – коэффициент активности иона
- 6. Кислотно-основные равновесия в водных растворах В соответствие с протолитической теорией Бренстеда и Лоури все частицы, способные
- 7. Кислотно-основные равновесия в водных растворах Согласно современным представлениям в воде осуществляется протолитическое равновесие – автопротолиз воды:
- 8. Кислотно-основные равновесия в водных растворах pH = 7, нейтральная среда pH pH > 7, щелочная среда
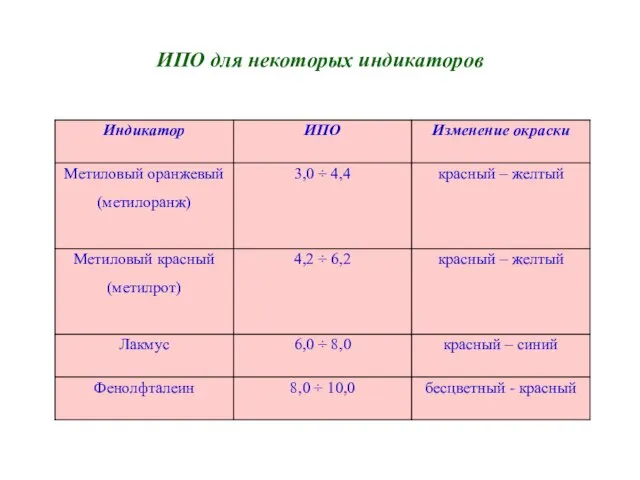
- 9. ИПО для некоторых индикаторов
- 10. Действие одноименнных ионов Степень диссоциации слабого электролита понижается при введении в раствор какого-либо сильного электролита, содержащего
- 11. Буферные растворы Количественной характеристикой способности буферного раствора поддерживать заданную величину pH является буферная емкость, под которой
- 12. Гидролиз солей Количественно гидролиз характеризуется степенью гидролиза h, которая равна отношению числа прогидролизровавшихся частиц nгидр к
- 13. Гидролиз солей При этом, чем слабее образующаяся в результате гидролиза кислота (меньше Ka), тем более сильным
- 14. Гидролиз солей 3. Гидролиз солей, содержащих катион слабого однокислотного основания и анион слабой одноосновной кислоты (ВА).
- 15. Гидролиз солей Так как Kа1 > Ka2, то Kh1 > Kh2 Na2S, K2CO3, Na2SO3, Na2C2O4 K3PO4,
- 16. Произведение растворимости Гетерогенная (неоднородная) система – это система, состоящая из нескольких гомогенных фаз, разделенных между собой
- 17. Произведение растворимости Правило произведения растворимости: произведение активностей ионов в степенях, равных стехиометрическим коэффициентам, в насыщенном растворе
- 18. Произведение растворимости Растворимость зависит 1. от природы малорастворимого соединения, 2. природы растворителя, 3. температуры, 4. давления,
- 20. Скачать презентацию
















 ОВР в органической химии
ОВР в органической химии 9 класс (обязательный минимум по химии) ПОЛИМЕРЫ Составитель презентации – учитель химии МОУ СОШ г. Холма Насонова Т.А.
9 класс (обязательный минимум по химии) ПОЛИМЕРЫ Составитель презентации – учитель химии МОУ СОШ г. Холма Насонова Т.А. Что изучает химия
Что изучает химия Подгруппа азота
Подгруппа азота Азот в природе
Азот в природе ТОМИЛОВА НАТАЛЬЯ ВЛАДИМИРОВНА УЧИТЕЛЬ ХИМИИ И ЕСТЕСТВОЗНАНИЯ МОУ СОШ № 47
ТОМИЛОВА НАТАЛЬЯ ВЛАДИМИРОВНА УЧИТЕЛЬ ХИМИИ И ЕСТЕСТВОЗНАНИЯ МОУ СОШ № 47 Алюминий. Нахождение алюминия в природе. Физические и химические свойства
Алюминий. Нахождение алюминия в природе. Физические и химические свойства Алюминий (лат. Aluminium)
Алюминий (лат. Aluminium) Процессы горения. Способы сжигания топлива. Горелочные устройства
Процессы горения. Способы сжигания топлива. Горелочные устройства Конструкционные материалы на основе легких металлов: сплавы алюминия
Конструкционные материалы на основе легких металлов: сплавы алюминия Презентация по химии Основные классы неорганических соединений
Презентация по химии Основные классы неорганических соединений  Аминокислоты и белки
Аминокислоты и белки Кислотность и основность органических соединений
Кислотность и основность органических соединений Значение минеральной воды для человека
Значение минеральной воды для человека Нерівноважна термодинаміка та хімічна кінетика. Лекція 1
Нерівноважна термодинаміка та хімічна кінетика. Лекція 1 Тема: физико-химический анализ хлеба. Цель: Физико - химический анализ разных разных сортов хлеба. Задачи: 1.Определить физико-хими
Тема: физико-химический анализ хлеба. Цель: Физико - химический анализ разных разных сортов хлеба. Задачи: 1.Определить физико-хими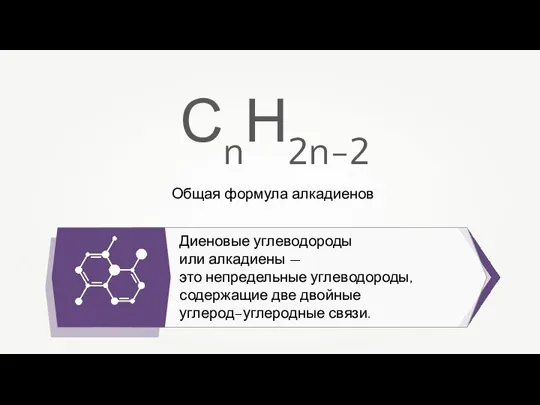 Общая формула алкадиенов
Общая формула алкадиенов Вещества и их системы. Смешивание растворов
Вещества и их системы. Смешивание растворов Флотационный способ обогащения
Флотационный способ обогащения Хімія в нашому житті Виконала: учениця 11 класу Онищенко Тетяна Вчитель:Біла В.М.
Хімія в нашому житті Виконала: учениця 11 класу Онищенко Тетяна Вчитель:Біла В.М.  Основные понятия термодинамики фазовых равновесий. Фазовые равновесия в однокомпонентных системах
Основные понятия термодинамики фазовых равновесий. Фазовые равновесия в однокомпонентных системах Химические волокна
Химические волокна Алкены. Непредельные углеводороды ряда этилена
Алкены. Непредельные углеводороды ряда этилена Глауконит
Глауконит Діагностика за показами газоаналізатора. Типи газоаналізаторів
Діагностика за показами газоаналізатора. Типи газоаналізаторів Алюміній
Алюміній  Кристаллические решетки
Кристаллические решетки Презентация по Химии "Феноли та нафтоли. Ароматичні аміни. Азо- та діазосполуки." - скачать смотреть бесплатно
Презентация по Химии "Феноли та нафтоли. Ароматичні аміни. Азо- та діазосполуки." - скачать смотреть бесплатно