Содержание
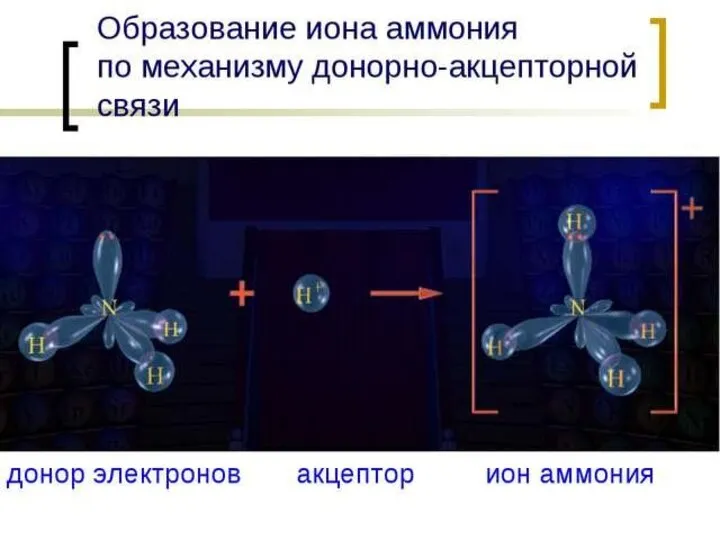
- 2. СОСТАВ солей аммония Соли аммония - это сложные вещества, в состав которых входят ионы аммония NH4+,
- 4. Физические свойства солей аммония Кристаллические вещества, хорошо растворимые в воде По строению, цвету и другим свойствам
- 5. Химические свойства солей аммония ОБЩИЕ С ДРУГИМИ СОЛЯМИ 1) Диссоциируют в водных растворах: NH4Cl ↔ NH4
- 6. Химические свойства солей аммония ОБЩИЕ С ДРУГИМИ СОЛЯМИ 3) Взаимодействуют с другими солями (реакция обмена): (NH4)2SO4
- 7. Химические свойства солей аммония СПЕЦИФИЧЕСКИЕ 1. При нагревании со щелочами выделяется аммиак (качественная реакция на ион
- 8. Химические свойства солей аммония СПЕЦИФИЧЕСКИЕ 2. Разлагаются при нагревании: a) если кислота летучая t NH4Cl →
- 9. Химические свойства солей аммония СПЕЦИФИЧЕСКИЕ 2. Разлагаются при нагревании: б) если анион проявляет окислительные свойства t
- 10. Получение солей аммония Получают взаимодействием NH3 или NH4OH с кислотами: NH3 + HNO3→NH4NO3 2NH4OH + H2SO4
- 11. Применение солей аммония Русский химик Д.Н Прянишников выяснил что растения предпочитают ионы аммония лучше нитратов Самое
- 12. Роль азотных соединений в жизни человека и общества велика, а применение разнообразно. Азот – основа жизни
- 13. Применение солей аммония Нитрат аммония NH4NО3 в смеси с порошками алюминия и угля используют в качестве
- 14. Применение солей аммония Гидрокарбонат аммония NH4HCO3 и карбонат аммония (NH4)2CO3 применяют в кондитерском деле, так как
- 15. Применение солей аммония Хлорид аммония NH4Cl используют при паянии и лужении металлов, так как он очищает
- 16. Применение солей аммония Хлорид аммония применяется при изготовлении дымовых шашек.
- 17. Соли аммония Полезные, важные, Превращают пустыни в оазисы, Реагируют, как все соли, с солями, кислотами и
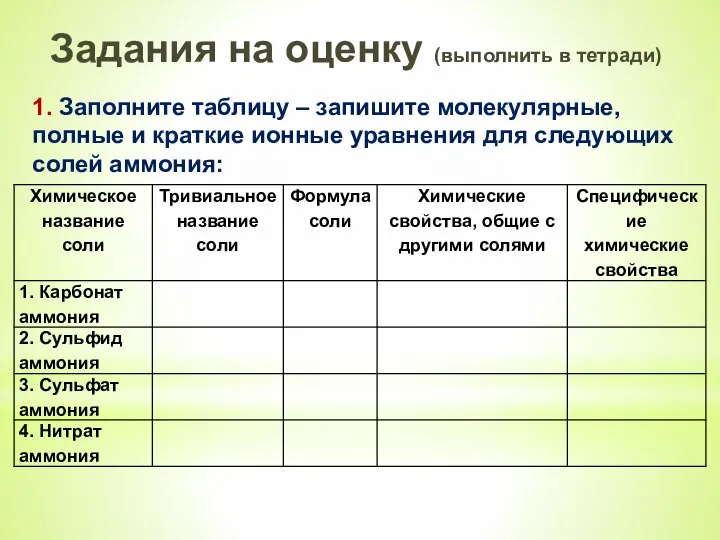
- 18. Задания на оценку (выполнить в тетради) 1. Заполните таблицу – запишите молекулярные, полные и краткие ионные
- 19. 2. Определите вещество (назовите его, приведя все возможные названия; напишите формулу). Напишите уравнения реакций в молекулярном
- 21. Скачать презентацию
















 Пирогова Т.В.учитель химии МОУ «Куженерская средняя общеобразовательная школа № 2»
Пирогова Т.В.учитель химии МОУ «Куженерская средняя общеобразовательная школа № 2»  Метаболизм липидов. Характеристика липидов. Значение. Представители. Эйкозаноиды. (Лекция 1-2)
Метаболизм липидов. Характеристика липидов. Значение. Представители. Эйкозаноиды. (Лекция 1-2) Химиядан сұрақтар
Химиядан сұрақтар Характерные дефекты в монокристаллах кремния и их влияние на свойства. Методы диагностики
Характерные дефекты в монокристаллах кремния и их влияние на свойства. Методы диагностики Электронная формула атома магния
Электронная формула атома магния Роль хімії в природі
Роль хімії в природі Инновационная технология скоростного экологически чистого гидролиза
Инновационная технология скоростного экологически чистого гидролиза Аміак
Аміак  Что объединяет вещества. Классификация твёрдых веществ
Что объединяет вещества. Классификация твёрдых веществ Вторичная переработка нефти. Лекция 9
Вторичная переработка нефти. Лекция 9 Спирты и их влияние на здоровье человека
Спирты и их влияние на здоровье человека Кремний и его соединения. Силикатная промышленность
Кремний и его соединения. Силикатная промышленность Скорость химических реакций. Химическое равновесие
Скорость химических реакций. Химическое равновесие Органическая химия. Основные положения. История развития науки Королёва Инна Николаевна Учитель химии МАОУ СОШ №10 Ст. Новомыша
Органическая химия. Основные положения. История развития науки Королёва Инна Николаевна Учитель химии МАОУ СОШ №10 Ст. Новомыша Аттестационная работа. Исследовательская деятельность на уроках химии (8 -9 классы). Исследование речки Беленькой
Аттестационная работа. Исследовательская деятельность на уроках химии (8 -9 классы). Исследование речки Беленькой Эксперимент. Выращивание солевых кристаллов
Эксперимент. Выращивание солевых кристаллов Выращивание снежинки
Выращивание снежинки Токсикологически важные вещества, подвергающиеся обязательному судебно-химическому исследованию
Токсикологически важные вещества, подвергающиеся обязательному судебно-химическому исследованию ЛЕКЦИЯ 1. Основы токсикологической химии
ЛЕКЦИЯ 1. Основы токсикологической химии  Оксиды в минералогии
Оксиды в минералогии Алкадиены. Строение алкадиенов
Алкадиены. Строение алкадиенов Производные хромана. Фенилхромановые соединения, флавоноиды. (Лекция 3)
Производные хромана. Фенилхромановые соединения, флавоноиды. (Лекция 3) Уральские самоцветы
Уральские самоцветы Пищевая сода
Пищевая сода Корозія металів. Засоби захисту від корозії
Корозія металів. Засоби захисту від корозії  Теория и практика решения задач высокого уровня сложности в процессе обучения химии
Теория и практика решения задач высокого уровня сложности в процессе обучения химии Презентация Химия и русский язык
Презентация Химия и русский язык Предельные одноатомные спирты
Предельные одноатомные спирты