Содержание
- 2. Титриметрические (объемные) методы количественного анализа основаны на точном измерении объема раствора реагента (титранта), вступающего в химическую
- 3. Титриметрия- наиболее широко применяется при определении высоких и средних концентраций веществ в растворах (до 1·10-4 моль/л
- 4. КЛАССИФИКАЦИЯ ТИТРИМЕТРИЧЕСКИХ МЕТОДОВ АНАЛИЗА ПО ТИПАМ ХИМИЧЕСКИХ РЕАКЦИЙ 1. Методы кислотно-основного титрования Основаны на использовании реакции
- 5. 2. Методы осадительного титрования Исследуемое вещество при взаимодействии с титрантом образует малорастворимые соединения. Широко применяемый метод
- 6. 3. Методы комплексометрического титрования Основаны на образовании слабоионизированных комплексов титранта с исследуемым веществом. Комплексонометрическое титрование –
- 7. 4. Методы окислительно-восстановительного титрования Основаны на окислительно-восстановительных реакциях, происходящих между определяемым веществом и титрантом. Перманганатометрия. Перманганат
- 8. Броматометрия – титриметрический метод определения восстановителей, а также органических соединений, вступающих с бромом в реакции присоединения
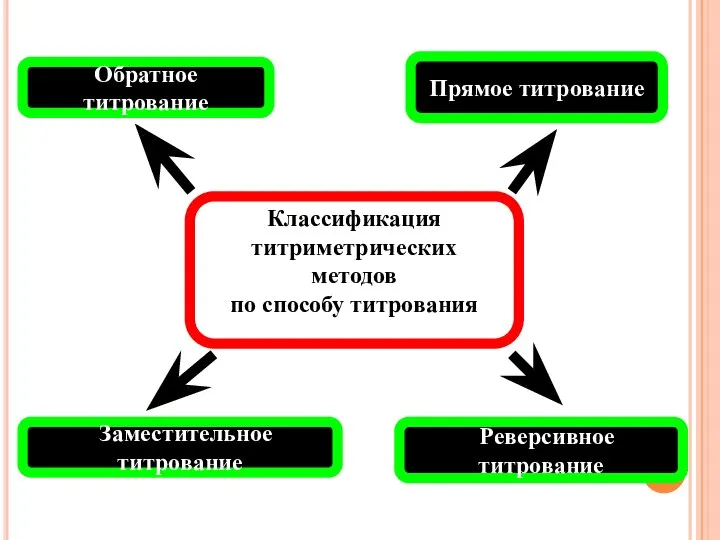
- 9. Прямое титрование Обратное титрование Заместительное титрование Реверсивное титрование Классификация титриметрических методов по способу титрования
- 10. Прямое титрование реакция взаимодействия исследуемого вещества (А) с реагентом в условиях проведения анализа должна быть специфичной;
- 11. Обратное титрование скорость прямой реакции невысокая; отсутствует соответствующий индикатор; возможна потеря определяемого вещества из-за его летучести.
- 12. Например, концентрацию раствора NH3 определяют обратным титрованием по причине его летучести. К раствору аммиака прибавляют избыток
- 13. Заместительное титрование определяемое вещество с данным титрантом не взаимодействует; взаимодействие определяемого вещества и титранта приводит к
- 14. Например, калия дихромат взаимодействует с титрантом Na2S2O3 нестехиометрично. Поэтому к раствору исследуемого вещества K2Cr2O7 прибавляют реагент
- 15. Реверсивное титрование При реверсивном титровании раствором определяемого вещества титруют стандартный раствор реагента:
- 16. ПРИГОТОВЛЕНИЕ ТИТРОВАННЫХ РАСТВОРОВ 1. по точной навеске исходного вещества (первичный стандартный раствор);
- 17. ПЕРВИЧНЫЕ СТАНДАРТНЫЕ РАСТВОРЫ ГОТОВЯТ ТОЛЬКО ИЗ СТАНДАРТНЫХ ВЕЩЕСТВ, КОТОРЫЕ ДОЛЖНЫ ОТВЕЧАТЬ СЛЕДУЮЩИМ ТРЕБОВАНИЯМ: вещество должно легко
- 18. 2. с помощью "фиксанала" (первичный стандартный раствор) Фиксаналы (стандарт-титры, первичные стандарты) – вещества в строго определенном
- 19. 3. готовят раствор с приблизительной концентрацией, близкой к требуемой, определяют точную концентрацию с помощью стандартного вещества
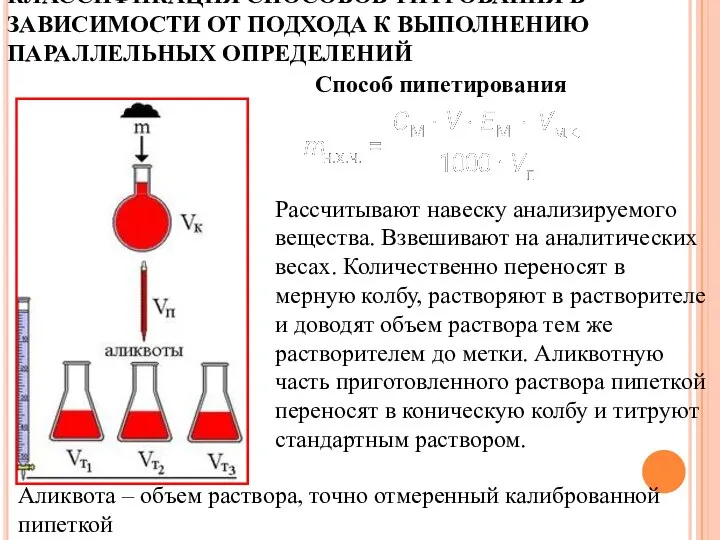
- 20. КЛАССИФИКАЦИЯ СПОСОБОВ ТИТРОВАНИЯ В ЗАВИСИМОСТИ ОТ ПОДХОДА К ВЫПОЛНЕНИЮ ПАРАЛЛЕЛЬНЫХ ОПРЕДЕЛЕНИЙ Способ отдельных навесок Рассчитывают навеску
- 21. КЛАССИФИКАЦИЯ СПОСОБОВ ТИТРОВАНИЯ В ЗАВИСИМОСТИ ОТ ПОДХОДА К ВЫПОЛНЕНИЮ ПАРАЛЛЕЛЬНЫХ ОПРЕДЕЛЕНИЙ Рассчитывают навеску анализируемого вещества. Взвешивают
- 22. различной емкости с делениями и без делений узкогорлые и широкогорлые со шлифом и без шлифа Конические
- 23. Бюретка представляет собой градуированную стеклянную трубку с запирающим устройством на нижнем конце – краном, зажимом Мора
- 24. ТЕХНИКА ТИТРОВАНИЯ 1. Перед использованием бюретка должна быть тщательно вымыта дистиллированной водой. 2. Бюретку трижды ополаскивают
- 25. 4. Конец бюретки должен быть опущен на 1-2 см в колбу для титрования. 5. Титрование проводят
- 26. Пипетки служат для точного отмеривания определенного объема жидкости Пипетки: простые (пипетки Мора) градуированные Для наполнения пипеток
- 28. ОПРЕДЕЛЕНИЕ КОНЕЧНОЙ ТОЧКИ ТИТРОВАНИЯ - ТОЧКИ НА КРИВОЙ ТИТРОВАНИЯ, В КОТОРОЙ РЕГИСТРИРУЕТСЯ РЕЗКОЕ ИЗМЕНЕНИЕ НАБЛЮДАЕМОГО СВОЙСТВА
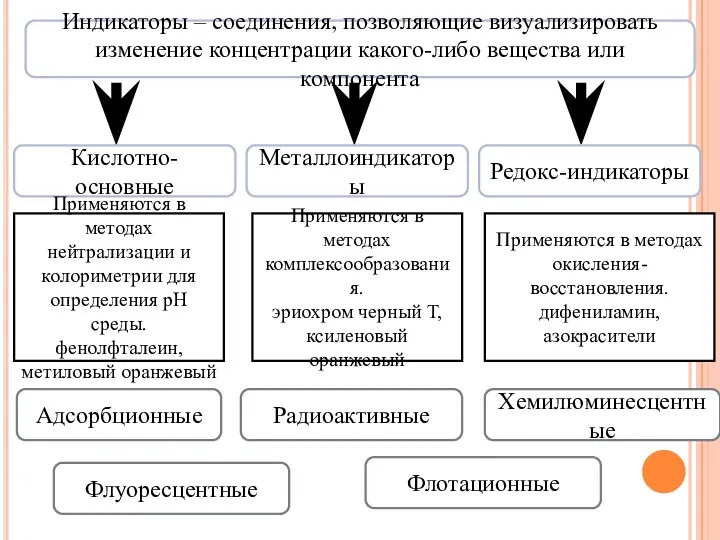
- 29. Индикаторы – соединения, позволяющие визуализировать изменение концентрации какого-либо вещества или компонента Кислотно-основные Металлоиндикаторы Редокс-индикаторы Применяются в
- 30. ТИТРАТОРЫ Титраторы – приборы предназначенные для частично или полностью автоматизированного проведения измерений. Программное обеспечение, прилагаемое к
- 32. Скачать презентацию


























 Особенности технологий обработки жидкостей и газов
Особенности технологий обработки жидкостей и газов Сплави металів
Сплави металів Өтмө металлдар
Өтмө металлдар Оценка опасности взрыва горючих газов
Оценка опасности взрыва горючих газов Uses of chlorine and its compounds
Uses of chlorine and its compounds Origin of petroleum dilemma
Origin of petroleum dilemma Аттестационная работа. Проектно-исследовательская деятельность учащихся на уроках химии и во внеурочной работе
Аттестационная работа. Проектно-исследовательская деятельность учащихся на уроках химии и во внеурочной работе Строение атома
Строение атома Липиды
Липиды Презентация Химические свойства кислот в свете теории электролитической диссоциации 9 Класс
Презентация Химические свойства кислот в свете теории электролитической диссоциации 9 Класс Жидкостная хроматография
Жидкостная хроматография Химиялык кару
Химиялык кару Разбор заданий #ОВРновый, #реакционно и #соточка
Разбор заданий #ОВРновый, #реакционно и #соточка Алюминий. История получения. Свойства алюминия. Корунд, бокситы
Алюминий. История получения. Свойства алюминия. Корунд, бокситы Химическая лаборатория
Химическая лаборатория Неорганическая химия. Соединение химических элементов
Неорганическая химия. Соединение химических элементов Исследование растворимости в системе уксусная кислота-этиловый спирт-этилацетат-вода методом изотермического титрования при 60˚C
Исследование растворимости в системе уксусная кислота-этиловый спирт-этилацетат-вода методом изотермического титрования при 60˚C Классификация терпенов
Классификация терпенов Презентация по Химии "Метали" - скачать смотреть бесплатно
Презентация по Химии "Метали" - скачать смотреть бесплатно Теория гибридизации. (Лекция 3)
Теория гибридизации. (Лекция 3) Оружие массового поражения. Биологическое оружие
Оружие массового поражения. Биологическое оружие  Organic Compounds
Organic Compounds Углеводороды и их природные источники. Гомологический ряд алканов. Строение алканов
Углеводороды и их природные источники. Гомологический ряд алканов. Строение алканов Трансформация соединений азота
Трансформация соединений азота Карбоновые кислоты
Карбоновые кислоты Спирты. Физические свойства
Спирты. Физические свойства Коррозия железа в различных средах Проект по химии: Авторы: ученица 10б класса
Коррозия железа в различных средах Проект по химии: Авторы: ученица 10б класса  Сульфатна кислота і сульфати
Сульфатна кислота і сульфати