Содержание
- 2. Лекция 7 Фугитивность. Химический потенциал идеального и реального газов. Условие химического равновесия. Стандартная энергия Гиббса химической
- 3. Что такое уравнения Максвелла (УМ)? Какие утверждения – правильные? УМ - это равенство вторых производныx функций
- 4. Какие формулы здесь – правильные? 1) Уравнение Гиббса-Дюгема: 3) Условие «самопроизвольности протекания процесса» 2) Условие «самопроизвольности
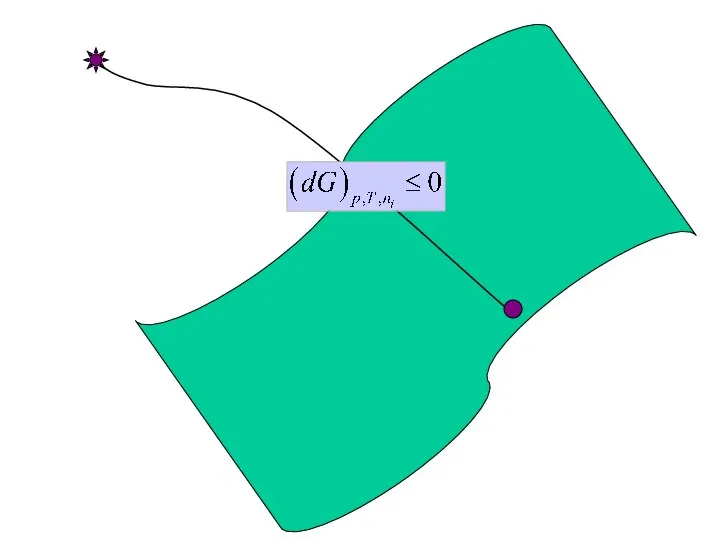
- 5. «Неравенство Клаузиуса».
- 6. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
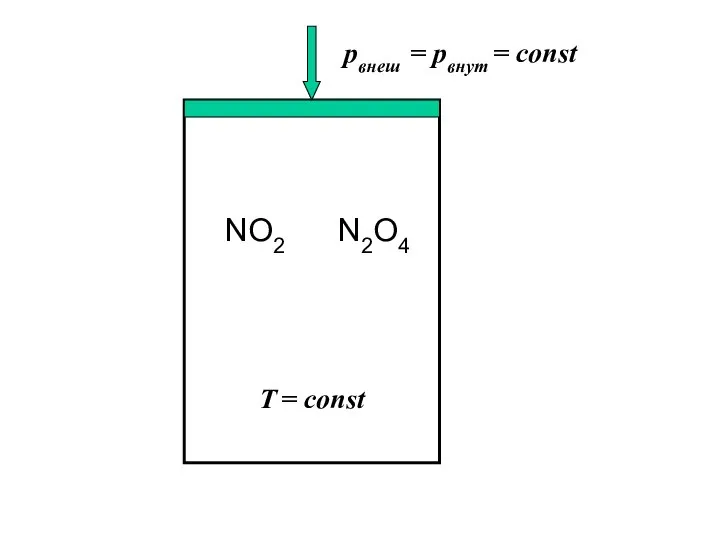
- 7. NO2 N2O4 рвнеш = рвнут = const T = const
- 9. Условия химического равновесия
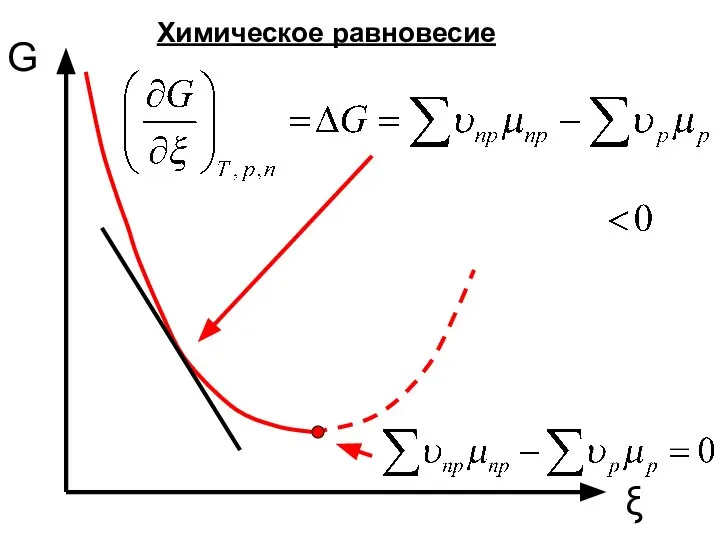
- 10. G ξ Химическое равновесие
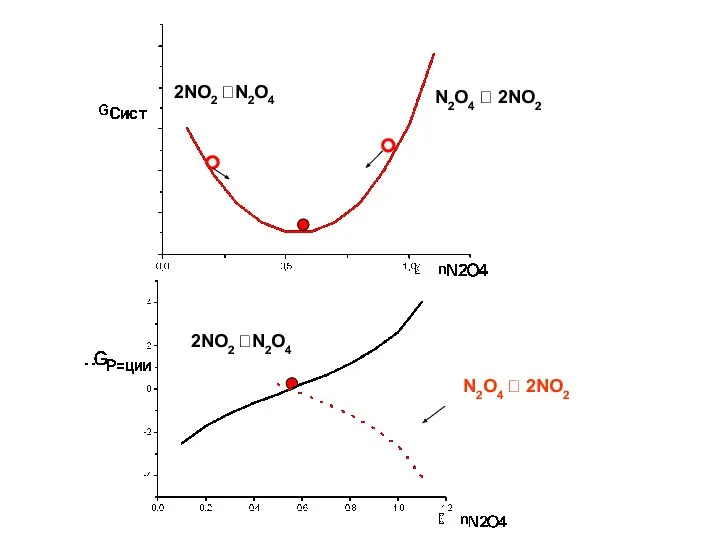
- 11. 2NO2 ?N2O4 N2O4 ? 2NO2 2NO2 ?N2O4 N2O4 ? 2NO2
- 12. Химический потенциал идеального газа
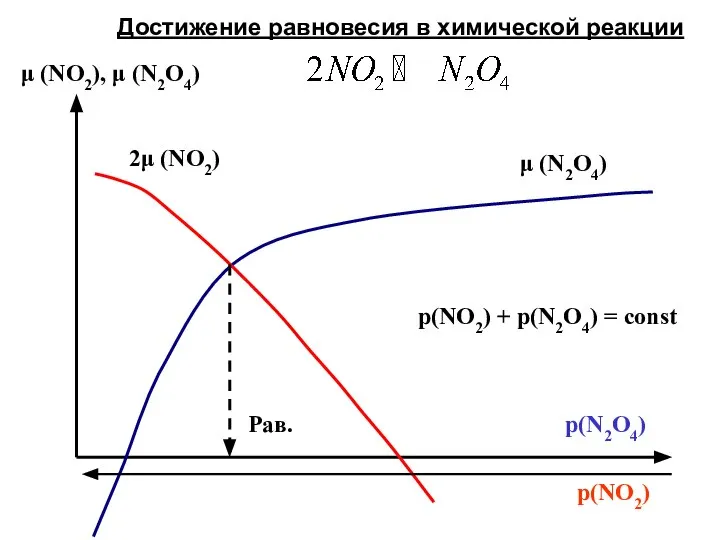
- 13. p(NO2) μ (NO2), μ (N2O4) Рав. μ (N2O4) 2μ (NO2) p(NO2) + p(N2O4) = const Достижение
- 14. Изотерма химической реакции
- 15. Химический потенциал идеального и реального газа
- 16. Изотерма химической реакции
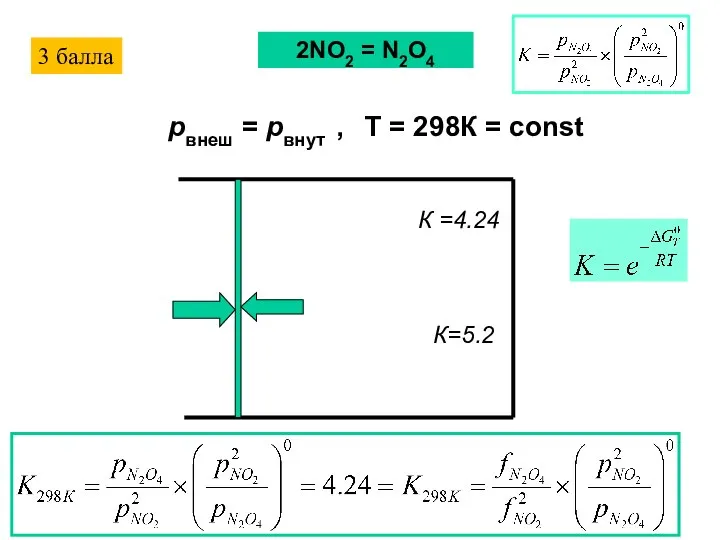
- 17. К =4.24 pвнеш = pвнут , T = 298К = const 2NO2 = N2O4 К=5.2 3
- 18. Уравнение Гиббса-Гельмгольца
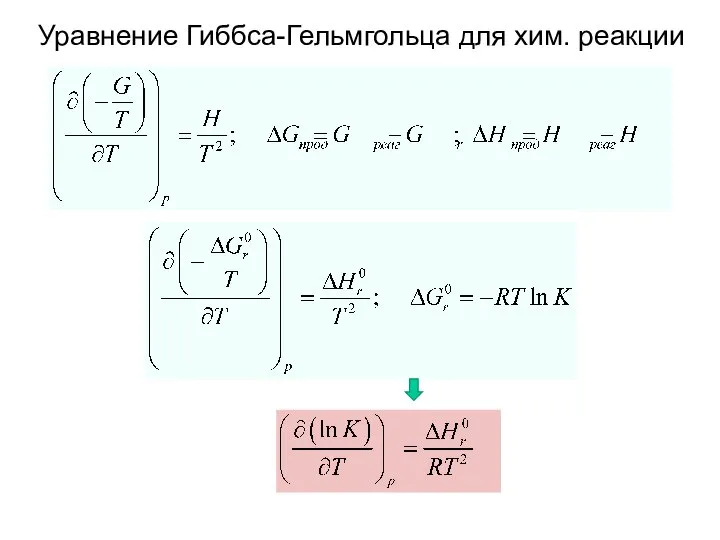
- 19. Уравнение Гиббса-Гельмгольца для хим. реакции
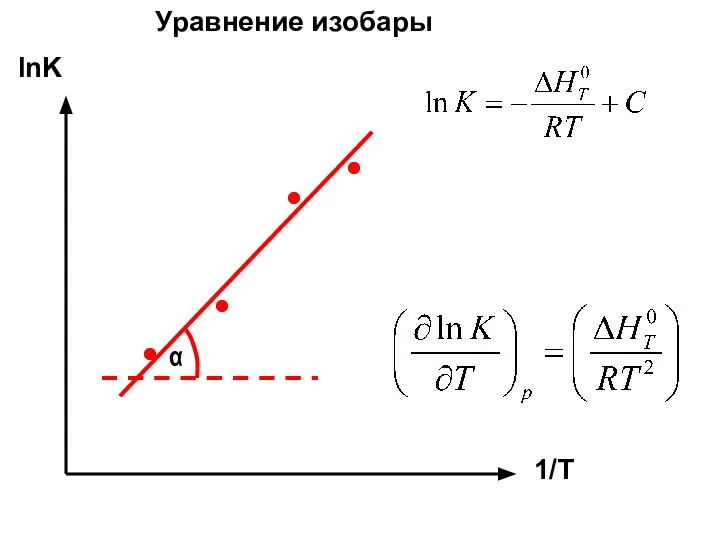
- 20. lnK 1/T α Уравнение изобары
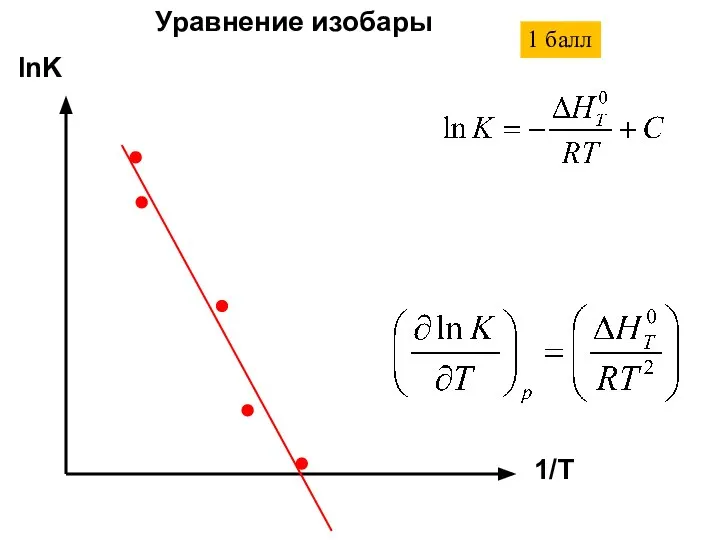
- 21. lnK 1/T Уравнение изобары 1 балл
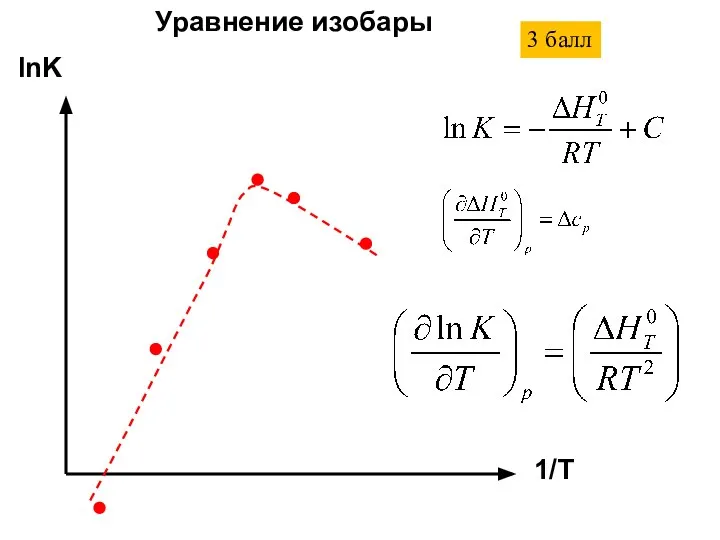
- 22. lnK 1/T Уравнение изобары 3 балл
- 23. Химическая реакция. Отметьте правильные утверждения Энергия Гиббса самопроизвольной химической реакции должна убывать. 2) При самопроизвольной реакции
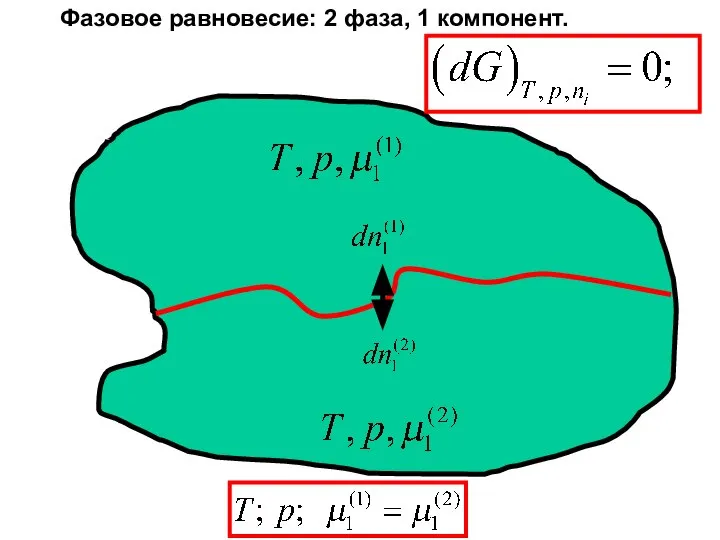
- 24. Фазовое равновесие
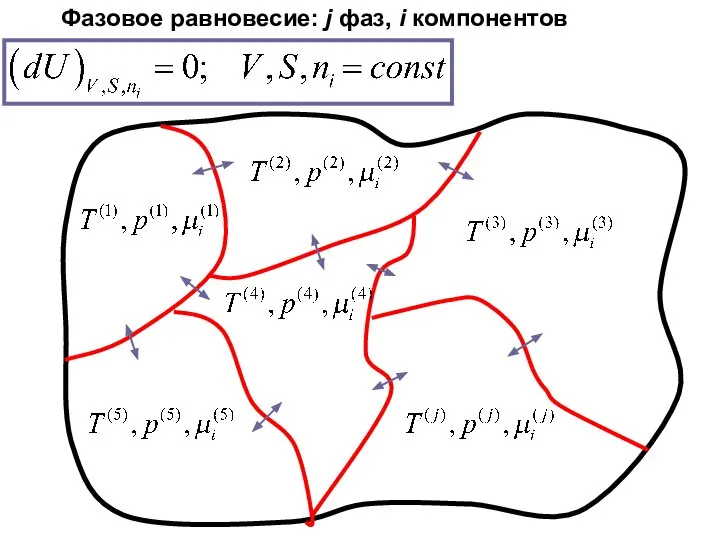
- 25. Фазовое равновесие: j фаз, i компонентов
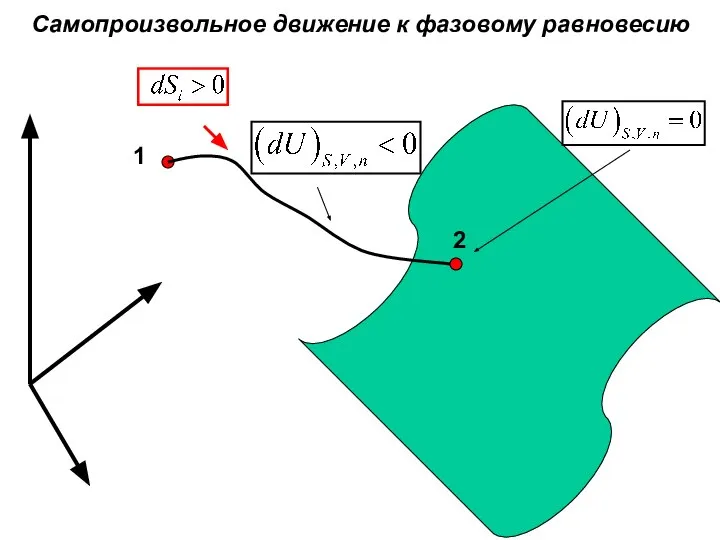
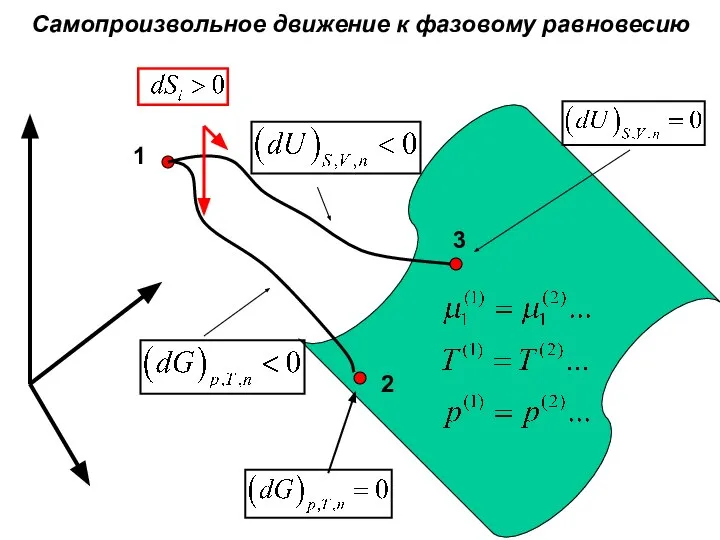
- 26. Самопроизвольное движение к фазовому равновесию 1 2
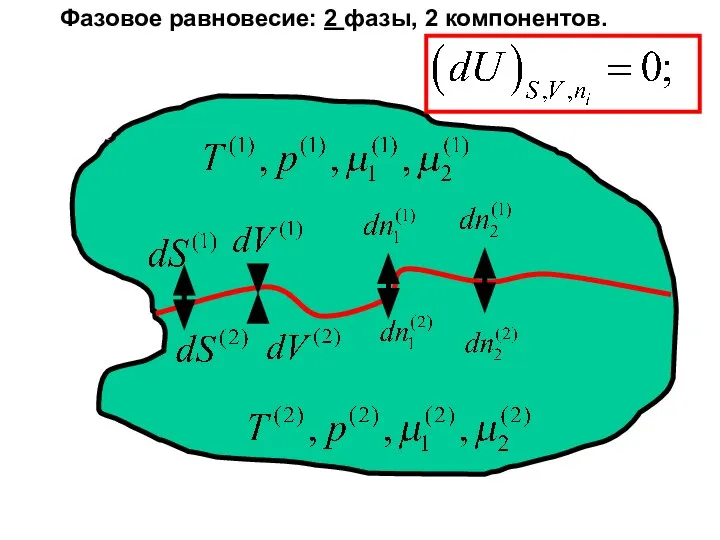
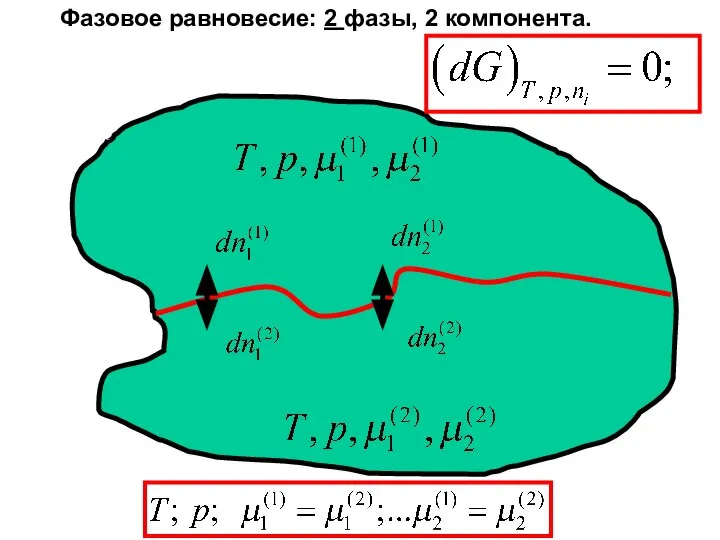
- 27. Фазовое равновесие: 2 фазы, 2 компонентов.
- 28. Фазовое равновесие. Билет 31, 2 сем., 1 курс
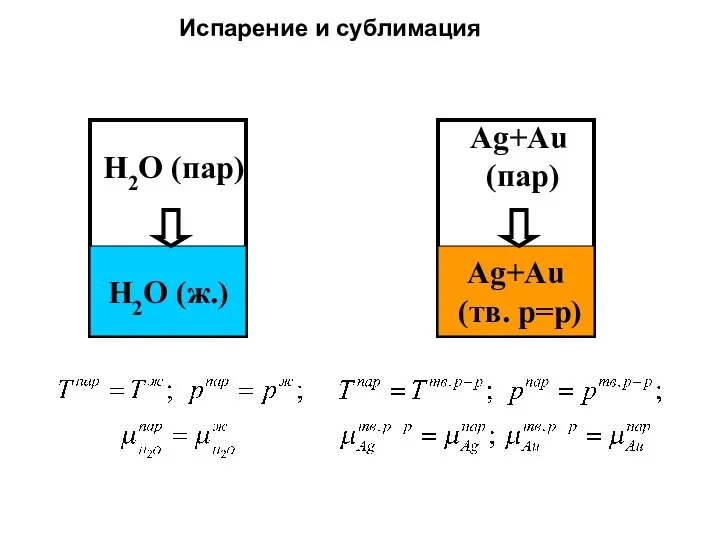
- 29. H2O (ж.) H2O (пар) Ag+Au (тв. р=р) Ag+Au (пар) Испарение и сублимация
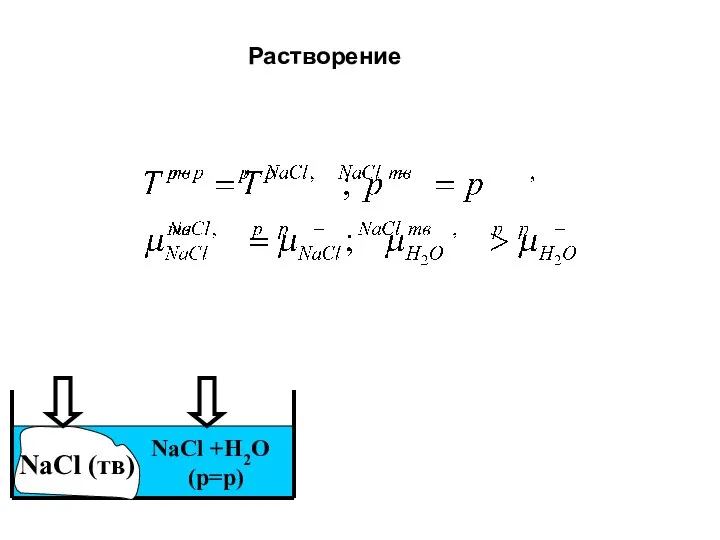
- 30. NaCl +H2O (р=р) NaCl (тв) Растворение
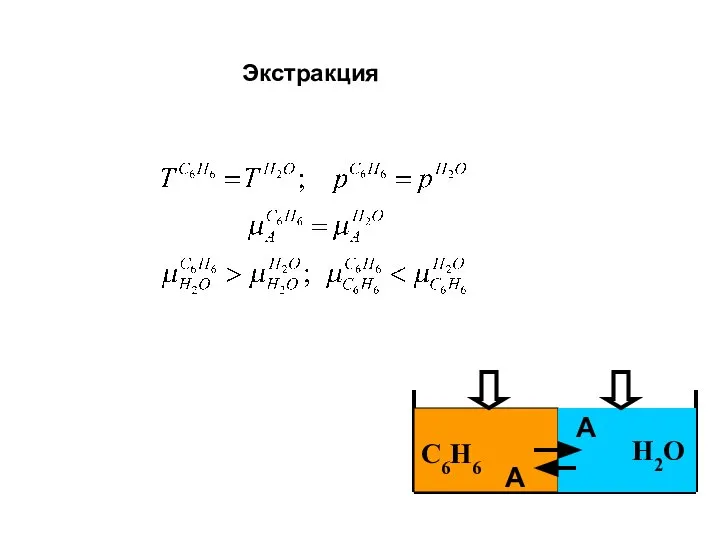
- 31. С6Н6 Н2О А А Экстракция
- 32. Фазовое равновесие: 2 фазы, 2 компонентa.
- 33. Самопроизвольное движение к фазовому равновесию 1 2 3
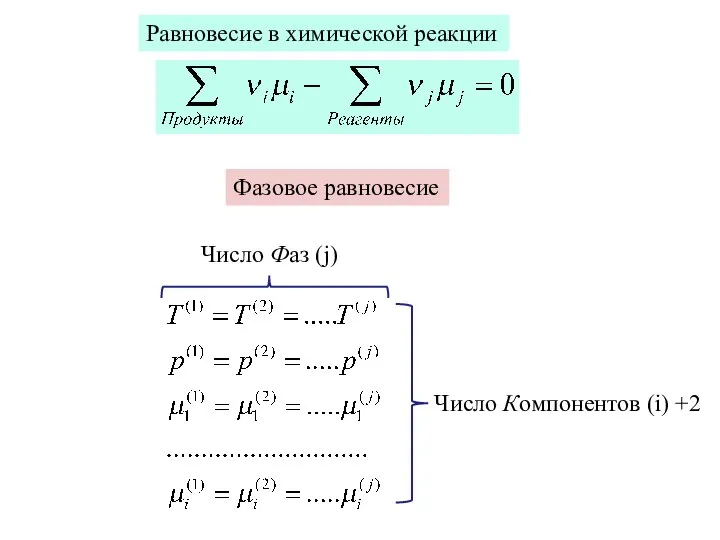
- 34. Равновесие в химической реакции Фазовое равновесие Число Компонентов (i) +2 Число Фаз (j)
- 35. Правило фаз Число Компонентов (i) +2 Число Фаз (j) Число переменных: Ф x (K+2) Число уравнений:(Ф-1)
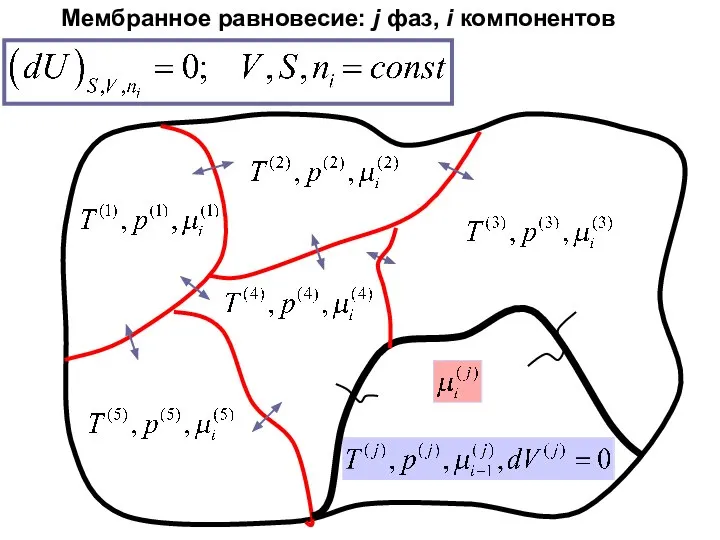
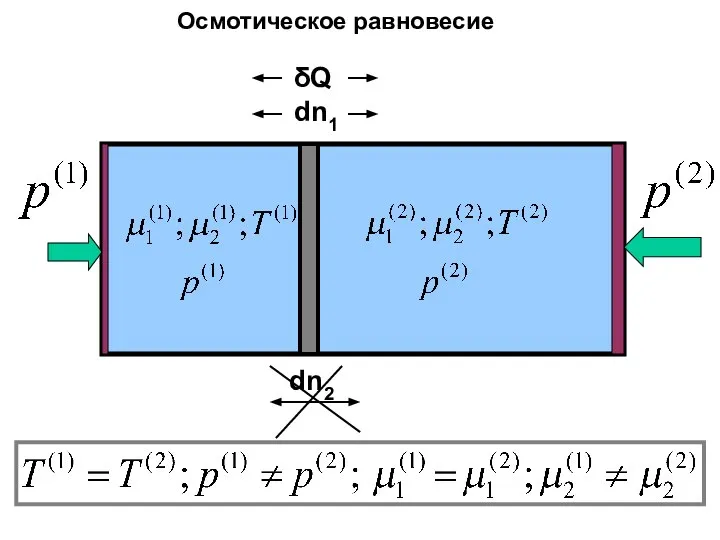
- 36. Мембранное равновесие
- 37. Мембранное равновесие: j фаз, i компонентов
- 38. Мембранное равновесие: j фаз, i компонентов
- 39. dn2 δQ dn1 Осмотическое равновесие
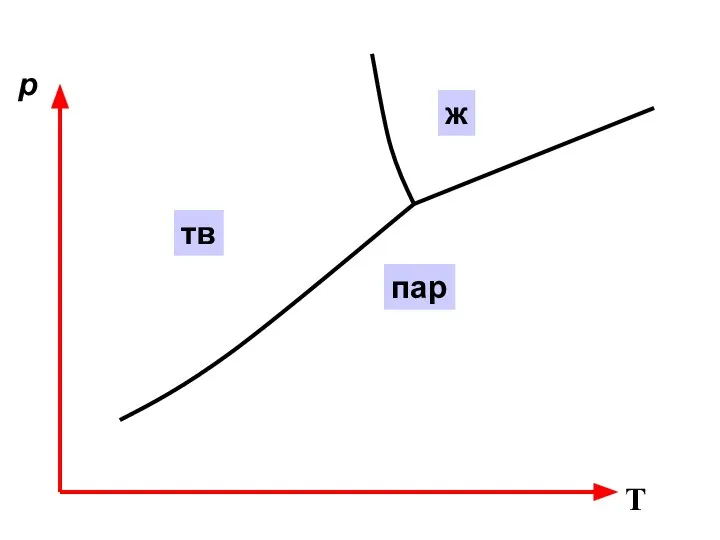
- 40. Фазовое равновесие в однокомпонентной системе
- 41. Фазовое равновесие: 2 фаза, 1 компонент.
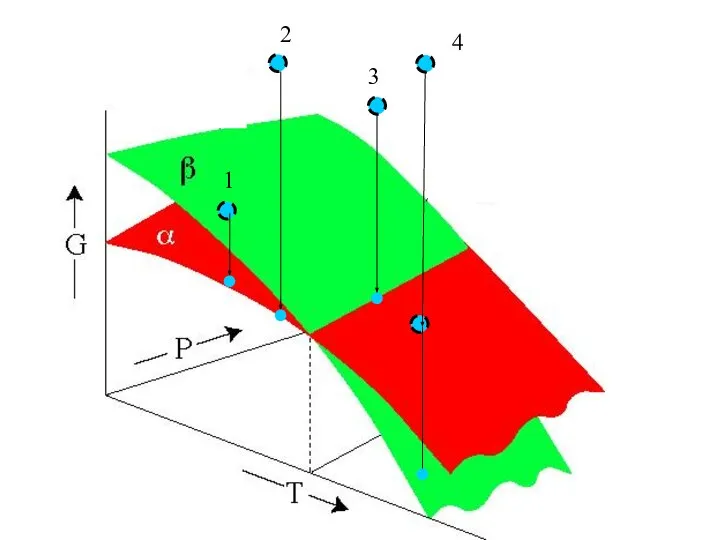
- 42. Энергия Гиббса системы. Один компонент, две фазы. 2 1 3 4
- 43. p T α β тв ж пар
- 45. Скачать презентацию


















 Вещества преимущественно удушающего действия (пульмонотоксиканты)
Вещества преимущественно удушающего действия (пульмонотоксиканты) Химические источники тока
Химические источники тока Классификация химических элементов в географической оболочке
Классификация химических элементов в географической оболочке Презентация по Химии "Дефицит пресной воды. Миф или реальность?" - скачать смотреть
Презентация по Химии "Дефицит пресной воды. Миф или реальность?" - скачать смотреть  Свойства жидких металлов
Свойства жидких металлов Орагническая химия. Теория А.М. Бутлерова
Орагническая химия. Теория А.М. Бутлерова Полимерные материалы и изделия
Полимерные материалы и изделия The chemistri of life and the micro universe
The chemistri of life and the micro universe Реактор получения элементарной серы
Реактор получения элементарной серы Исследование Е. Е. Вагнера в области терпенов и камфоры
Исследование Е. Е. Вагнера в области терпенов и камфоры Термодинамика химических процессов
Термодинамика химических процессов Устойчивость и коагуляция коллоидных растворов
Устойчивость и коагуляция коллоидных растворов Основные понятия и законы химии
Основные понятия и законы химии Углеводы. Глюкоза
Углеводы. Глюкоза Реакции окисления-восстановления в химическом анализе. (Лекция 8.2)
Реакции окисления-восстановления в химическом анализе. (Лекция 8.2)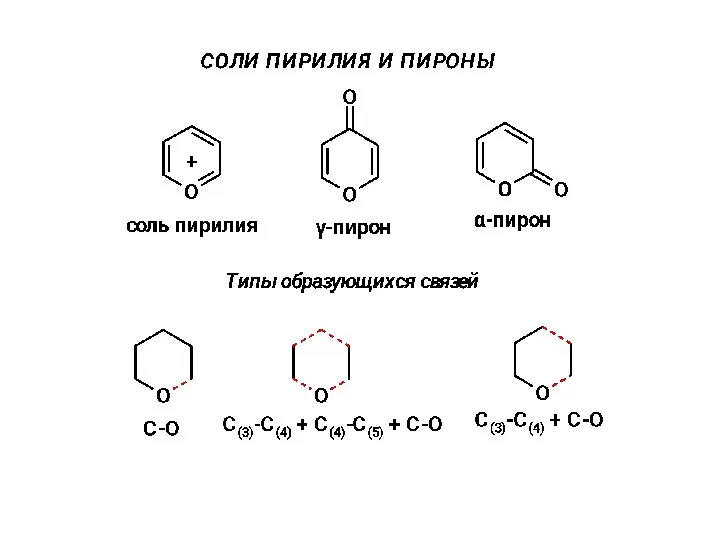 Соли пирилия и пироны
Соли пирилия и пироны “Кількість речовини. Молярна маса. Молярний об’єм” Урок хімії у 8 класі КЗ Верхівцевського НВК Учитель Кукса Наталія Миколаївна.
“Кількість речовини. Молярна маса. Молярний об’єм” Урок хімії у 8 класі КЗ Верхівцевського НВК Учитель Кукса Наталія Миколаївна.  Смещение химического равновесия. Принцип Ле Шателье-Брауна
Смещение химического равновесия. Принцип Ле Шателье-Брауна Химия высокомолекулярных соединений
Химия высокомолекулярных соединений Введение. Основные понятия химии
Введение. Основные понятия химии Ароматические углеводороды (арены). Гомологи бензола
Ароматические углеводороды (арены). Гомологи бензола Алкины. Ацетилен – представитель алкинов.
Алкины. Ацетилен – представитель алкинов. Попутные нефтяные газы
Попутные нефтяные газы Оксиди нітрогену
Оксиди нітрогену Основные характеристики ковалентной связи
Основные характеристики ковалентной связи Массообменные процессы
Массообменные процессы Алюминий. История получения. Свойства алюминия. Корунд, бокситы
Алюминий. История получения. Свойства алюминия. Корунд, бокситы Вибух газо- та пароповітряних сумішей на відкритому просторі та в приміщенні
Вибух газо- та пароповітряних сумішей на відкритому просторі та в приміщенні