Содержание
- 2. Дисперсные системы Крайне редко в природе встречаются вещества в идеально чистом виде и состоянии. Обычно это
- 3. Дисперсные системы
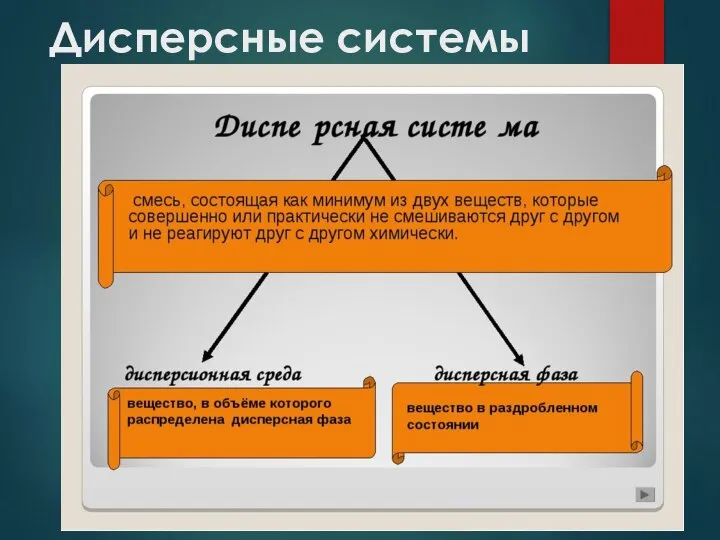
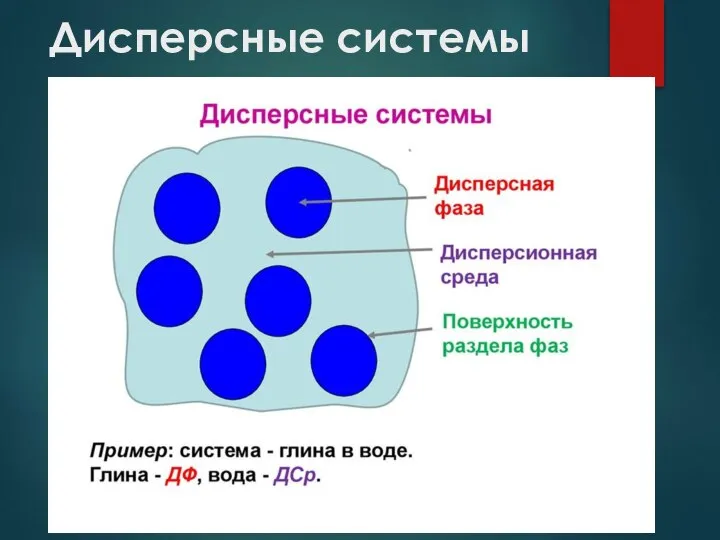
- 4. Дисперсные системы Дисперсные системы представляют собой гетерогенные структуры, внутри которых одно или более веществ распределяются в
- 5. Дисперсные системы
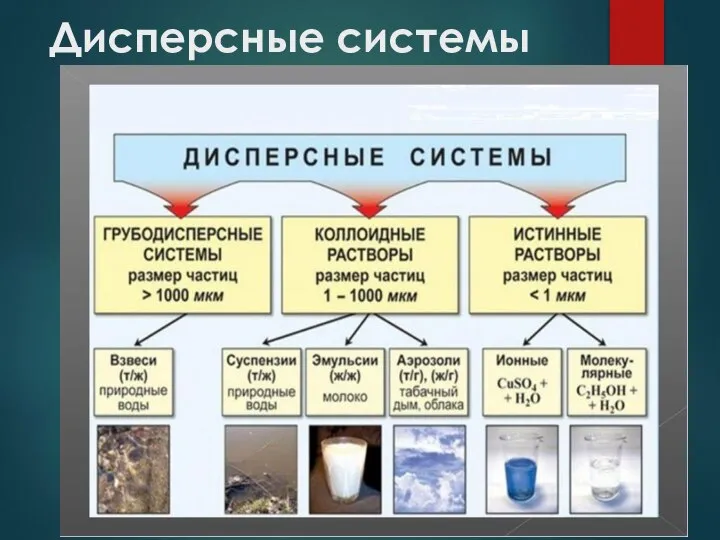
- 6. Дисперсные системы В зависимости от размера частиц дисперсной фазы различают грубодисперсные (взвеси) - размер частиц больше
- 7. Дисперсные системы
- 8. Дисперсные системы
- 9. Дисперсные системы В зависимости от агрегатного состояния дисперсной фазы и дисперсионной среды дисперсные системы разделяют на
- 10. Дисперсные системы Суспензия – грубодисперсная система, в которой твёрдые частицы размером более 10-3 см равномерно распределены
- 11. Дисперсные системы Аэрозоль – грубодисперсная система, в которой твёрдые (н-р, смог, пылевое облако) или жидкие (облака,
- 12. Дисперсные системы Получение и свойства коллоидных растворов Тонкодисперсные коллоидные системы получили название «золь». Золи могут быть
- 13. Дисперсные системы Получение и свойства коллоидных растворов Золи прозрачны, как и истинные растворы. Чтобы отличить золь
- 14. Дисперсные системы
- 15. Дисперсные системы Коагуляция коллоидных растворов Если к золю добавить раствор электролита, произойдет нейтрализация заряда коллоидных частиц.
- 16. Дисперсные системы
- 21. Домашнее задание Раздел 3.6. Контрольные вопросы и задания № 1-5 стр. 56.
- 23. Скачать презентацию

















 Стеклянные товары. Основные сырьевые материалы для производства стекла
Стеклянные товары. Основные сырьевые материалы для производства стекла Известные ученые и их открытия
Известные ученые и их открытия Определение активной реакции воды (рН)
Определение активной реакции воды (рН) Химический состав прямогонных бензинов
Химический состав прямогонных бензинов Physical chemistry of surface phenomena. Basics of adsorptive therapy
Physical chemistry of surface phenomena. Basics of adsorptive therapy Конструкционные материалы. Пластмассы
Конструкционные материалы. Пластмассы Истинная и средняя скорости реакции
Истинная и средняя скорости реакции  Буферные растворы. Буферная емкость
Буферные растворы. Буферная емкость Презентация по Химии "Алюміній" - скачать смотреть бесплатно
Презентация по Химии "Алюміній" - скачать смотреть бесплатно Сердечные гликозиды. Общая характеристика, методы выделения, анализ. (Тема 7)
Сердечные гликозиды. Общая характеристика, методы выделения, анализ. (Тема 7) лекарства Урок-защита проектов Разработала учитель химии МОУ «Гимназия №1» г. Саратова Шишкина И.Ю.
лекарства Урок-защита проектов Разработала учитель химии МОУ «Гимназия №1» г. Саратова Шишкина И.Ю. Круговорот воды в природе
Круговорот воды в природе Циклоалканы (полиметиленовые, циклопарафины, ациклические)
Циклоалканы (полиметиленовые, циклопарафины, ациклические) Количество вещества. Единица измерения вещества моль
Количество вещества. Единица измерения вещества моль Металлы в природе. Общие способы их получения.
Металлы в природе. Общие способы их получения. Введение в органическую химию
Введение в органическую химию Презентация по Химии "Закон збереження маси" - скачать смотреть
Презентация по Химии "Закон збереження маси" - скачать смотреть  Гетерогенный катализ
Гетерогенный катализ Спирты: получение, свойства и применение
Спирты: получение, свойства и применение Кислотность и основность органических соединений
Кислотность и основность органических соединений Химические свойства карбоновых кислот
Химические свойства карбоновых кислот Задачи к экзамену по дисциплине «ИПР и ОП»
Задачи к экзамену по дисциплине «ИПР и ОП» Дисахариды, моносахариды
Дисахариды, моносахариды Атомы и молекулы. Простые и сложные вещества. 8 класс
Атомы и молекулы. Простые и сложные вещества. 8 класс Тағамдық қоспалардың гигиеналық регламенттелуі
Тағамдық қоспалардың гигиеналық регламенттелуі Водородная связь
Водородная связь СЕРА Учитель химии МКОУ СОШ №3 с.Чикола РСО-Алания Кадохова А.Г.
СЕРА Учитель химии МКОУ СОШ №3 с.Чикола РСО-Алания Кадохова А.Г. Теоретические основы биоорганической химии
Теоретические основы биоорганической химии