Содержание
- 2. Что читать? Ахметов Н.С. «Общая и неорганическая химия». Карапетьянц М.Х., Дракин С.И. «Общая и неорганическая химия».
- 3. S2Р5 S1 + электрон Полностью заполненный уровень Стабильный ион Н- Двухатомная молекула, как и других галогенов:
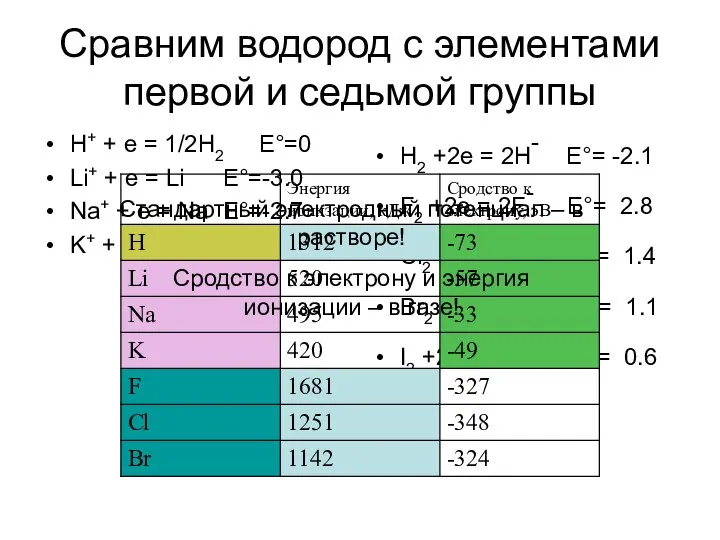
- 4. Сравним водород с элементами первой и седьмой группы H+ + e = 1/2H2 E°=0 Li+ +
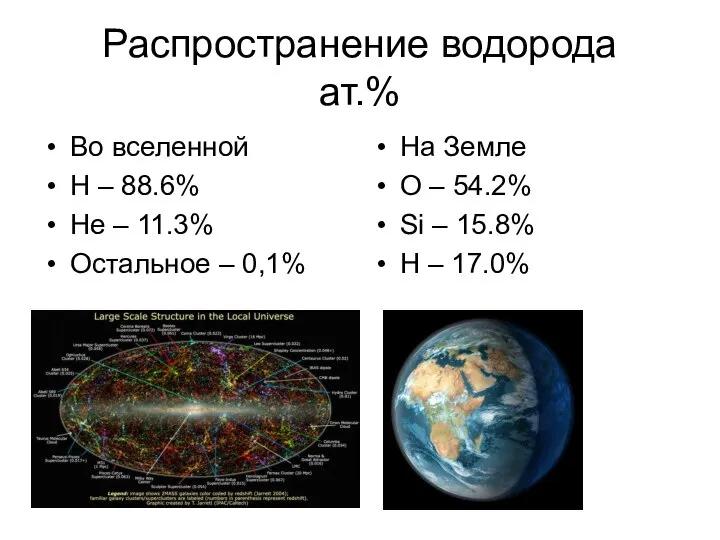
- 5. Распространение водорода ат.% Во вселенной H – 88.6% He – 11.3% Остальное – 0,1% На Земле
- 6. Степени окисления водорода 1S1 + электрон - электрон -1 +1 0 ПРИМЕРЫ NaH LiAlH4 H2 H2O
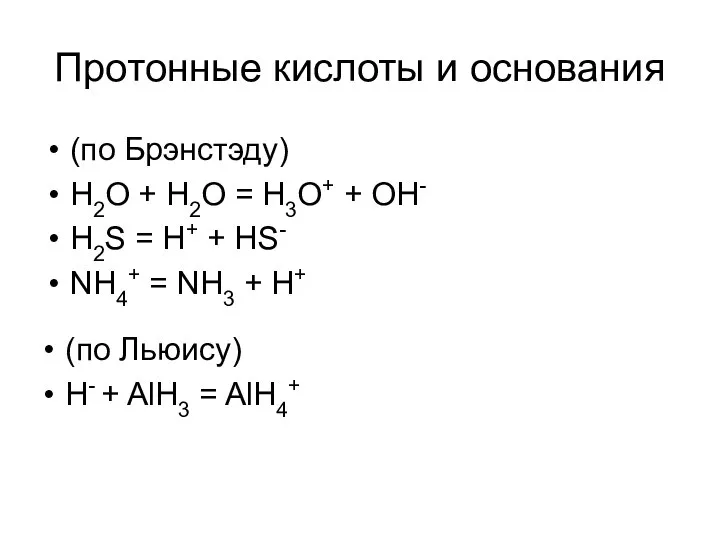
- 7. Протонные кислоты и основания (по Брэнстэду) H2O + H2O = H3O+ + OH- H2S = H+
- 8. Получение водорода Лабораторные способы: Основаны на ОВР 1. CaH2 + 2 H2O = Ca(OH)2 + H2
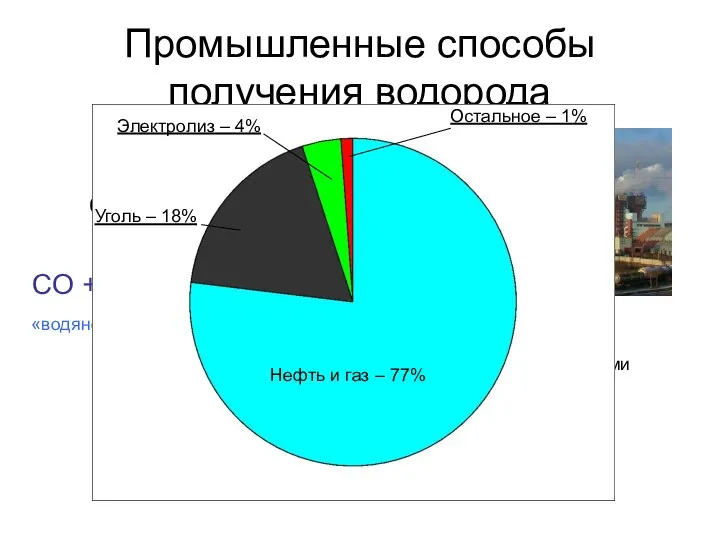
- 9. Промышленные способы получения водорода 750 °C Ni CH4 + H2O → CO + 3H2 C(кокс) +
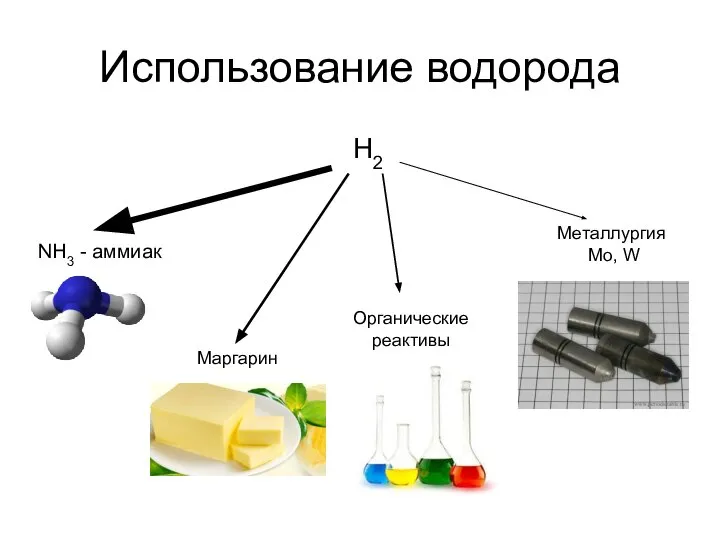
- 10. Использование водорода H2 NH3 - аммиак Маргарин Органические реактивы Металлургия Mo, W
- 11. Водородная энергетика Водородная энергетика — направление выработки и потребления энергии человечеством, основанное на использовании водорода в
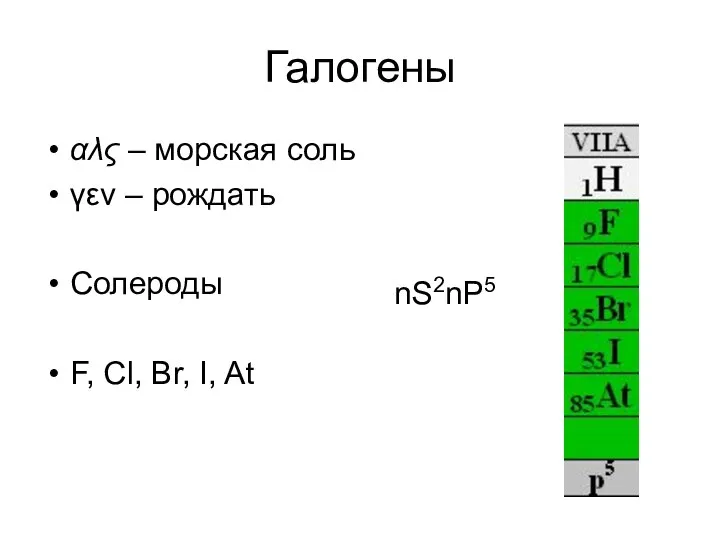
- 12. Галогены αλς – морская соль γεν – рождать Солероды F, Cl, Br, I, At nS2nP5
- 13. Распространение в природе F Cl Br I At 0.063 0.017 0.0002 4.10-5 - 13 место 20
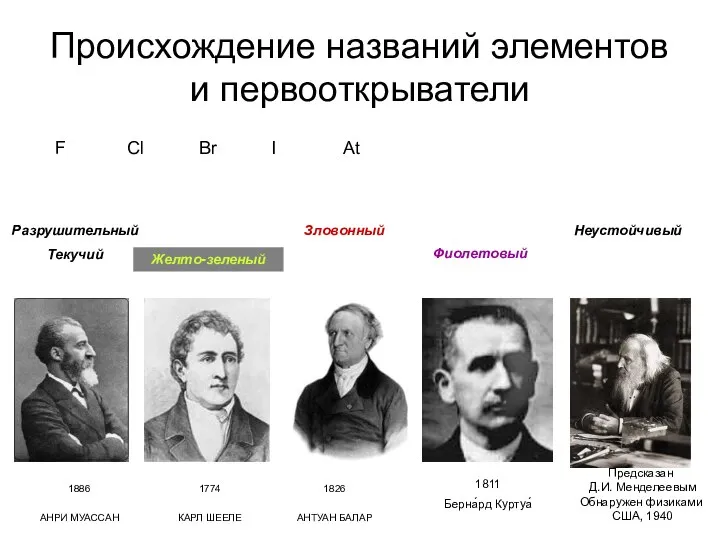
- 14. Происхождение названий элементов и первооткрыватели F Cl Br I At Разрушительный Текучий Желто-зеленый Зловонный Фиолетовый Неустойчивый
- 15. F Cl Br I At Физические свойства Температуры кипения и плавления (°С) -220 -101 -7 117
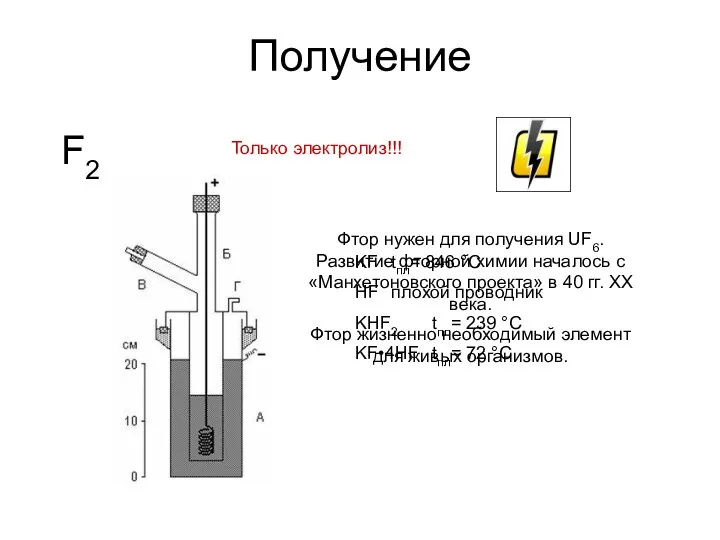
- 16. Получение F2 Только электролиз!!! KF tпл= 846 °С HF плохой проводник KHF2 tпл= 239 °С KF•4HF
- 17. Абу Али Хусейн ибн Абдаллах ибн Си́на «Авиценна» «Все есть яд, все есть лекарство – всему
- 18. Получение Cl2 Все тот же электролиз. Промышленный способ. Электролиз водных растворов: 2 H2O + 2 NaCl
- 19. Получение Br2 I2 Электролиз. Промышленный способ. Окисление галогенид-ионов 2KMnO4 + 16HBr → 5Br2 + 2MnBr2 +
- 20. Получение галогеноводородов Реакция замещения CaF2 + H2SO4 → 2HF + CaSO4 2NaCl + H2SO4 → 2HCl
- 21. Галогеноводороды При с.у. безцветные газы, хорошо растворимые в воде. Растворы в воде – сильные кислоты (кроме
- 22. Взаимодействие галогенов с водой Фтор – уникальный окислитель, очень сильный: 2F2 + 2H2O = 4HF +
- 23. Химические свойства nS2nP5 +7 +5 +3 +1 0 -1 Степени окисления ОК И С ЛИ Т
- 25. Скачать презентацию














 Презентация по химии Электрохимический ряд напряжений металлов
Презентация по химии Электрохимический ряд напряжений металлов  Минеральные компоненты молока и молочных продуктов. Макроэлементы
Минеральные компоненты молока и молочных продуктов. Макроэлементы Металлы VБ–подгруппы
Металлы VБ–подгруппы Карбоновые кислоты
Карбоновые кислоты Именные реакции в органической химии
Именные реакции в органической химии Иондық және ковалентті байланысы бар қосылыстардың электролиттік диссоциациясы
Иондық және ковалентті байланысы бар қосылыстардың электролиттік диссоциациясы Металлы и сплавы -материал для древних и современных олимпийских наград.
Металлы и сплавы -материал для древних и современных олимпийских наград.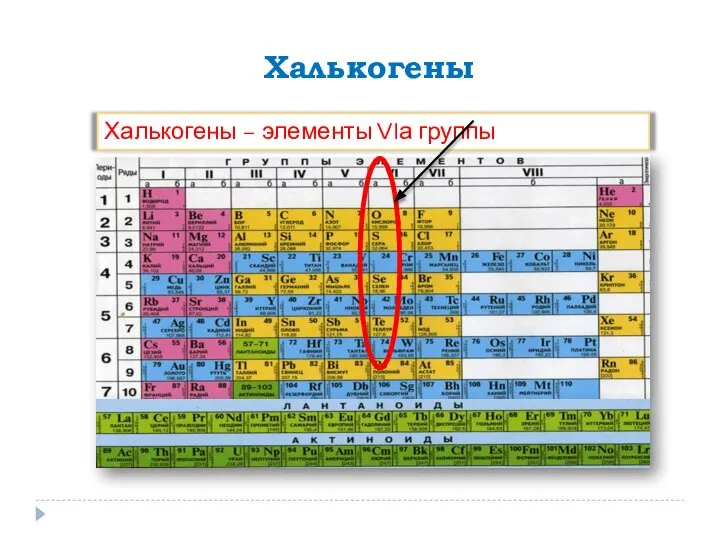 Кислород. Сера
Кислород. Сера Феноло-альдегидные олигомеры и пластмассы на их основе
Феноло-альдегидные олигомеры и пластмассы на их основе Химический состав свежих плодов и овощей
Химический состав свежих плодов и овощей Алканы. Циклоалканы
Алканы. Циклоалканы Окислительно-восстановительные потенциалы (электродные потенциалы)
Окислительно-восстановительные потенциалы (электродные потенциалы) Обмен нуклеотидов. Матричные биосинтезы
Обмен нуклеотидов. Матричные биосинтезы Химический элементы в нашей жизни
Химический элементы в нашей жизни Презентация по химии Угарный газ
Презентация по химии Угарный газ  Федоренко Катерина
Федоренко Катерина  Коррозия металлов
Коррозия металлов Расчет ректификационной колонны
Расчет ректификационной колонны Окислительно-восстановителые реакции в органической химии
Окислительно-восстановителые реакции в органической химии Колообіг Оксигену Підготувала: учениця 10-В
Колообіг Оксигену Підготувала: учениця 10-В  Непредельные углеводороды. (Лекция 6)
Непредельные углеводороды. (Лекция 6) Презентация по Химии "История открытия и экспериментального подтверждения периодического закона" - скачать смотреть
Презентация по Химии "История открытия и экспериментального подтверждения периодического закона" - скачать смотреть  Роль органической химии в жизни человека. Выполнила Чабан Выполнила ученица 10 «б» класса МОУ «СОШ р.п. Озинки» Чабан Мария
Роль органической химии в жизни человека. Выполнила Чабан Выполнила ученица 10 «б» класса МОУ «СОШ р.п. Озинки» Чабан Мария  Зеленая химия и проблемы устойчивого развития Член-корреспондент РАН Н.П.Тарасова РХТУ им.Д.И.Менделеева Институт химии и про
Зеленая химия и проблемы устойчивого развития Член-корреспондент РАН Н.П.Тарасова РХТУ им.Д.И.Менделеева Институт химии и про «Кремний и его соединения» Автор: учитель химии и биологии МБОУ Летуновской СОШ Короткова Фаина Алексеевна
«Кремний и его соединения» Автор: учитель химии и биологии МБОУ Летуновской СОШ Короткова Фаина Алексеевна Кристаллические решетки
Кристаллические решетки Тема урока: «Скорость химических реакций.» Цель урока : Знать определение скорости реагирующих веществ, от реакций; зависимости с
Тема урока: «Скорость химических реакций.» Цель урока : Знать определение скорости реагирующих веществ, от реакций; зависимости с Подготовка к ГИА. А8. Реакции ионного обмена и условия их осуществления
Подготовка к ГИА. А8. Реакции ионного обмена и условия их осуществления