Содержание
- 2. Вещество (более 70 млн.) Что надо знать о каждом веществе? Формула (из чего состоит) Структура (как
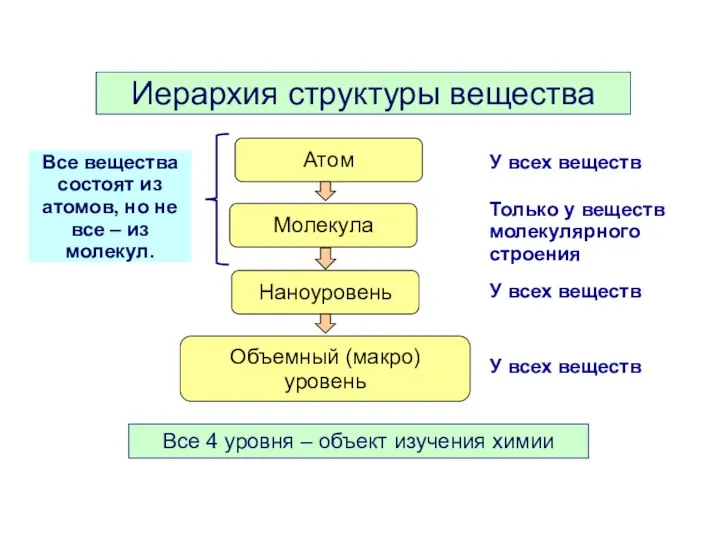
- 3. Иерархия структуры вещества Атом Молекула Наноуровень Объемный (макро) уровень У всех веществ Только у веществ молекулярного
- 4. Вещества молекулярного и немолекулярного строения
- 5. Вещества
- 6. Вещества Хлорид натрия Формульная единица NaCl
- 7. Вещества Диоксид кремния Формульная единица SiO2 Минералогический музей имени Ферсмана находится возле входа в Нескучный сад.
- 8. Разнообразие химических структур. пропеллан C5H6 коронен (супербензол) C24H12 кавитанд C36H32O8
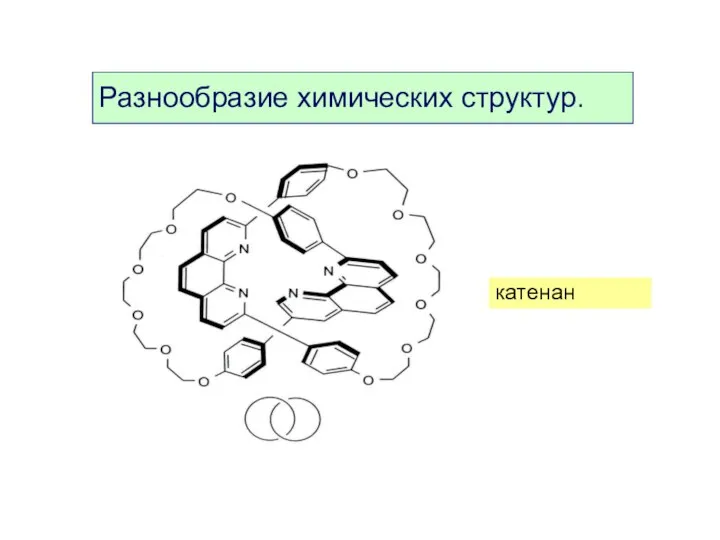
- 9. катенан Разнообразие химических структур.
- 10. катенан Разнообразие химических структур.
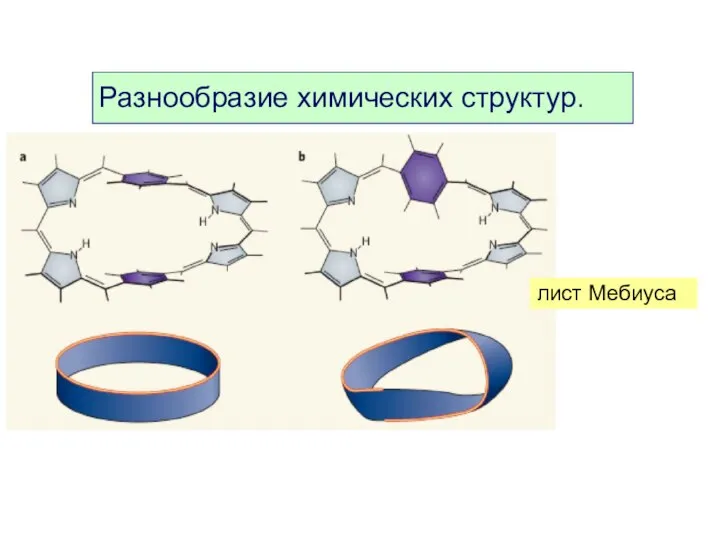
- 11. лист Мебиуса Разнообразие химических структур.
- 12. Молекула Молекула – устойчивая система, состоящая из нескольких атомных ядер и электронов. Атомы объединяются в молекулы
- 13. Главная движущая сила образования химической связи между частицами вещества – уменьшение общей энергии системы.
- 14. Основные типы химической связи: Ионная Ковалентная Металлическая Основные межмолекулярные взаимодействия: Водородные связи Ван-дер-Ваальсовы связи
- 15. Ионная связь Если связь образуют атомы с резко различающимися значениями электроотрицательности (ΔОЭО ≥ 1,7), общая электронная
- 16. Ионная связь Кулоновский потенциал сферически симметричен, направлен во все стороны, поэтому ионная связь ненаправлена. Кулоновский потенциал
- 17. Ионная связь Соединения с ионным типом связи твердые, хорошо растворимые в полярных растворителях, имеют высокие температуры
- 18. Ионная связь Кривая I: притяжение ионов, если бы они представляли собой точечные заряды. Кривая II: отталкивание
- 19. Химическая связь в молекулах Химическую связь в молекулах можно описать с позиций двух методов: - метода
- 20. Метод валентных связей Теория Гейтлера-Лондона Основные положения метода ВС: 1. Связь образуют два электрона с противоположными
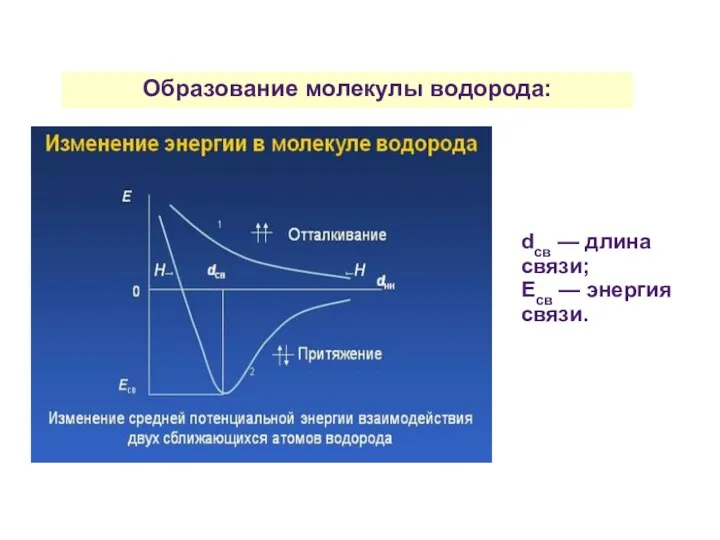
- 21. Образование молекулы водорода: dсв — длина связи; Есв — энергия связи.
- 22. При сближении двух атомов возникают силы притяжения и отталкивания: 1) притяжения: «электрон-ядро» соседних атомов; 2) отталкивания:
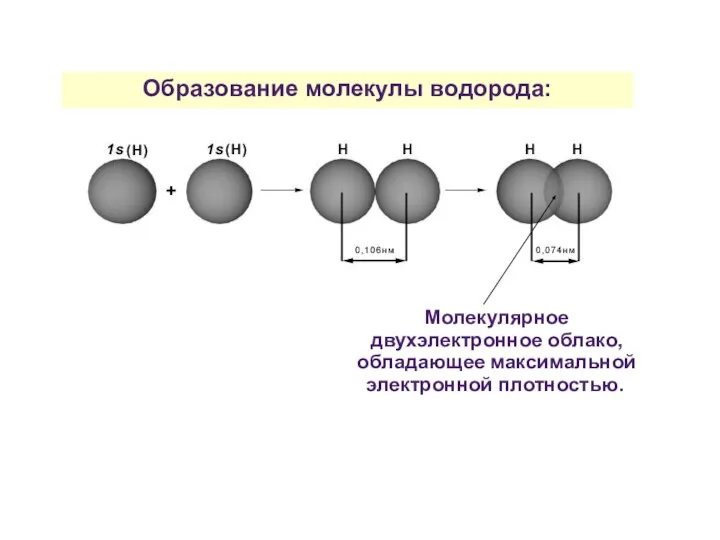
- 23. Образование молекулы водорода: Молекулярное двухэлектронное облако, обладающее максимальной электронной плотностью.
- 24. Химическая связь, осуществляемая общими электронными парами, называется ковалентной. Общая электронная пара может образоваться двумя способами: 1)
- 25. Способы перекрывания атомных орбиталей при образовании ковалентной связи Если образование максимальной электронной плотности связи происходит по
- 26. Способы перекрывания атомных орбиталей при образовании ковалентной связи Если образование максимальной электронной плотности связи происходит по
- 27. Полярная и неполярная ковалентная связь 1) Если связь образуют одинаковые атомы, двухэлектронное облако связи распределяется в
- 28. Полярная ковалентная связь Дипольный момент связи H+δCl-δ или H+0,18Cl-0,18 Где ±δ — эффективный заряд атома, доля
- 29. Полярная ковалентная связь Дипольный момент молекулы Дипольный момент молекулы равен сумме векторов дипольных моментов связей с
- 30. Полярная ковалентная связь Дипольный момент молекулы В произведении μ = δl обе величины разнонаправлены. Поэтому надо
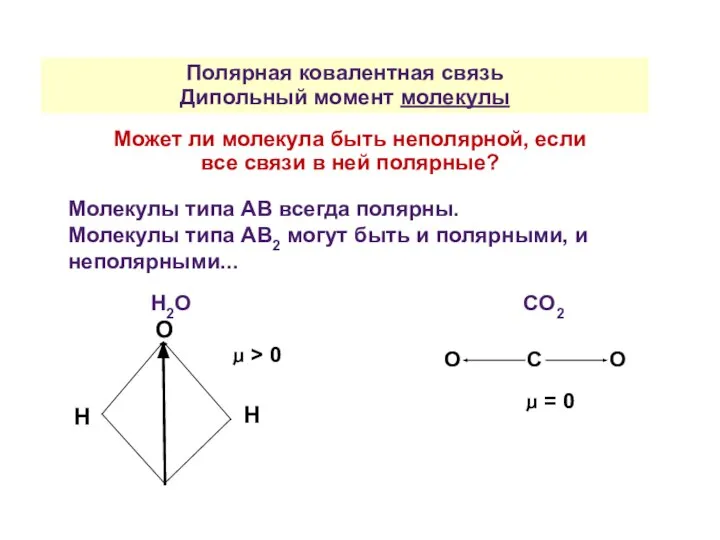
- 31. Полярная ковалентная связь Дипольный момент молекулы Может ли молекула быть неполярной, если все связи в ней
- 32. Полярная ковалентная связь Молекулы, состоящие из трех атомов и более (АВ2, АВ3, АВ4, АВ5, АВ6) ,
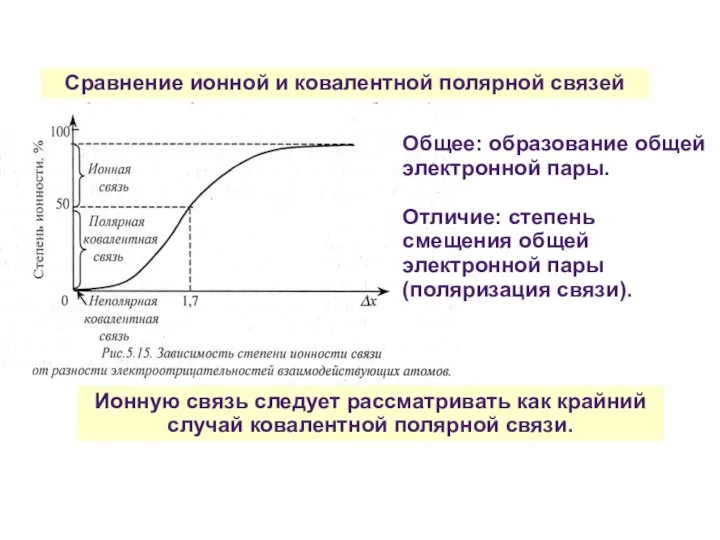
- 33. Сравнение ионной и ковалентной полярной связей Ионную связь следует рассматривать как крайний случай ковалентной полярной связи.
- 34. Сравнение характеристик ионной и ковалентной полярной связей Ковалентная связь: насыщена и направлена Насыщаемость (максимальная валентность) —
- 35. Сравнение характеристик ионной и ковалентной полярной связей Направленность связи задают валентные углы. Валентные углы определяют экспериментально
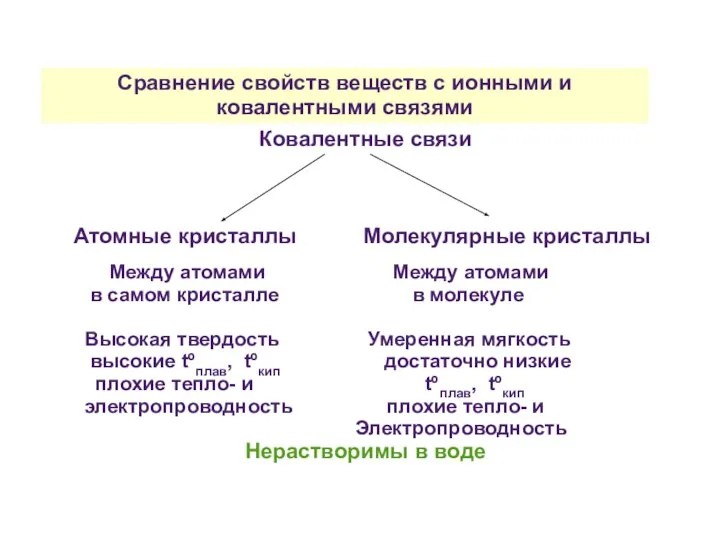
- 36. Сравнение свойств веществ с ионными и ковалентными связями Ковалентные связи Атомные кристаллы Молекулярные кристаллы Между атомами
- 37. Сравнение свойств веществ с ионными и ковалентными связями Молекулярный кристалл Температура плавления 112,85 °С
- 38. Сравнение свойств веществ с ионными и ковалентными связями Атомный ковалентный кристалл Температура плавления ≈ 3700 °С
- 39. Сравнение свойств веществ с ионными и ковалентными связями Ионные связи между ионами в кристалле твердость и
- 40. Сравнение свойств веществ с ионными и ковалентными связями Ионный кристалл Температура плавления ≈ 800 °С
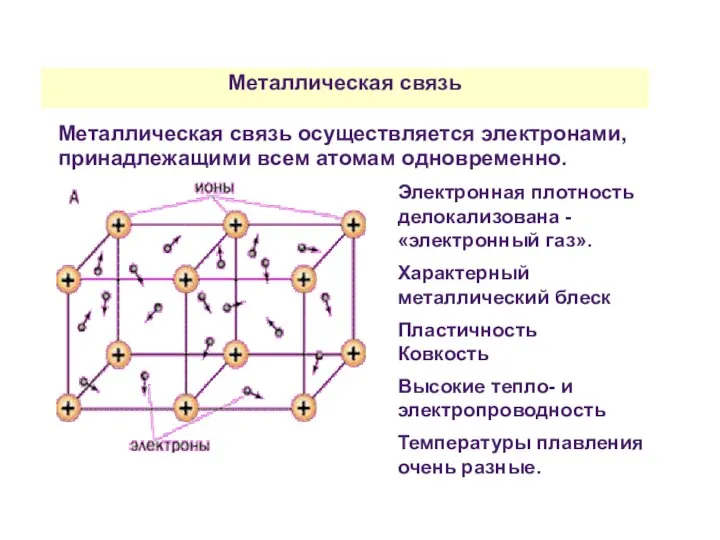
- 41. Металлическая связь Металлическая связь осуществляется электронами, принадлежащими всем атомам одновременно. Электронная плотность делокализована - «электронный газ».
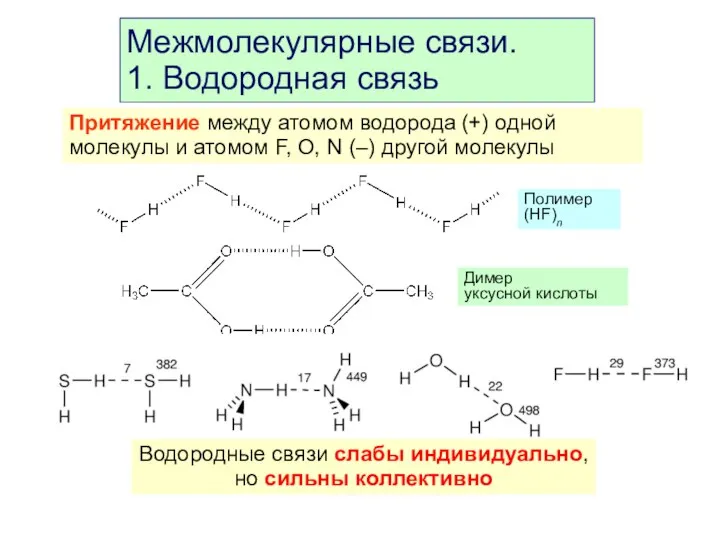
- 42. Межмолекулярные связи. 1. Водородная связь Притяжение между атомом водорода (+) одной молекулы и атомом F, O,
- 43. Межмолекулярные связи. 2. Водородная связь в ДНК
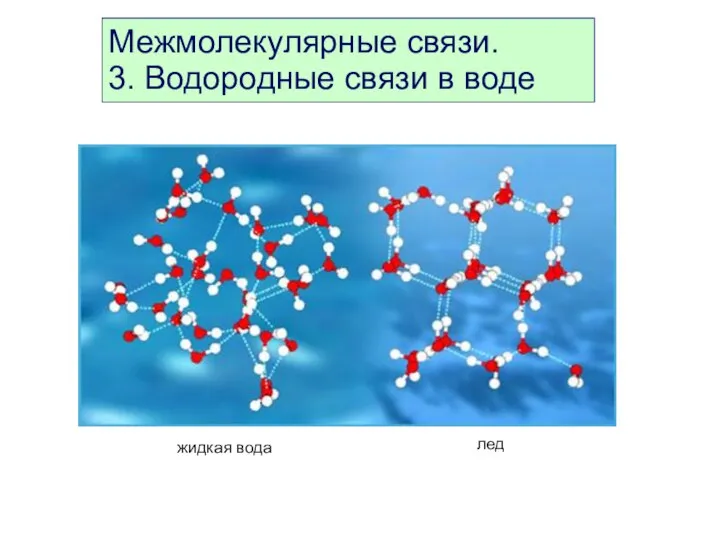
- 44. Межмолекулярные связи. 3. Водородные связи в воде
- 45. Межмолекулярные связи. 4. Образование водородных связей в воде жидкая вода превращение воды в лед
- 46. Межмолекулярные связи. 5. Ван-дер-ваальсовы связи Даже если между молекулами нет водородных связей, молекулы всегда притягиваются друг
- 48. Скачать презентацию


































 Презентация по Химии "Твердые вещества" - скачать смотреть
Презентация по Химии "Твердые вещества" - скачать смотреть  Основания, их состав, номенклатура и основные представители
Основания, их состав, номенклатура и основные представители Композитный материал
Композитный материал Формы кристаллов и агрегаты
Формы кристаллов и агрегаты Обмен простых белков. Дезаминирование и трансаминирование аминокислот
Обмен простых белков. Дезаминирование и трансаминирование аминокислот Нуклеиновые кислоты
Нуклеиновые кислоты Реакция Пфитцингера
Реакция Пфитцингера Химическая организация клетки. Неорганические вещества, входящие в состав клетки
Химическая организация клетки. Неорганические вещества, входящие в состав клетки Предмет органической химии. Теория строения органических веществ А.М. Бутлерова
Предмет органической химии. Теория строения органических веществ А.М. Бутлерова Топливо и его характеристики
Топливо и его характеристики Анализ лекарственных форм
Анализ лекарственных форм Обмен веществ. Регуляция водно-солевого обмена. (Лекция 5)
Обмен веществ. Регуляция водно-солевого обмена. (Лекция 5) Алхимический период
Алхимический период Теорія сильних і слабких електролітів. Рівновага в розчинах малорозчинних електролітів
Теорія сильних і слабких електролітів. Рівновага в розчинах малорозчинних електролітів Характеристика растворов. Кислоты, основания, соли в свете теории электролитической диссоциации. Гидролиз солей
Характеристика растворов. Кислоты, основания, соли в свете теории электролитической диссоциации. Гидролиз солей Дифференциальный диагноз анемий
Дифференциальный диагноз анемий Галогены Что это такое ?
Галогены Что это такое ? Химия элементов VIA группы
Химия элементов VIA группы Різноманіття карбонових кислот
Різноманіття карбонових кислот Одноатомні спирти Підготували Учениці 9-Б класу
Одноатомні спирти Підготували Учениці 9-Б класу  Презентация Проверим знания по теме «Кремний»
Презентация Проверим знания по теме «Кремний» Методы определения коэффициентов селективности
Методы определения коэффициентов селективности Моторные масла
Моторные масла Чистые вещества и смеси. Способы разделения смесей. Загадка
Чистые вещества и смеси. Способы разделения смесей. Загадка Золь. Свойства золи
Золь. Свойства золи Enantioselective synthesis of an ophiobolin sesterterpene via a programmed radical cascade
Enantioselective synthesis of an ophiobolin sesterterpene via a programmed radical cascade Презентация по Химии "Металлы 9 класс" - скачать смотреть
Презентация по Химии "Металлы 9 класс" - скачать смотреть  Строение электронных оболочек атомов
Строение электронных оболочек атомов