Содержание
- 2. Антибиотики - это лекарственные средства, избирательно угнетающие жизнедеятельность микроорганизмов. в России используется 30 групп антибиотиков, число
- 3. Особенности антибиотиков 1. Мишень-рецептор находится не в тканях человека, а в клетке микроорганизма. 2. Активность антибиотиков
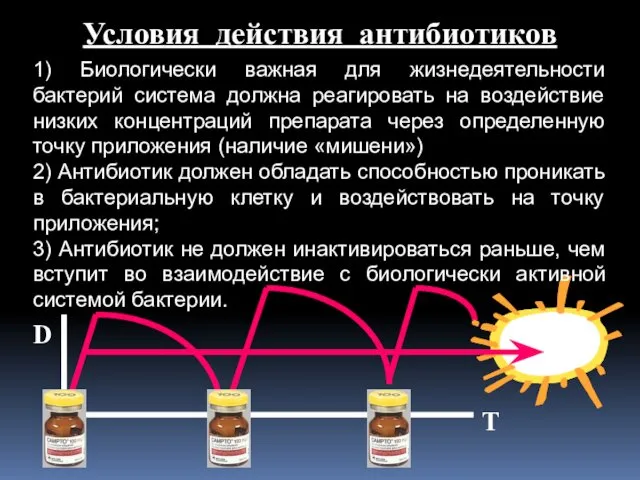
- 4. Условия действия антибиотиков 1) Биологически важная для жизнедеятельности бактерий система должна реагировать на воздействие низких концентраций
- 5. Принципы рационального назначения антибиотиков (1-5) Компонента «больной» 1. Материал для микробиологической диагностики следует брать до начала
- 6. Принципы рационального назначения антибиотиков (2-5) Компонента «микроорганизм» 3. Учет факторов - чувствительность, резистентность, устойчивость, выживаемость
- 7. Принципы рационального назначения антибиотиков (3-5) Компонента «врач» 4. Необходимо иметь современную и объективную информацию о препаратах
- 8. Принципы рационального назначения антибиотиков (4-5) Общие принципы 6. Максимальные дозы до полного преодоления болезни; предпочтительный способ
- 9. Принципы рационального назначения антибиотиков (5-5) Общие принципы 8. Проведение программы циклической замены антибактериального препарата. 9. Комбинированное
- 10. Классификация и механизм действия β-лактамные антибиотики - Пенициллины Природные: бензилпенициллин (пенициллин - натриевая и калиевая соли),
- 11. Полусинтетические: 1. Изоксазолилпенициллины (пенициллиназоста-бильные, антистафилококковые): оксациллин 2. Аминопенициллины: ампициллин, амоксициллин 3. Карбоксипенициллины (антисинегнойные): карбенициллин, тикарциллин 4.
- 12. Механизм действия β-лактаминов Мишень действия - пенициллиносвязывающие белки бактерий, выполняющих роль ферментов на завершающем этапе синтеза
- 13. Для преодоления приобретенной устойчивости микроорганизмов, вырабатывающих особые ферменты - β-лактамазы (разрушающих β-лактамы), разработаны необратимые ингибиторы β-лактамаз
- 14. Лекарственные взаимодействия (1-2) Пенициллины нельзя смешивать в одном шприце или в одной инфузионной системе с аминогликозидами
- 15. Лекарственные взаимодействия (2-2) Требуется соблюдать осторожность при сочетании пенициллинов, активных в отношении синегнойной палочки, с антикоагулянтами
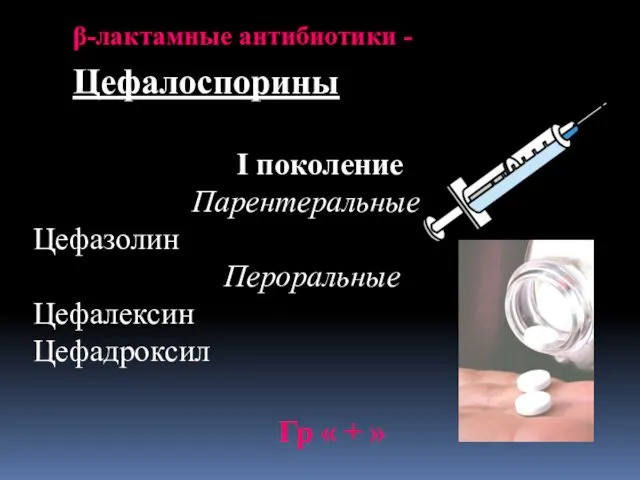
- 16. β-лактамные антибиотики - Цефалоспорины I поколение Парентеральные Цефазолин Пероральные Цефалексин Цефадроксил Гр « + »
- 17. II поколение Парентеральные Цефуроксим Пероральные Цефуроксим аксетил Цефаклор Гр « - » Гр « + »
- 18. III поколение Парентеральные Цефотаксим Цефтриаксон Цефтазидим Цефоперазон Пероральные Цефиксим Цефтибутен Гр « - »
- 19. IV поколение Парентеральные Цефепим, Цефпиром Активны в отношении некоторых штаммов, устойчивых к III поколению цефалоспоринов. Более
- 20. Лекарственные взаимодействия При сочетании с аминогликозидами и/или петлевыми диуретиками, особенно у пациентов с нарушениями функции почек,
- 21. β-лактамные антибиотики Карбапенемы: имипенем, меропенем Препараты резерва, более устойчивые к действию бактериальных β-лактамаз, более быстро проникают
- 22. Лекарственные взаимодействия Карбапенемы нельзя применять в сочетании с другими β-лактамными антибиотиками ввиду их антагонизма. Не рекомендуется
- 23. β-лактамные антибиотики Монобактамы: (моноциклические β-лактамы) азтреонам Препарат резерва, узкого спектра действия, его следует назначать в сочетании
- 24. Группа аминогликозидов I поколение: Стрептомицин, Неомицин, Канамицин II поколение: Гентамицин, Тобрамицин, Нетилмицин III поколение: Амикацин Гр
- 25. Механизм действия Бактерицидное действие, нарушение синтеза белка рибосомами. Степень антибактериальной активности аминогликозидов зависит от их концентрации.
- 26. Основное клиническое значение аминогликозиды имеют при лечении нозокомиальных инфекций, вызванных аэробными грамотрицательными возбудителями, а также инфекционного
- 27. Лекарственные взаимодействия Нельзя смешивать в одном шприце или одной инфузионной системе с β-лактамными антибиотиками или гепарином
- 28. Группа аминоциклитолов (структурно сходны с аминогликозидами) Природные: Спектиномицин Механизм действия Бактериостатическое действие, подавление синтеза белка рибосомами
- 29. Группа хинолонов/фторхинолонов I поколение (нефторированные хинолоны): 3 кислоты - налидиксовая, оксолиновая и пипемидовая (пипемидиевая) узкий спектр,
- 30. Механизм действия Хинолоны/фторхинолоны оказывают бактерицидный эффект, ингибируя жизненно важный фермент микробной клетки - ДНК-гиразу и нарушая
- 31. Лекарственные взаимодействия (1-4) При одновременном применении с антацидами и другими препаратами, содержащими ионы магния, цинка, железа,
- 32. Лекарственные взаимодействия (2-4) Хинолоны проявляют антагонизм с производными нитрофурана, поэтому следует избегать комбинаций этих препаратов. Хинолоны
- 33. Лекарственные взаимодействия (3-4) Повышают кардиотоксичность препаратов, удлиняющих интервал QT на электрокардиограмме, так как увеличивается риск развития
- 34. Лекарственные взаимодействия (4-4) При назначении ципрофлоксацина, норфлоксацина и пефлоксацина совместно с препаратами, ощелачивающими мочу (ингибиторы карбоангидразы,
- 35. Группа макролидов 14-членные: Природные - Эритромицин Полусинтетические - Кларитромицин, Рокситромицин 15-членные (азалиды): Полусинтетические - Азитромицин 16-членные:
- 36. Механизм действия Макролиды временно прекращают размножение грамположительных кокков. Эффект обусловлен нарушением синтеза белка рибосомами микробной клетки.
- 37. Лекарственные взаимодействия (1-2) Макролиды ингибируют метаболизм и повышают концентрацию в крови непрямых антикоагулянтов, теофиллина, карбамазепина, вальпроевой
- 38. Лекарственные взаимодействия (2-2) Антациды снижают всасывание макролидов, особенно азитромицина, в ЖКТ. Рифампицин усиливает метаболизм макролидов в
- 39. Группа тетрациклинов Природные: тетрациклин Полусинтетические: доксициклин Сохраняют клиническое значение при хламидийных инфекциях, риккетсиозах, боррелиозах и некоторых
- 40. Лекарственные взаимодействия (1-2) При приеме внутрь одновременно с антацидами, содержащими кальций, алюминий и магний, с натрия
- 41. Лекарственные взаимодействия (2-2) Карбамазепин, фенитоин и барбитураты усиливают печеночный метаболизм доксициклина и снижают его концентрацию в
- 42. Группа линкосамидов Природные: линкомицин Его полусинтетический аналог: клиндамицин Механизм действия Оказывают бактериостатическое действие, которое обусловлено ингибированием
- 43. Лекарственные взаимодействия Антагонизм с хлорамфениколом и макролидами. При одновременном использовании с опиоидными анальгетиками, ингаляционными наркотическими средствами
- 44. Группа гликопептидов Природные: ванкомицин и тейкопланин Механизм действия Нарушают синтез клеточной стенки бактерий. Оказывают бактерицидное действие,
- 45. Лекарственные взаимодействия При одновременном применении с местными анестетиками увеличивается риск развития гиперемии и других симптомов гистаминовой
- 46. Группа полимиксинов Полимиксин В - парентеральный Полимиксин М - пероральный Механизм действия Оказывают бактерицидное действие, которое
- 47. Лекарственные взаимодействия Не следует сочетать полимиксин В с аминогликозидами и амфотерицином В (повышение риска нефротоксичности), а
- 48. Группа рифамицинов Природные: рифамицин SV, рифамицин S Полусинтетические: рифампицин, рифабутин Механизм действия Бактерицидный эффект, специфические ингибиторы
- 49. Лекарственные взаимодействия Рифампицин - индуктор микросомальных ферментов системы цитохрома P-450; ускоряет метаболизм многих лекарственных препаратов: непрямых
- 50. Хлорамфеникол Природный: Хлорамфеникол (левомицетин) Механизм действия Бактериостатическое действие, из-за нарушения синтеза белка рибосомами. В высоких концентрациях
- 51. Лекарственные взаимодействия Антагонист макролидов и линкосамидов. Снижает эффективность препаратов железа, фолиевой кислоты и витамина В12 за
- 52. ЛЕКАРСТВЕННАЯ РЕЗИСТЕНТНОСТЬ МИКРООРГАНИЗМОВ Механизмы резистентности к антибактериальным препаратам
- 53. ОБЩИЕ ЗАКОНОМЕРНОСТИ Основой терапевтического действия антибактериальных препаратов является подавление жизнедеятельности возбудителя инфекционной болезни в результате угнетения
- 54. Известны следующие биохимические механизмы устойчивости бактерий к антибиотикам: Модификация мишени действия. Инактивация антибиотика. Активное выведение антибиотика
- 55. МЕХАНИЗМЫ УСТОЙЧИВОСТИ К АНТИБАКТЕРИАЛЬНЫМ ПРЕПАРАТАМ ОТДЕЛЬНЫХ ГРУПП β-лактамные антибиотики Ферментативная инактивация. Наиболее распространенным механизмом устойчивости микроорганизмов
- 56. МЕХАНИЗМЫ УСТОЙЧИВОСТИ К АНТИБАКТЕРИАЛЬНЫМ ПРЕПАРАТАМ ОТДЕЛЬНЫХ ГРУПП β-лактамные антибиотики β-лактамазы встречаются у подавляющего большинства клинически значимых
- 57. МЕХАНИЗМЫ УСТОЙЧИВОСТИ К АНТИБАКТЕРИАЛЬНЫМ ПРЕПАРАТАМ ОТДЕЛЬНЫХ ГРУПП β-лактамные антибиотики Наиболее распространенные β-лактамазы и их свойства
- 58. МЕХАНИЗМЫ УСТОЙЧИВОСТИ К АНТИБАКТЕРИАЛЬНЫМ ПРЕПАРАТАМ ОТДЕЛЬНЫХ ГРУПП β-лактамные антибиотики Снижение проницаемости внешних структур грамотрицательных бактерий. Внешняя
- 59. МЕХАНИЗМЫ УСТОЙЧИВОСТИ К АНТИБАКТЕРИАЛЬНЫМ ПРЕПАРАТАМ ОТДЕЛЬНЫХ ГРУПП Аминогликозиды Ферментативная инактивация. Основным механизмом устойчивости к аминогликозидамОсновным механизмом
- 60. МЕХАНИЗМЫ УСТОЙЧИВОСТИ К АНТИБАКТЕРИАЛЬНЫМ ПРЕПАРАТАМ ОТДЕЛЬНЫХ ГРУПП Аминогликозиды АМК - амикацинАМК - амикацин; ГЕН - гентамицинАМК
- 61. МЕХАНИЗМЫ УСТОЙЧИВОСТИ К АНТИБАКТЕРИАЛЬНЫМ ПРЕПАРАТАМ ОТДЕЛЬНЫХ ГРУПП Аминогликозиды Снижение проницаемости внешних структур. Проникновение аминогликозидов Проникновение аминогликозидов
- 62. МЕХАНИЗМЫ УСТОЙЧИВОСТИ К АНТИБАКТЕРИАЛЬНЫМ ПРЕПАРАТАМ ОТДЕЛЬНЫХ ГРУПП Хинолоны / фторхинолоны Модификация мишени действия. Ведущим механизмом устойчивости
- 63. МЕХАНИЗМЫ УСТОЙЧИВОСТИ К АНТИБАКТЕРИАЛЬНЫМ ПРЕПАРАТАМ ОТДЕЛЬНЫХ ГРУПП Макролиды, кетолиды и линкозамиды Модификация мишени действия. Основной мишенью
- 64. МЕХАНИЗМЫ УСТОЙЧИВОСТИ К АНТИБАКТЕРИАЛЬНЫМ ПРЕПАРАТАМ ОТДЕЛЬНЫХ ГРУПП Макролиды, кетолиды и линкозамиды Активное выведение. Активное выведение макролидов
- 65. МЕХАНИЗМЫ УСТОЙЧИВОСТИ К АНТИБАКТЕРИАЛЬНЫМ ПРЕПАРАТАМ ОТДЕЛЬНЫХ ГРУПП Тетрациклины Активное выведение. Этот механизм является наиболее распространенным среди
- 66. МЕХАНИЗМЫ УСТОЙЧИВОСТИ К АНТИБАКТЕРИАЛЬНЫМ ПРЕПАРАТАМ ОТДЕЛЬНЫХ ГРУПП Гликопептиды Модификация мишени действия. Механизм действия гликопептидов заключается в
- 67. МЕХАНИЗМЫ УСТОЙЧИВОСТИ К АНТИБАКТЕРИАЛЬНЫМ ПРЕПАРАТАМ ОТДЕЛЬНЫХ ГРУПП Сульфаниламиды и ко-тримоксазол СульфаниламидыСульфаниламиды и триметоприм блокируют различные этапы
- 68. МНОЖЕСТВЕННАЯ УСТОЙЧИВОСТЬ, СВЯЗАННАЯ СО СНИЖЕНИЕМ ПРОНИЦАЕМОСТИ Снижение проницаемости внешних структур бактериальной клетки является наименее специфичным механизмом
- 69. ОПРЕДЕЛЕНИЕ ЧУВСТВИТЕЛЬНОСТИ К АНТИБИОТИКАМ: МЕТОДЫ, РЕЗУЛЬТАТЫ, ОЦЕНКА В настоящее время в клинической практике существуют два принципа
- 70. Антибактериальные препараты. Методы определения чувствительности к ним
- 71. Этапы изучения антибиотиков : 1929г. – открытие пенициллина А.Флемингом 1940г. – Х.В. Чейн и Э.Б.Флори получили
- 72. По механизму действия 1. ингибиторы синтеза компонентов клеточной стенки ( пенициллины природные, полусинтетические, бета- лактамовые, потенцированные,
- 73. По типу действия на микробную клетку 1. бактерицидные препараты (бета-лактамы, аминогликозиды и др.) 2. бактериостатические препараты
- 74. По источнику получения 1. природные – продуцируемые микроорганизмами (пенициллины) 2. полусинтетические – получаемые в результате модификации
- 75. По химическому строению 1. β-лактамные антибиотики : - пенициллины (бензилпенициллин, оксациллин, ампициллин, азлоциллин); - цефалоспорины 4-х
- 76. Определение чувствительности микроорганизмов к антимикробным препаратам осуществляется для решения следующих задач: обоснование целенаправленной индивидуальной терапии для
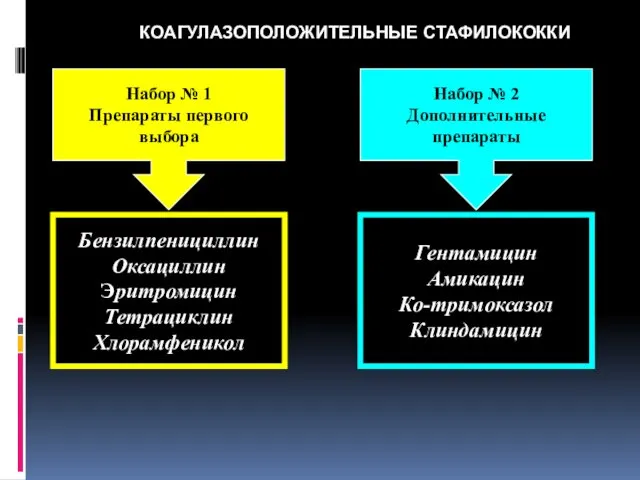
- 77. КОАГУЛАЗОПОЛОЖИТЕЛЬНЫЕ СТАФИЛОКОККИ Набор № 1 Препараты первого выбора Набор № 2 Дополнительные препараты Бензилпенициллин Оксациллин Эритромицин
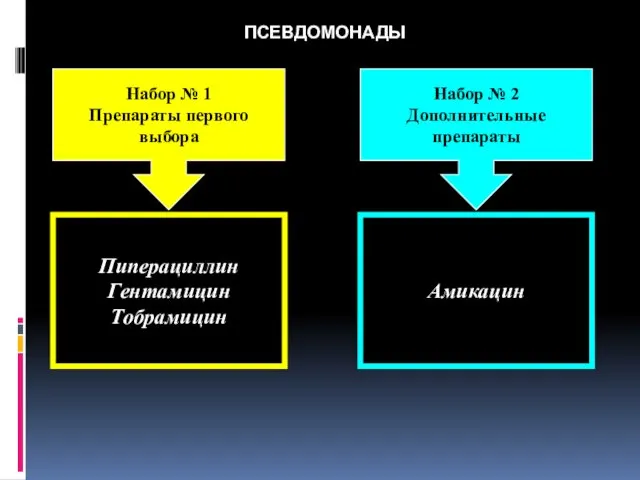
- 78. ПСЕВДОМОНАДЫ Набор № 1 Препараты первого выбора Набор № 2 Дополнительные препараты Пиперациллин Гентамицин Тобрамицин Амикацин
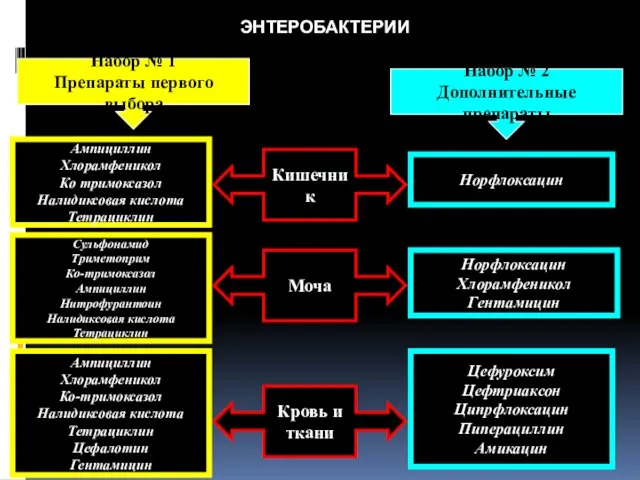
- 79. ЭНТЕРОБАКТЕРИИ Набор № 1 Препараты первого выбора Набор № 2 Дополнительные препараты Ампициллин Хлорамфеникол Ко тримоксазол
- 80. Чума Доксициклин Ципрфлоксацин ( офлоксацин, пефлоксацин) Стрептомицин Гентамицин Цефтриаксон ( цефотаксим) Рифампицин
- 81. Туляремия Рифампицин Ципрофлоксацин ( пефлоксацин) Стрептомицин Канамицин Гентамицин Доксициклин
- 82. Сибирская язва Ампициллин (бензилпенициллин) Ципрофлоксацин ( офлоксацин, пефлоксацин) Доксициклин Рифампицин Гентамицин
- 83. Холера Доксициклин Ципрофлоксацин ( офлоксацин, пефлоксацин) Сульфатон (сульфамонометаксим /триметоприм) Фуразолидон Хлорамфеникол Гентамицин Цефтриаксон (цефотаксим, цефтибутен) Рифампицин
- 84. Бруцеллез Ципрофлоксацин (офлоксацин, пефлоксацин) Рифампицин Доксициклин Гентамицин
- 85. Сап Ципрофлоксацин ( офлоксацин, пефлоксацин) Доксициклин Сульфаметаксозол/триметоприм Рифампицин
- 86. Мелиоидоз Пефлоксацин Доксициклин Сульфаметаксозол/триметоприм Рифампицин Хлорамфеникол
- 87. Главный показатель чувствительности - величина МИНИМАЛЬНОЙ ИНГИБИРУЮЩЕЙ КОНЦЕНТРАЦИИ* - МИК (мкг/мл), т.е минимальная концентрация АБП, задерживающая
- 88. Чувствительный - микроорганизм не имеет механизмов резистентности к данному антимикробному средству и при лечении стандартными дозами
- 89. Методы определения чувствительности к антибактериальным препаратам Методы серийных разведений - бульоне - в агаре - макроразведений
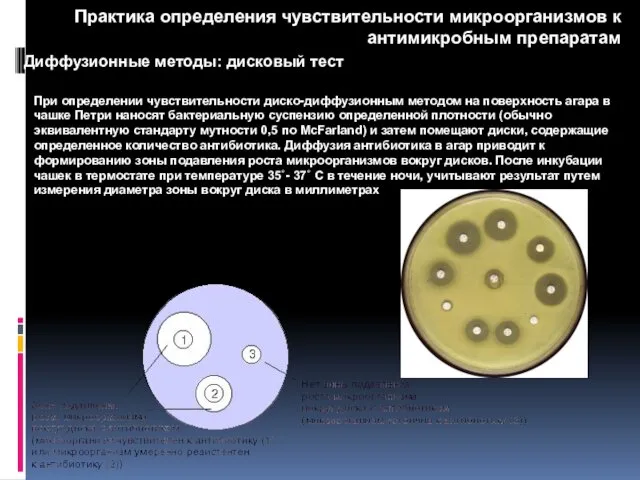
- 90. Диффузионные методы: дисковый тест При определении чувствительности диско-диффузионным методом на поверхность агара в чашке Петри наносят
- 91. Диффузионные методы: Е-тест Определение чувствительности микроорганизма с помощью Е-теста проводится аналогично тестированию диско-диффузионным методом. Отличие состоит
- 92. Методы разведения: Используют двукратные последовательные разведения концентраций антибиотика от максимальной к минимальной (например от 128 мкг/мл,
- 93. Методы разведения Минимальная подавляющая концентрация (МПК) - наименьшая концентрация антибиотика (мг/л или мкг/мл), которая in vitro
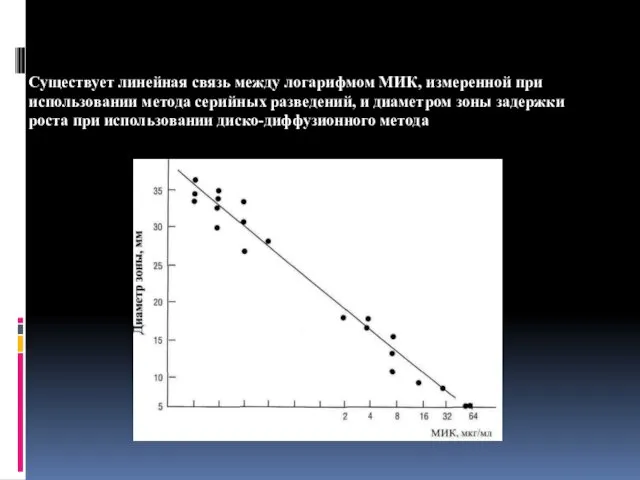
- 94. Практика определения чувствительности микроорганизмов к антимикробным препаратам Существует линейная связь между логарифмом МИК, измеренной при использовании
- 95. Использование диспенсеров
- 96. Использование октодисков 1 3 4 2
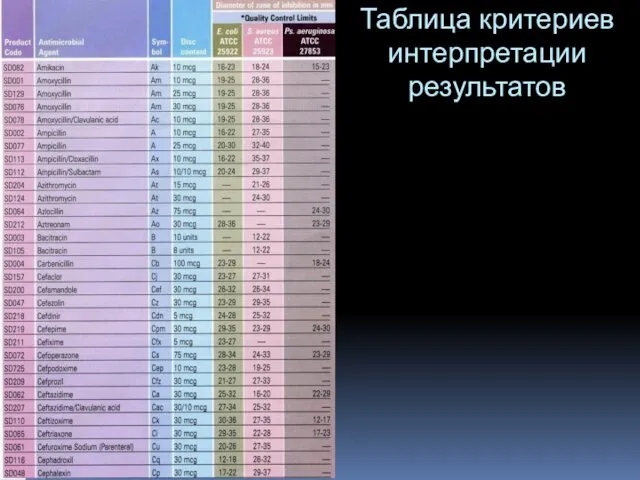
- 97. Таблица критериев интерпретации результатов
- 98. Обязательные правила при постановке тестов на чувствительность к антибиотикам: использовать диски стандартного размера ( 6,35 мм);
- 99. Стандартные штаммы для контроля качества: Staphylococcus aureus (АТСС 25923) Escherichia coli (АТСС 25922) Pseudomonas aeruginoza (АТСС
- 100. Практика определения чувствительности микроорганизмов к антимикробным препаратам Метод пограничных концентраций можно считать усеченным методом серийных разведении.
- 101. Практика определения чувствительности микроорганизмов к антимикробным препаратам Оригинальный диско-диффузионный метод, описанный в 1966 г., хорошо стандартизован
- 102. Практика определения чувствительности микроорганизмов к антимикробным препаратам В повседневной лабораторной практике нет надобности выполнять тесты на
- 103. Практика определения чувствительности микроорганизмов к антимикробным препаратам Антимикробные средства для первичного и дополнительного тестирования в зависимости
- 104. Автоматический анализатор антибиотикочувствительности "Osiris" (BioRad)
- 105. Система идентификации микроорганизмов МикроТакс
- 106. ГЕНЕТИКА И МОЛЕКУЛЯРНАЯ ЭПИДЕМИОЛОГИЯ МНОЖЕСТВЕННОЙ АНТИБИОТИКОРЕЗИСТЕНТНОСТИ ВОЗБУДИТЕЛЕЙ ООИ
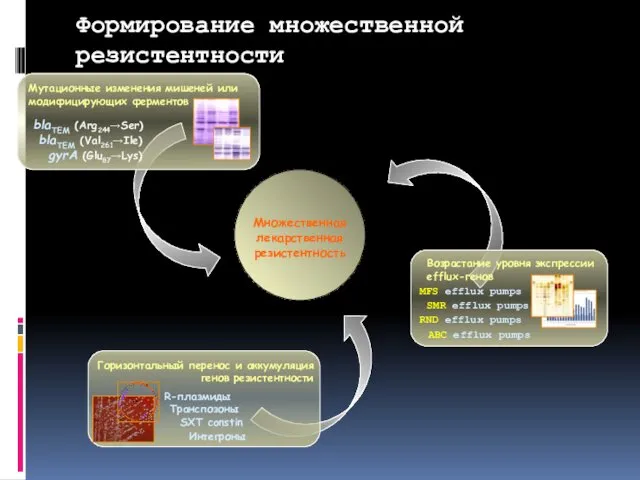
- 107. Формирование множественной резистентности Мутационные изменения мишеней или модифицирующих ферментов Горизонтальный перенос и аккумуляция генов резистентности Возрастание
- 108. Хромосомные гены резистентности Y.pestis NC_005810 4,595,065 bp 4095 генов Генов резистентности - 103
- 109. Резистентностные штаммы Yersinia pestis Y. pestis 17/95 Y. pestis 16/95 Клинический изолят pFra pPla pYV pIP1202
- 111. Хромосомные гены резистентности V.cholerae NC_002505 2,961,149 bp 2860 генов NC_002506 1,072,315 bp 1097 генов Генов резистентности
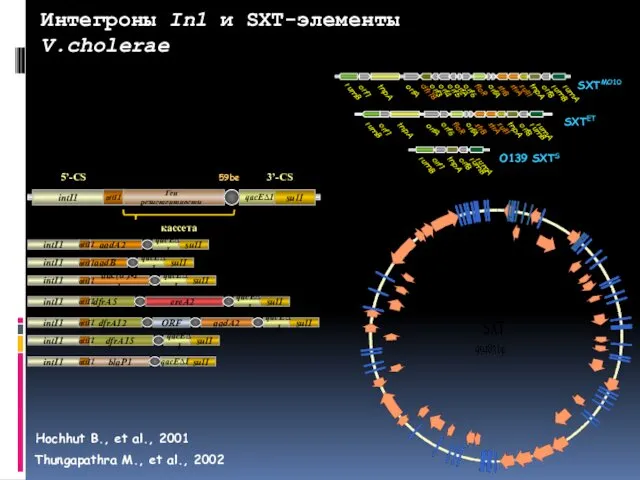
- 113. Интегроны In1 и SXT-элементы V.cholerae Thungapathra M., et al., 2002 Hochhut B., et al., 2001
- 115. RIF - рифампицин, POL - полимиксин, STR - стрептомицин, AMP - ампициллин, OXA - оксациллин, PIP
- 116. Секвенирование и картирование последовательности In1 Vibrio cholerae В-193
- 117. Хромосомные гены резистентности B.pseudomallei NC_00650 4,074,542 bp 3537 генов Генов резистентности - 94 NC_006351 3,173,005 bp
- 118. Хромосомные гены резистентности B.mallei NC_006351 2,325,379 bp 1800 генов Генов резистентности - 51 NC_00650 3,510,148 bp
- 119. Изучение молекулярно-генетических механизмов полирезистентности видов Burkholderia Дифференциальный дисплей мРНК Анализ аллельного полиморфизма отдельных R-детерминант
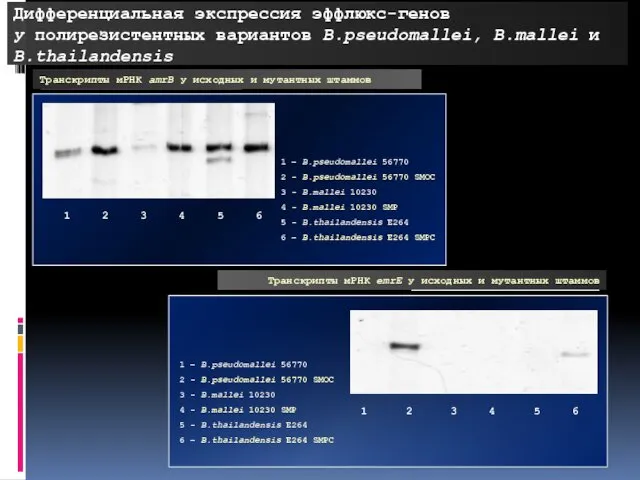
- 120. Дифференциальная экспрессия эффлюкс-генов у полирезистентных вариантов B.pseudomallei, B.mallei и B.thailandensis Транскрипты мРНК amrB у исходных и
- 122. Скачать презентацию

































































































 Особенности заполнения специализированной отчетной формы №7 (онкология сводная)
Особенности заполнения специализированной отчетной формы №7 (онкология сводная) Лечебная физкультура при суставной патологии
Лечебная физкультура при суставной патологии Гепатопульмональный синдром
Гепатопульмональный синдром Jaundice
Jaundice Объективное исследование больного
Объективное исследование больного Терминальные состояния. Принципы реанимации. Постреанимационная болезнь. Методы интенсивной терапии
Терминальные состояния. Принципы реанимации. Постреанимационная болезнь. Методы интенсивной терапии Микробиологическая диагностика холеры
Микробиологическая диагностика холеры Ювенильный артрит
Ювенильный артрит Первичное интервью по Волкану: за и против
Первичное интервью по Волкану: за и против Виды действия ЛС по характеру воздействия на организм
Виды действия ЛС по характеру воздействия на организм Диагностика и лечение гипотиреоза во время беременности
Диагностика и лечение гипотиреоза во время беременности Отравление. Симптомы
Отравление. Симптомы Ботулизм
Ботулизм Инструментальные методы исследования
Инструментальные методы исследования Беременность и острая хирургическая патология
Беременность и острая хирургическая патология Созылмалы жүрек жетіспеушілігі
Созылмалы жүрек жетіспеушілігі Амеба и плазмодий
Амеба и плазмодий Методы регистрации электрической активности головного мозга человека
Методы регистрации электрической активности головного мозга человека Диагностика болезни Паркинсона и паркинсонизма
Диагностика болезни Паркинсона и паркинсонизма Гострий коронарний синдром
Гострий коронарний синдром Новые оригинальные препараты в арсенале успешного фармацевта
Новые оригинальные препараты в арсенале успешного фармацевта Патология липидного обмена
Патология липидного обмена Постваготомическая диарея
Постваготомическая диарея Вопросы биоэтики в фармакоэкономике и фармакотерапии с позиции безопасности пациента
Вопросы биоэтики в фармакоэкономике и фармакотерапии с позиции безопасности пациента Cовременные представления о смазанном слое и гибридной зоне. Адгезия
Cовременные представления о смазанном слое и гибридной зоне. Адгезия Группа резко выраженной деменции
Группа резко выраженной деменции Частная психопатология
Частная психопатология Современная концепция досуга
Современная концепция досуга