Содержание
- 2. Диск Эри и проблема разрешения
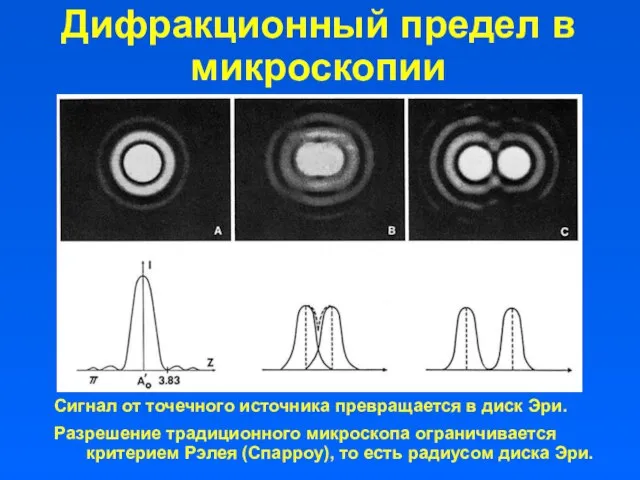
- 3. Дифракционный предел в микроскопии Сигнал от точечного источника превращается в диск Эри. Разрешение традиционного микроскопа ограничивается
- 4. Увеличение разрешающей способности флуоресцентной микроскопии Возбуждение субдифракционного объема STED – stimulated emission depletion RESOLFT – resolution
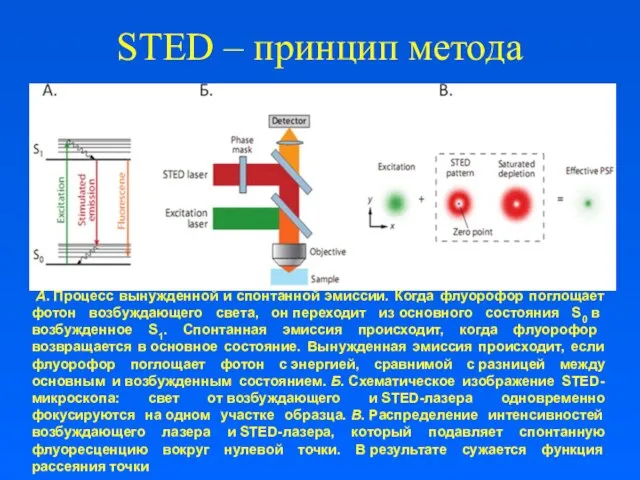
- 5. А. Процесс вынужденной и спонтанной эмиссии. Когда флуорофор поглощает фотон возбуждающего света, он переходит из основного
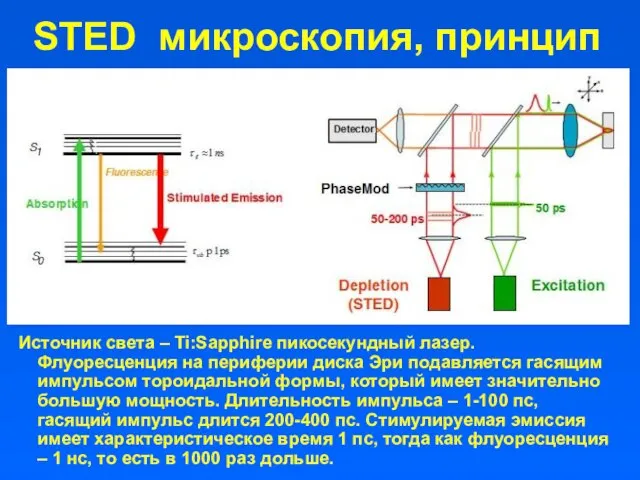
- 6. STED микроскопия, принцип Источник света – Ti:Sapphire пикосекундный лазер. Флуоресценция на периферии диска Эри подавляется гасящим
- 7. STED микроскопия Возбуждение осуществляется с помощью пикосекундного лазерного импульса, который настроен на максимум поглощения красителя, и
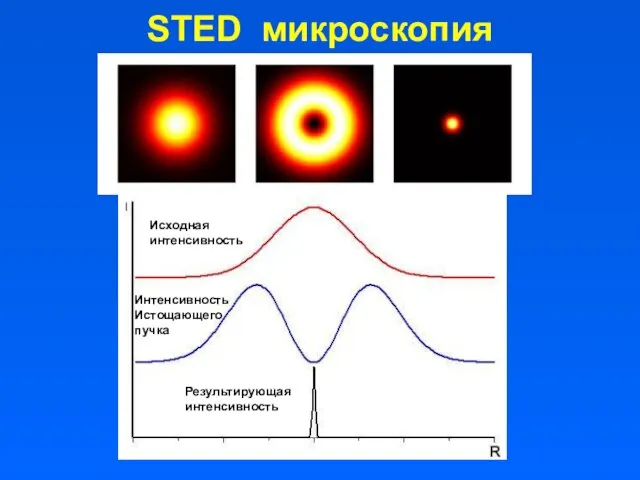
- 8. STED микроскопия Исходная интенсивность Интенсивность Истощающего пучка Результирующая интенсивность
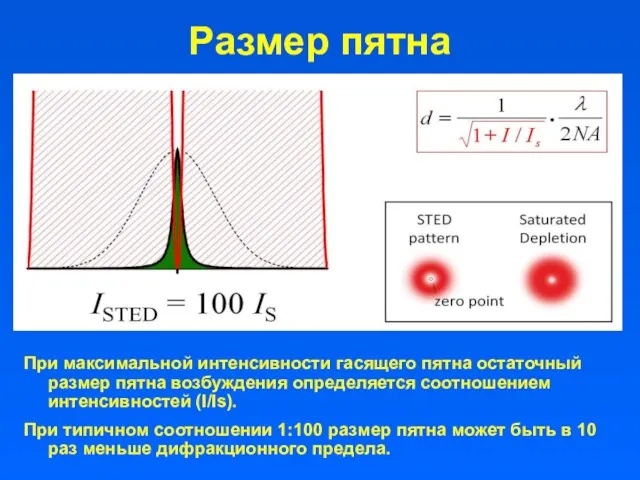
- 9. Размер пятна При максимальной интенсивности гасящего пятна остаточный размер пятна возбуждения определяется соотношением интенсивностей (I/Is). При
- 10. STED микроскопия – вид перетяжки
- 11. Микротрубочки Конфокальный микроскоп STED
- 12. Разрешающая способность в режиме STED Imax – мощность гасящего импульса; Is – мощность возбуждающего импульса
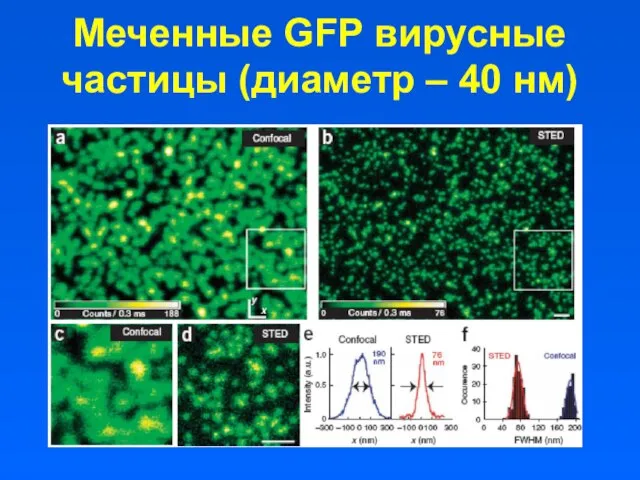
- 13. Меченные GFP вирусные частицы (диаметр – 40 нм)
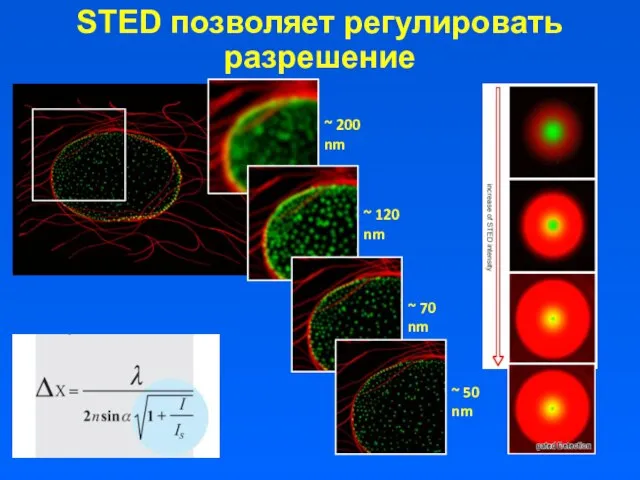
- 14. STED позволяет регулировать разрешение
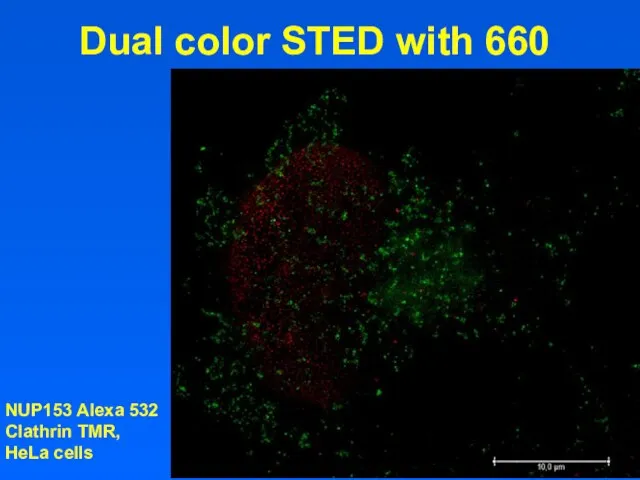
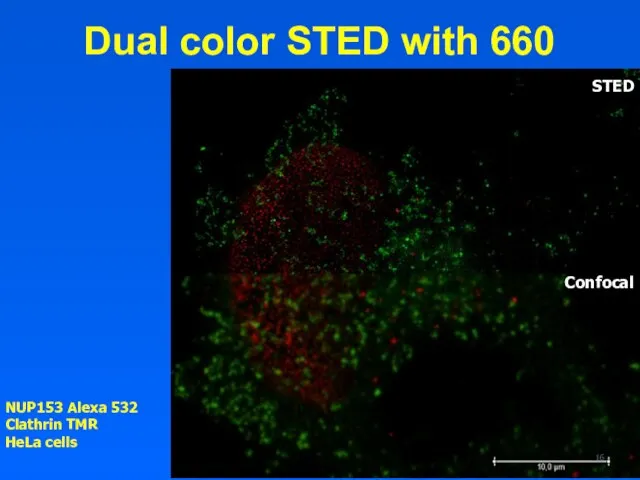
- 15. Dual color STED with 660 NUP153 Alexa 532 Clathrin TMR, HeLa cells
- 16. Dual color STED with 660 NUP153 Alexa 532 Clathrin TMR HeLa cells STED Confocal
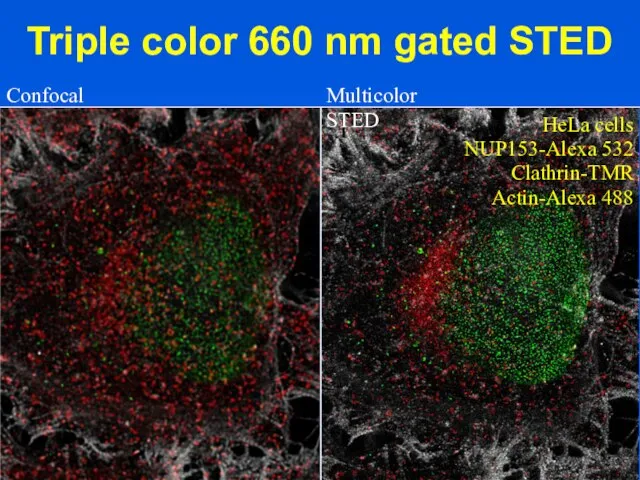
- 17. Triple color 660 nm gated STED Confocal Please enter the titel here l Multicolor STED HeLa
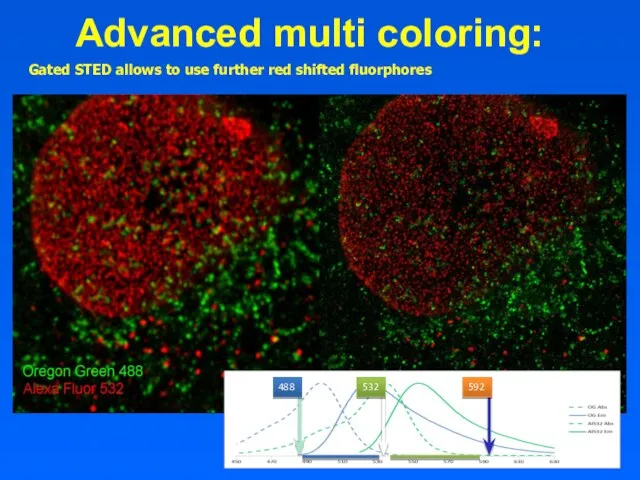
- 18. Advanced multi coloring: Gated STED allows to use further red shifted fluorphores
- 19. Объектив для STED HC PL APO 100x/1.40 OIL STED WHITE Based on the Leica CS2 objective
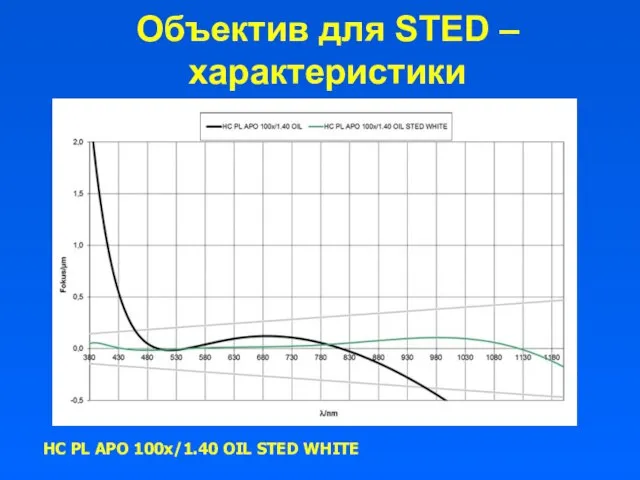
- 20. Объектив для STED – характеристики HC PL APO 100x/1.40 OIL STED WHITE
- 21. Регулируемая область возбуждения Расчетный вид перетяжки при различных настройках обжимающего пучка. Слева – стандартная перетяжка для
- 22. STED – ограничения Малый шаг (около 20 нм) – следовательно большое время сканирования поля зрения. Для
- 23. Reversible saturable optical fluorescence transitions (RESOLFT) superresolution microscopy
- 24. Микроскопия суперразрешения - RESOLFT Решетка для «тормозящего» освещения имеет максимумы и минимумы. Эффективная флуоресценция достигается в
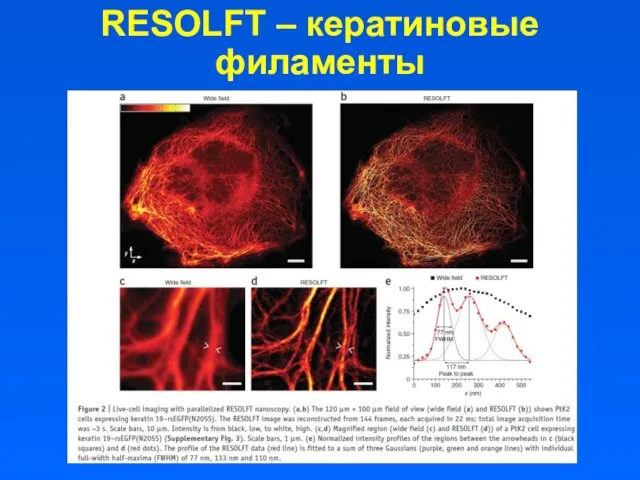
- 25. RESOLFT – кератиновые филаменты
- 26. Микроскопия суперразрешения - RESOLFT Оценка возможностей метода: Шаг сканирования – от 25 до 40 нм. Время
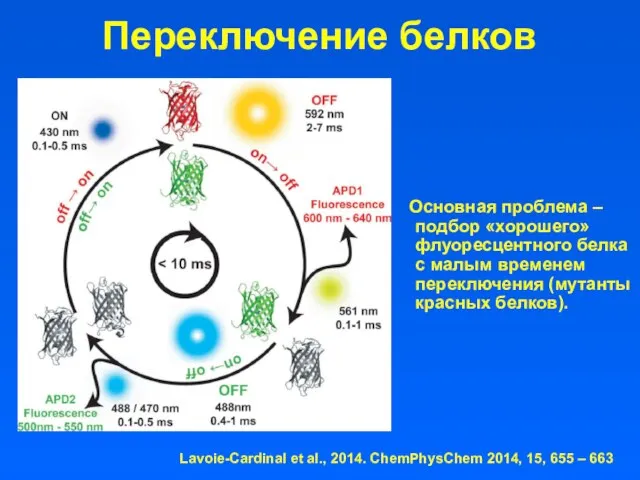
- 27. Переключение белков Основная проблема – подбор «хорошего» флуоресцентного белка с малым временем переключения (мутанты красных белков).
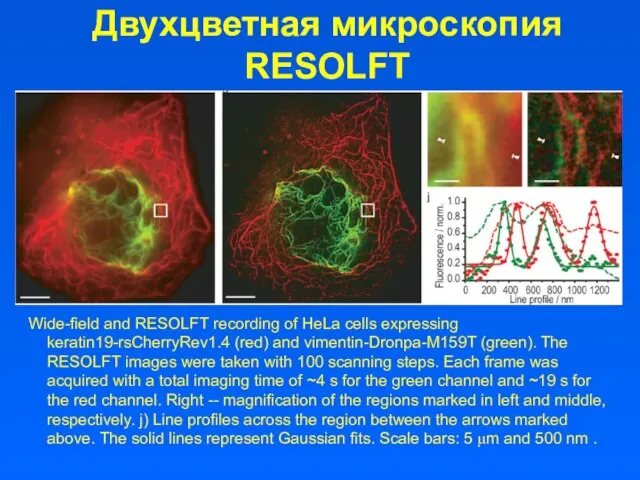
- 28. Двухцветная микроскопия RESOLFT Wide-field and RESOLFT recording of HeLa cells expressing keratin19-rsCherryRev1.4 (red) and vimentin-Dronpa-M159T (green).
- 29. Приближение к дифракционному пределу в цифровой микроскопии 1. Сканирование с малым шагом в конфокальной микроскопии (менее
- 30. Структурированное освещение – SIM Structured illumination microscopy – разрешение увеличивается за счет компьютерного анализа муарового рисунка,
- 31. Микроскопия структурированного освещения. На трех исходных изображениях (A—C) видно, что при перемещении решетки (обозначено черной линией)
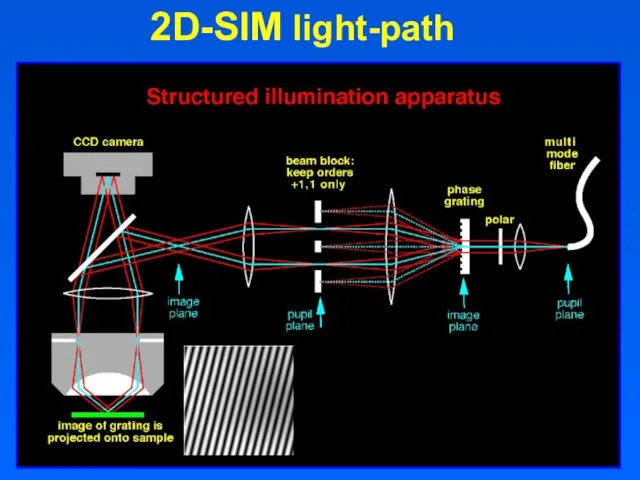
- 32. November 20, 2018 2D-SIM light-path
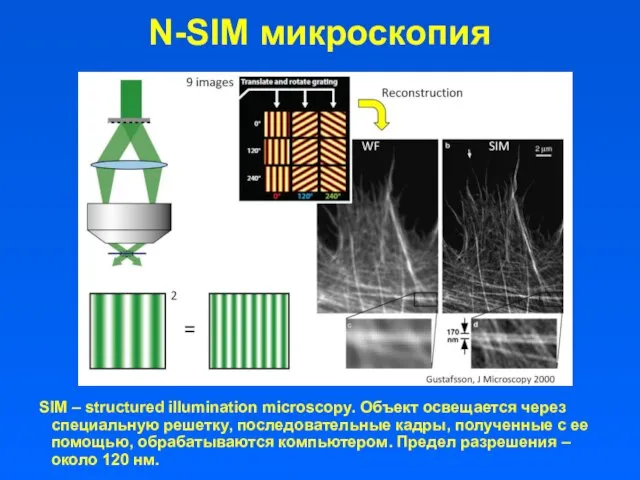
- 33. N-SIM микроскопия SIM – structured illumination microscopy. Объект освещается через специальную решетку, последовательные кадры, полученные с
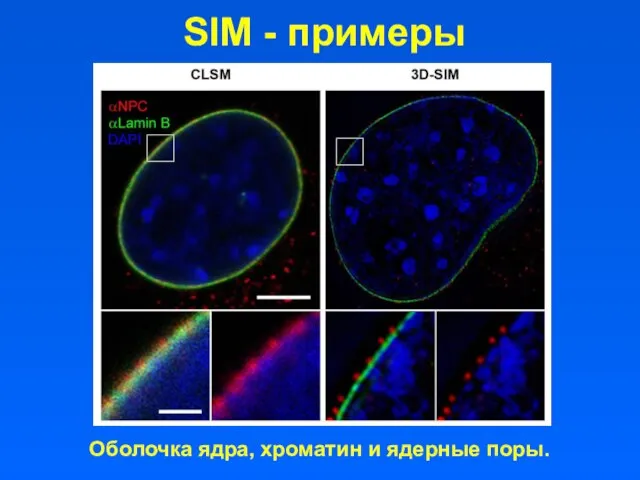
- 34. SIM - примеры Оболочка ядра, хроматин и ядерные поры.
- 35. 3D-SIM Профазное ядро в различных проекциях. Хроматин (красный) и ядерные поры.
- 36. Преодоление дифракционного предела в микроскопии 1. Восстановление центров дисков Эри (центроидов) на множестве кадров (~30000) при
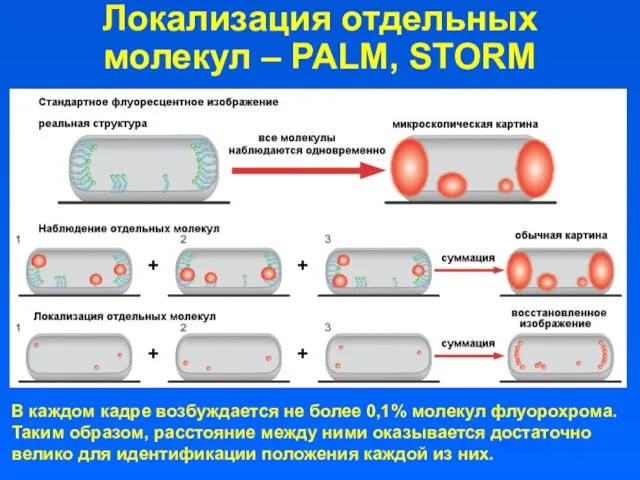
- 37. Локализация отдельных молекул – PALM, STORM В каждом кадре возбуждается не более 0,1% молекул флуорохрома. Таким
- 38. Преодоление дифракицонного предела в микроскопии 1. Детекция сигнала от отдельных флуоресцирующих молекул – равномерная флуоресценция, которая
- 39. Локализация точечного источника света в микроскопии Вычисление положения центроида позволяет «преодолеть» дифракционный предел. Точность расчетов определяется
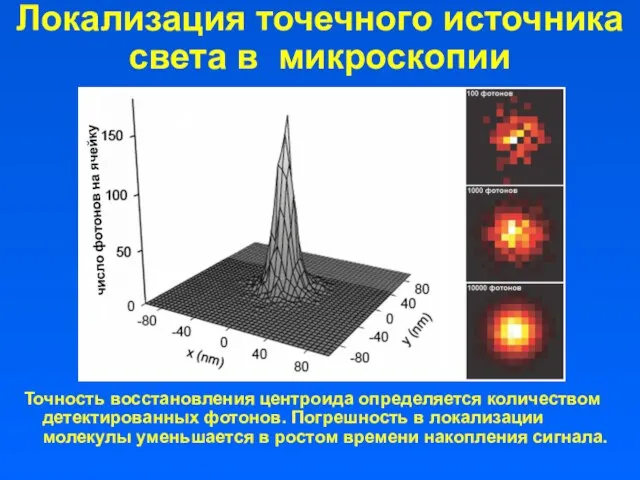
- 40. Локализация точечного источника света в микроскопии Точность восстановления центроида определяется количеством детектированных фотонов. Погрешность в локализации
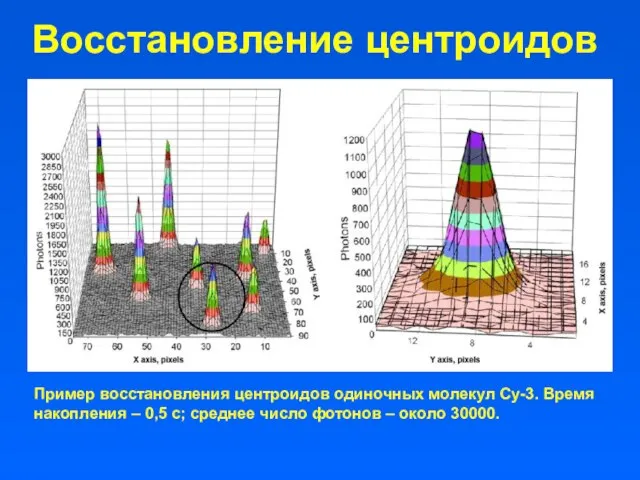
- 41. Восстановление центроидов Пример восстановления центроидов одиночных молекул Су-3. Время накопления – 0,5 с; среднее число фотонов
- 42. Разрешение в STORM Точность определения позиции центроида (аппроксимрованного двумерным Гауссовым распределением) – стандартное отклонение для гауссианы:
- 43. Xiaowei Zhuang Howard Hughes Medical Institute Investigator Professor of Chemistry and Chemical Biology, Professor of Physics
- 44. STORM микроскопия Два лазера (зеленый/красный) и сближенные красители (Су-3/Су-5) – длительность флуоресценции регулируется переключением молекулы Су-5.
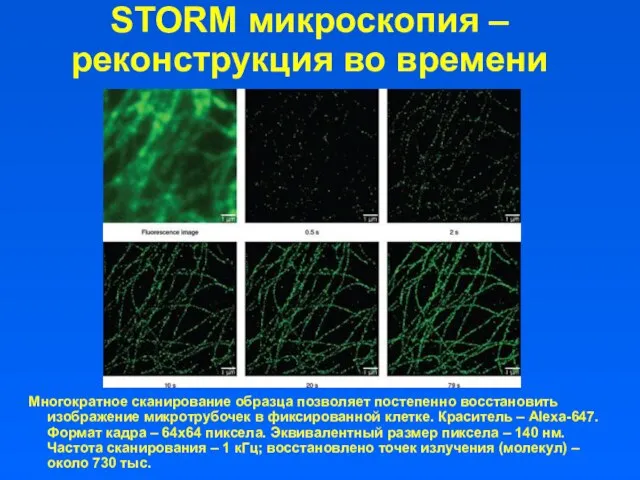
- 45. STORM микроскопия –реконструкция во времени Многократное сканирование образца позволяет постепенно восстановить изображение микротрубочек в фиксированной клетке.
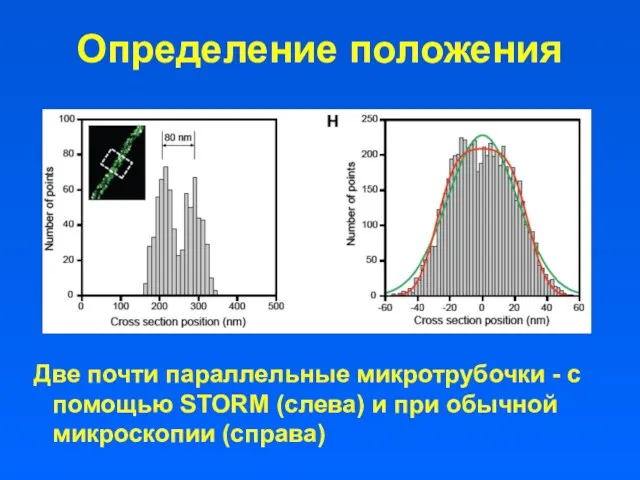
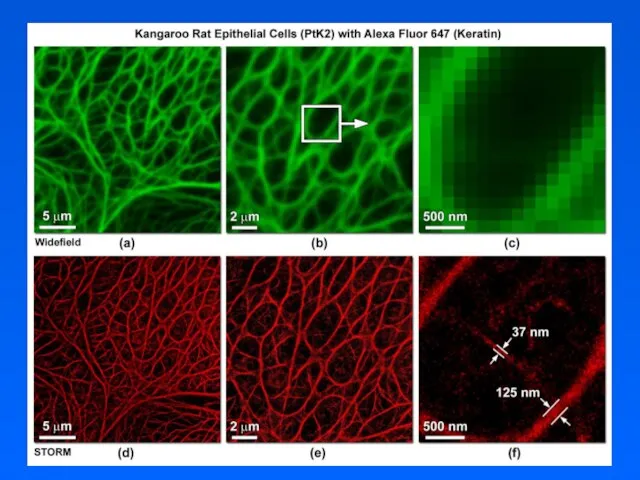
- 46. Определение положения Две почти параллельные микротрубочки - с помощью STORM (слева) и при обычной микроскопии (справа)
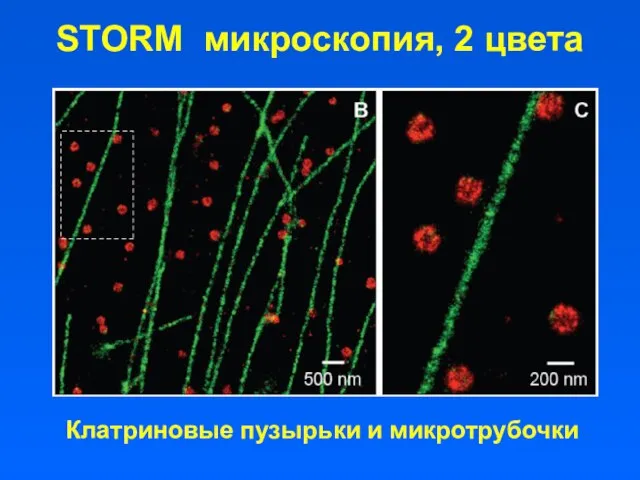
- 49. STORM микроскопия, 2 цвета Клатриновые пузырьки и микротрубочки
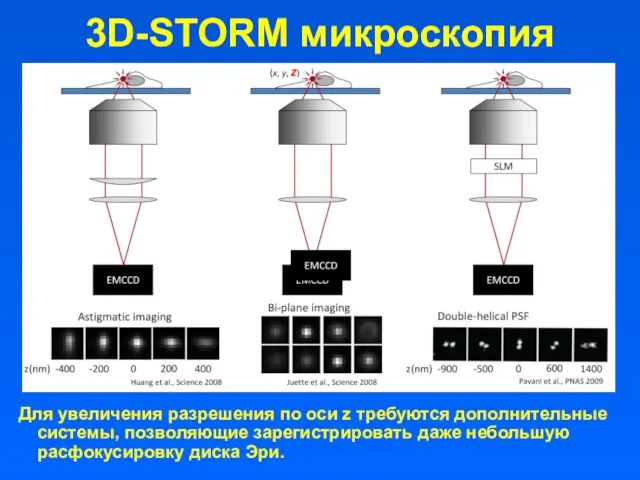
- 50. 3D-STORM микроскопия Для увеличения разрешения по оси z требуются дополнительные системы, позволяющие зарегистрировать даже небольшую расфокусировку
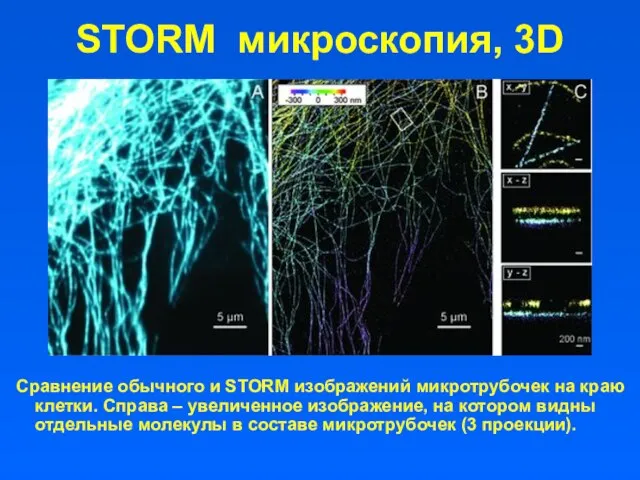
- 52. STORM микроскопия, 3D Сравнение обычного и STORM изображений микротрубочек на краю клетки. Справа – увеличенное изображение,
- 53. 3D-STORM микроскопия Использование двух объективов позволяет повысить разрешение в плоскости x-y до 10 нм, а по
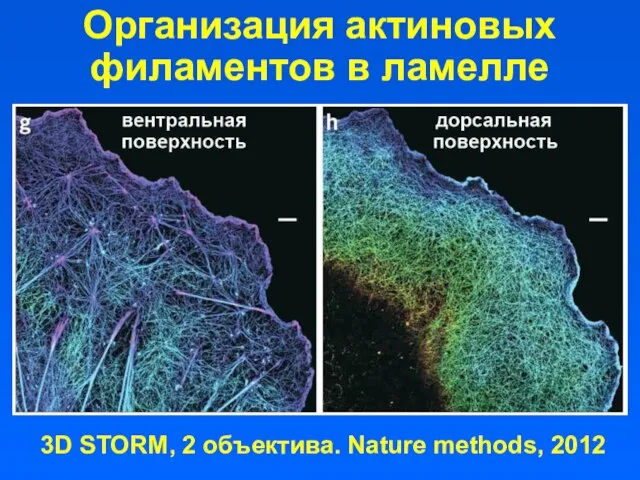
- 54. Организация актиновых филаментов в ламелле 3D STORM, 2 объектива. Nature methods, 2012
- 55. PALM микроскопия PALM – photoactivated localization microscopy. Изображение складывается из нескольких тысяч последовательных кадров, в каждом
- 56. PALM микроскопия PALM – photoactivated localization microscopy. Наиболее эффективное применение метода – с использованием фотоактивируемых флуоресцентных
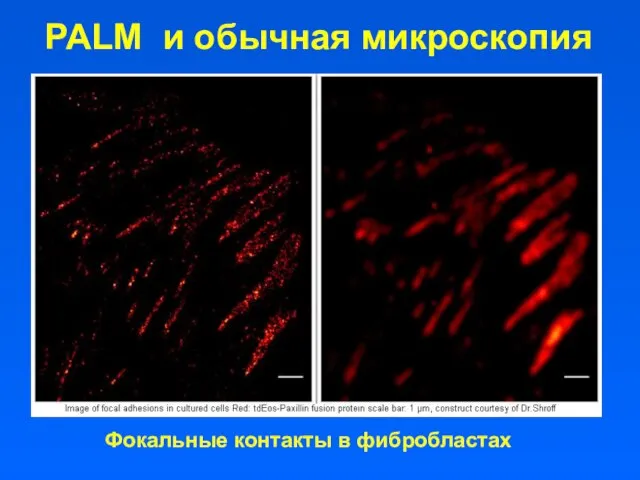
- 57. PALM и обычная микроскопия Фокальные контакты в фибробластах
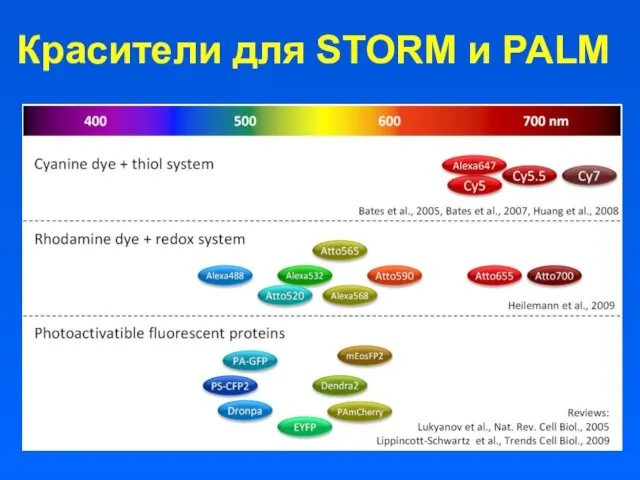
- 58. Красители для STORM и PALM
- 59. PALM versus STORM Два метода фундаментально схожи, так как основаны на общем принципе – восстановлении положения
- 61. Скачать презентацию



























 Классификация оториноларингологических инструментов
Классификация оториноларингологических инструментов Демодекоз. Цикл развития Demodex Canis
Демодекоз. Цикл развития Demodex Canis Острые кишечные инфекции
Острые кишечные инфекции Остеосаркома в детском возрасте
Остеосаркома в детском возрасте Хирургиядағы ақпаратты-компьютерлік технологиялар телемедицинасы
Хирургиядағы ақпаратты-компьютерлік технологиялар телемедицинасы Асқазан жəне ұлтабар ойық жара ауруы
Асқазан жəне ұлтабар ойық жара ауруы Кора головного мозга. Высшие мозговые функции и их расстройства
Кора головного мозга. Высшие мозговые функции и их расстройства Аллергиялық жағдайлар. Созылмалы рецидивті афтозды стоматит, көп түрлі талшықты эритема. Этиологиясы, патогенезі клиникасы
Аллергиялық жағдайлар. Созылмалы рецидивті афтозды стоматит, көп түрлі талшықты эритема. Этиологиясы, патогенезі клиникасы Рентгенологические методы диагностики в стоматологии
Рентгенологические методы диагностики в стоматологии Уход за больными с повреждениями позвоночника, спинного мозга, таза
Уход за больными с повреждениями позвоночника, спинного мозга, таза Методика Масару Ибука
Методика Масару Ибука Органы иммунитета и кроветворения или медуло-тимо-лимфатическая система
Органы иммунитета и кроветворения или медуло-тимо-лимфатическая система Догляд за хворими онкозахворюваннями
Догляд за хворими онкозахворюваннями Вводная в дебаты. Регламент
Вводная в дебаты. Регламент Аборты, их виды и последствия
Аборты, их виды и последствия Микрофлора влагалища
Микрофлора влагалища Променеві методи діагностики захворювань щитовидної залози
Променеві методи діагностики захворювань щитовидної залози Фолликулит собак
Фолликулит собак Гормондар биохимиясы. Гормондар және бейімділік процестер
Гормондар биохимиясы. Гормондар және бейімділік процестер Жүректің қақпақшаларының ақаулары
Жүректің қақпақшаларының ақаулары Методы обследования гинекологических больных. Общая симптоматика гинекологических заболеваний
Методы обследования гинекологических больных. Общая симптоматика гинекологических заболеваний Эмпирические методы исследования личности (часть 2)
Эмпирические методы исследования личности (часть 2) Классификация нарушений речи
Классификация нарушений речи Вирусные заболевания
Вирусные заболевания Гриппомикс
Гриппомикс Медицинские ошибки и риск-менеджмент в больнице
Медицинские ошибки и риск-менеджмент в больнице Проблема виникнення і розв’язання конфліктів у сім’ї
Проблема виникнення і розв’язання конфліктів у сім’ї Бета-адреноблокаторы
Бета-адреноблокаторы