Содержание
- 2. МЫ ОКРУЖЕНЫ ПАТОГЕНАМИ! Патогены – микроорганизмы, которые могут вызвать заболевание или разрушить ткани человека и животных.
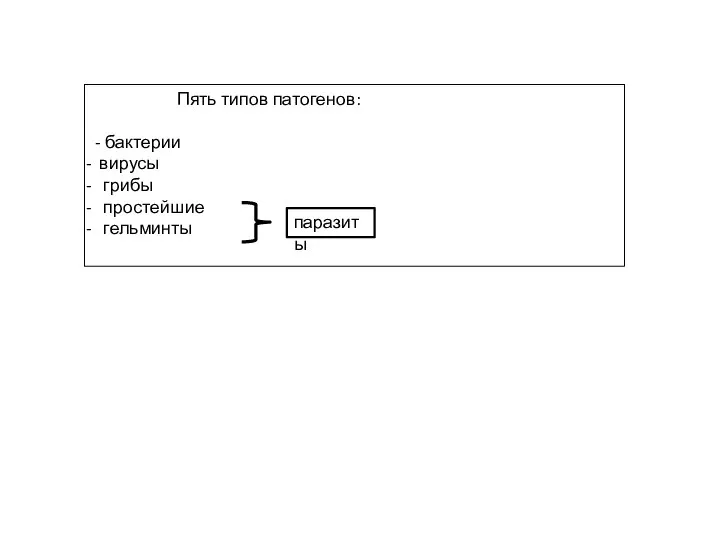
- 3. Пять типов патогенов: - бактерии вирусы грибы простейшие гельминты паразиты
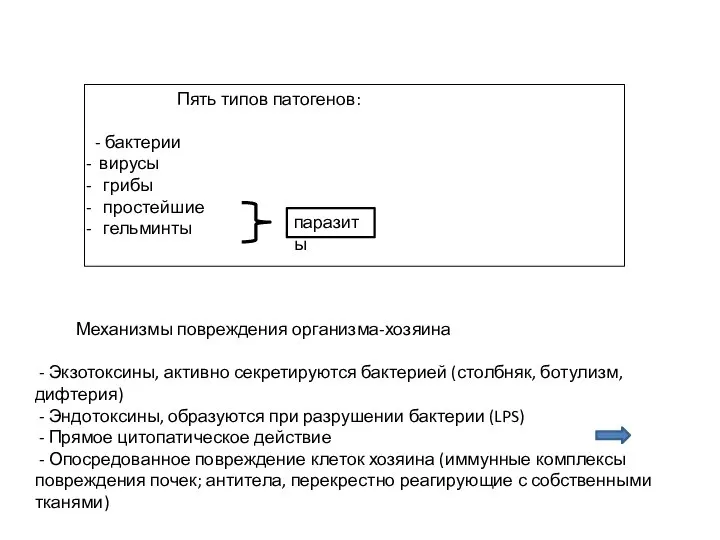
- 4. Пять типов патогенов: - бактерии вирусы грибы простейшие гельминты паразиты Механизмы повреждения организма-хозяина - Экзотоксины, активно
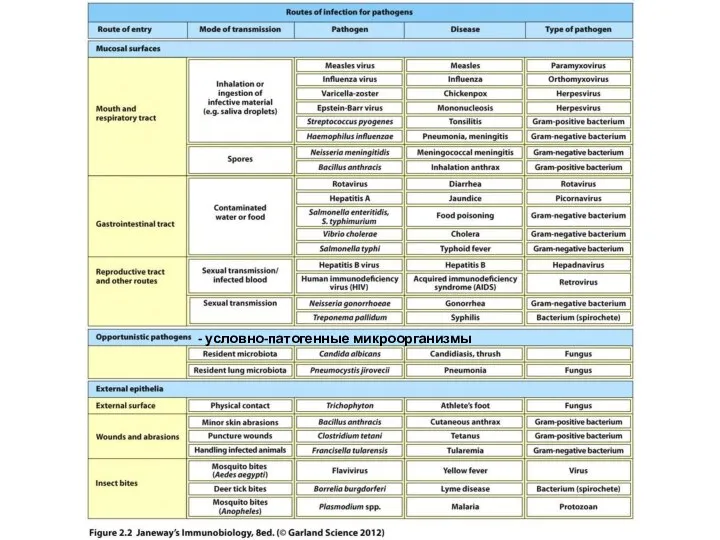
- 5. - условно-патогенные микроорганизмы
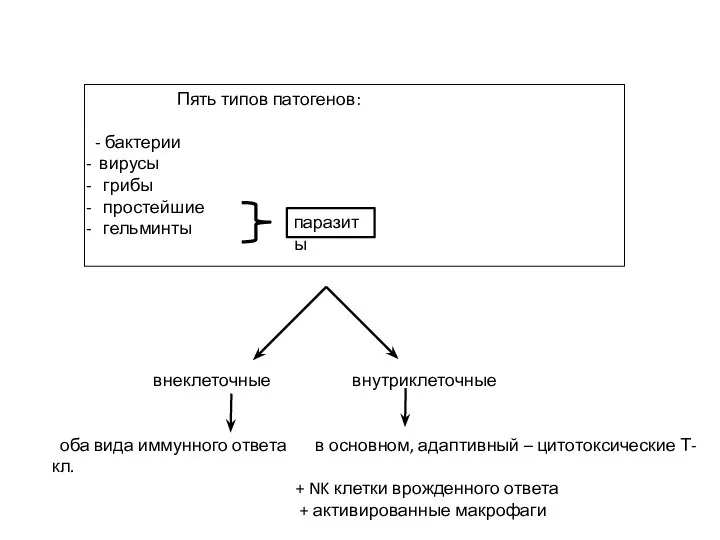
- 6. Пять типов патогенов: - бактерии вирусы грибы простейшие гельминты паразиты внеклеточные внутриклеточные оба вида иммунного ответа
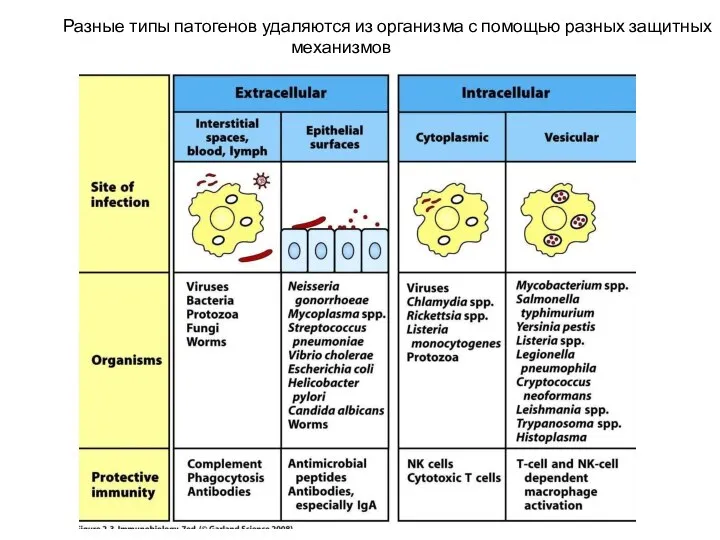
- 7. Разные типы патогенов удаляются из организма с помощью разных защитных механизмов
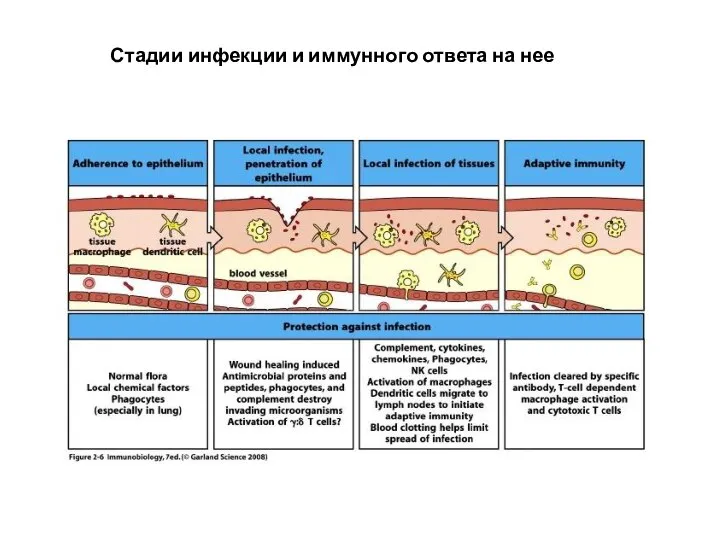
- 8. Стадии инфекции и иммунного ответа на нее
- 9. Врожденный иммунитет – первая линия защиты организма от инфекций. Врожденные механизмы, в отличие от приобретенных, начинают
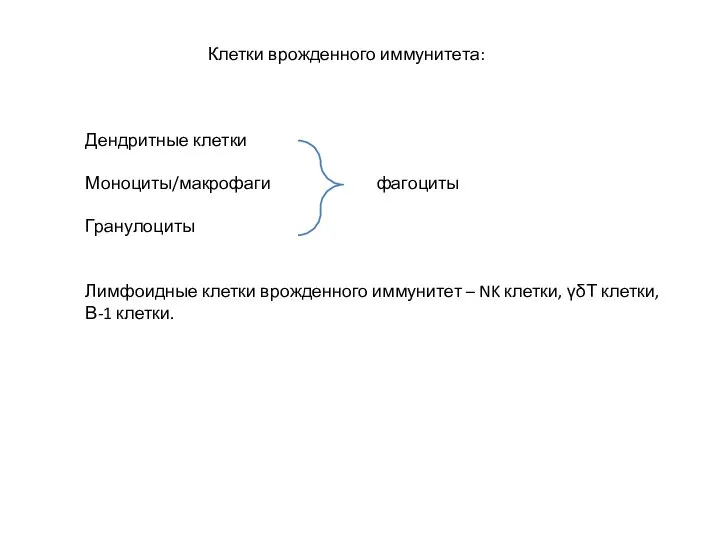
- 10. Клетки врожденного иммунитета: Дендритные клетки Моноциты/макрофаги фагоциты Гранулоциты Лимфоидные клетки врожденного иммунитет – NK клетки, γδТ
- 11. ЭПИТЕЛИАЛЬНАЯ ТКАНЬ – ПЕРВЫЙ БАРЬЕР НА ПУТИ ПАТОГЕНОВ Кожа + Слизистый эпителий (дыхательные пути, желудочно-кишечный тракт,
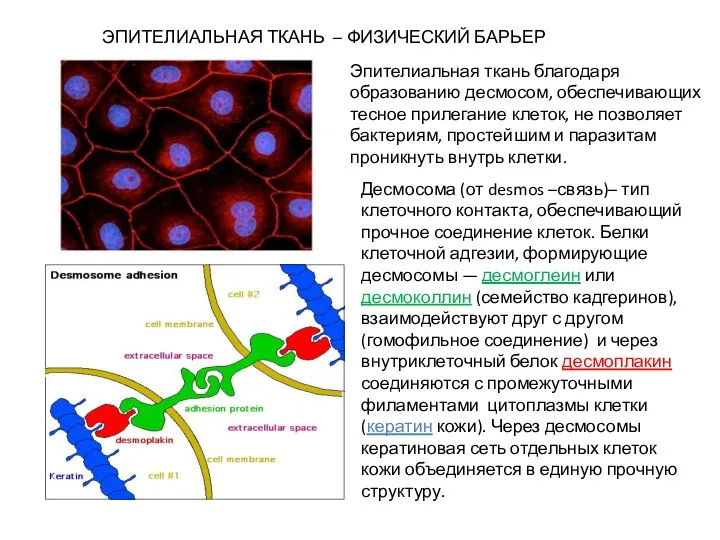
- 12. ЭПИТЕЛИАЛЬНАЯ ТКАНЬ – ФИЗИЧЕСКИЙ БАРЬЕР Эпителиальная ткань благодаря образованию десмосом, обеспечивающих тесное прилегание клеток, не позволяет
- 13. Аутоантитела к десмоглеину Заболевание «пемфигус» или «пузырчатка» – нарушение целостности кожи, инфицирование ран прогноз неблагоприятный
- 14. ЭПИТЕЛИАЛЬНАЯ ТКАНЬ – ФИЗИЧЕСКИЙ БАРЬЕР Кожа – сухая, наиболее труднопреодолимый эпителиальный барьер. Эпителий слизистых оболочек (слизистый
- 15. ЭПИТЕЛИАЛЬНАЯ ТКАНЬ – МИКРОБИОЛОГИЧЕСКИЙ БАРЬЕР Нормальная флора эпителиальных поверхностей (микробиота): конкурирует с патогенной флорой за пищу
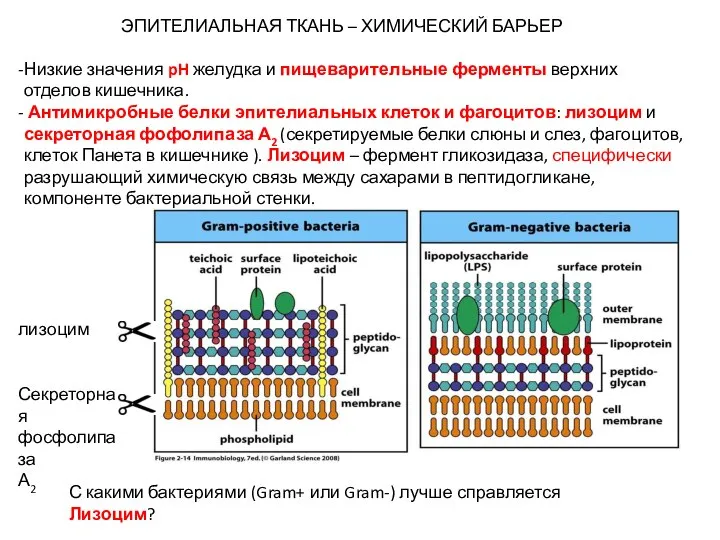
- 16. ЭПИТЕЛИАЛЬНАЯ ТКАНЬ – ХИМИЧЕСКИЙ БАРЬЕР Низкие значения pH желудка и пищеварительные ферменты верхних отделов кишечника. Антимикробные
- 17. Секреторная фосфолипаза А2 Фермент, гидролизует фосфолипиды клеточной мембраны бактерий.
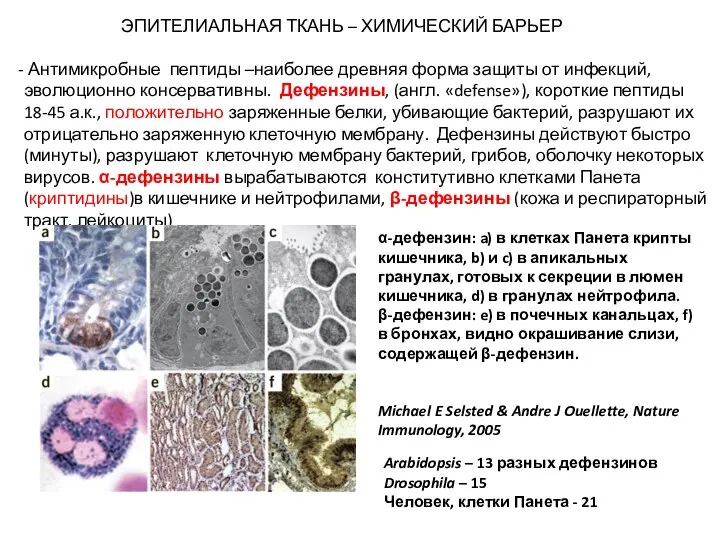
- 18. ЭПИТЕЛИАЛЬНАЯ ТКАНЬ – ХИМИЧЕСКИЙ БАРЬЕР Антимикробные пептиды –наиболее древняя форма защиты от инфекций, эволюционно консервативны. Дефензины,
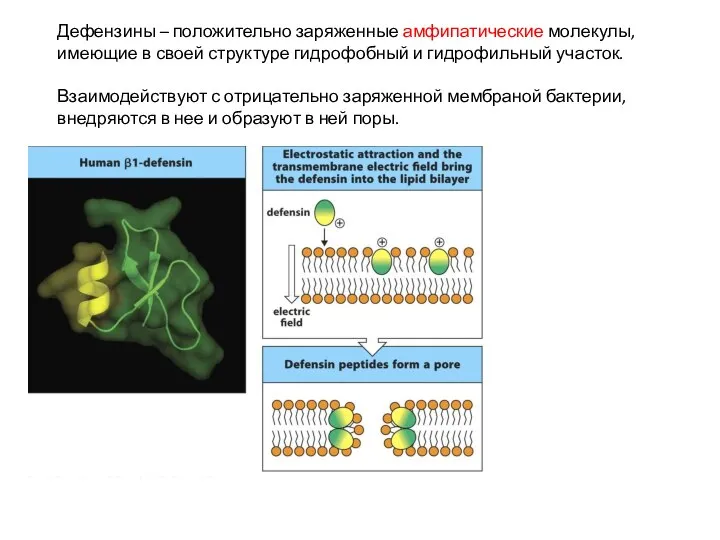
- 19. Дефензины – положительно заряженные амфипатические молекулы, имеющие в своей структуре гидрофобный и гидрофильный участок. Взаимодействуют с
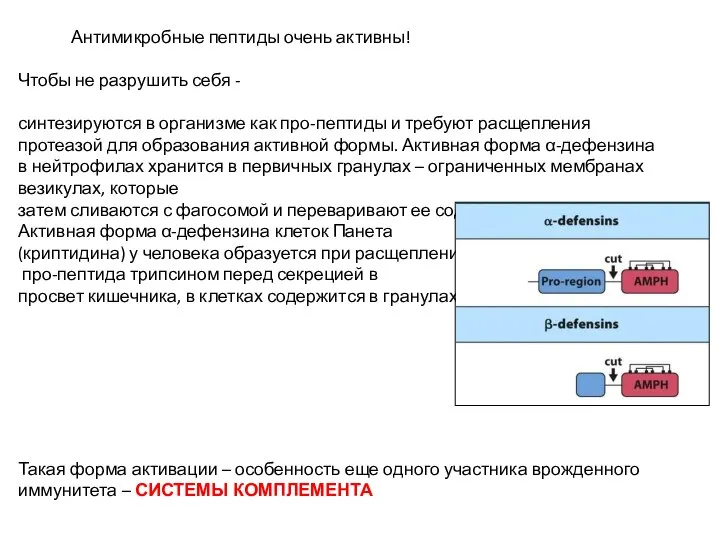
- 20. Антимикробные пептиды очень активны! Чтобы не разрушить себя - синтезируются в организме как про-пептиды и требуют
- 21. Дефензины не только сами убивают микробы, но и участвуют в регуляции воспаления и стимуляции клеток адаптивного
- 22. Если микроорганизм все-таки пересек границу – эпителий, что происходит? - После прохождения эпителиального барьера многие патогены
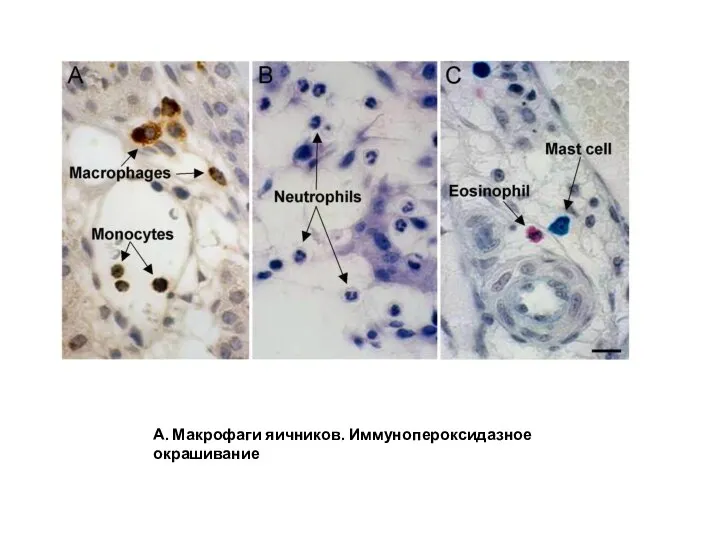
- 23. ФАГОЦИТЫ. КТО ОНИ? Два основных типа фагоцитов - ключевые клетки врожденного иммунного ответа. Тканевые макрофаги или
- 24. А. Макрофаги яичников. Иммунопероксидазное окрашивание
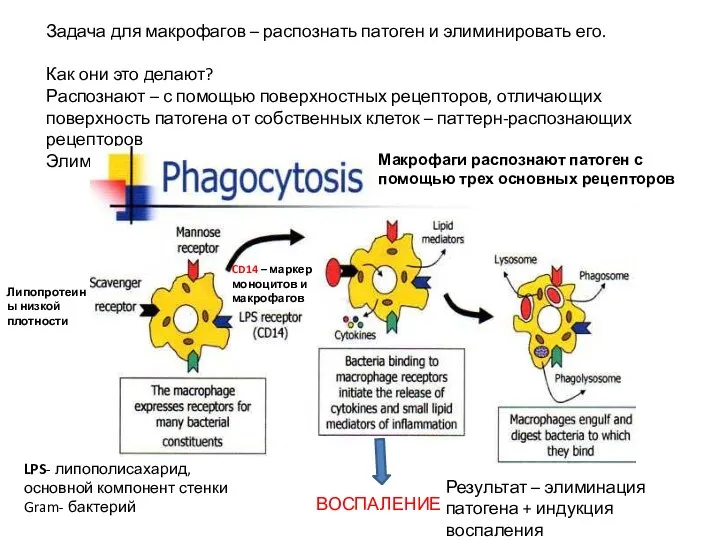
- 25. Задача для макрофагов – распознать патоген и элиминировать его. Как они это делают? Распознают – с
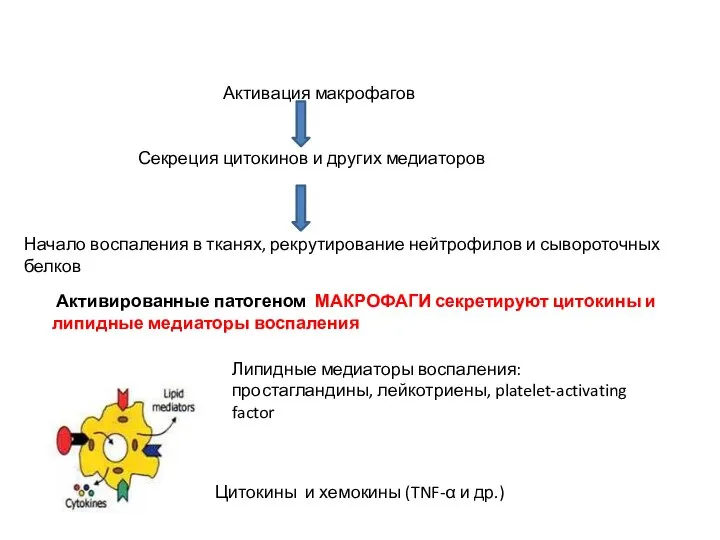
- 26. Активация макрофагов Секреция цитокинов и других медиаторов Начало воспаления в тканях, рекрутирование нейтрофилов и сывороточных белков
- 27. Зачем организму воспаление? Его Роль? Доставить дополнительные молекулы и клетки к месту инфекции для обеспечения поддержки
- 28. ВОСПАЛЕНИЕ (развивается в течение минут после проникновения патогена) Начинается с цитокинов и липидных медиаторов воспаления, которые
- 29. Повреждения кровеносных сосудов Кининовая система ферментов плазмы крови (брадикинин) Увеличение проницаемости сосудов и выход сывороточных белков
- 30. Активация СИСТЕМЫ КОМПЛЕМЕНТА – еще один путь для запуска процесса воспаления
- 31. СИСТЕМА КОМПЛЕМЕНТА – Complement System Complement (англ.)- «дополнение», был открыт как система сывороточных белков, которые дополняют
- 32. Система активации комплемента запускается белком, распознающим патоген и действующим как паттерн-распознающий рецептор.
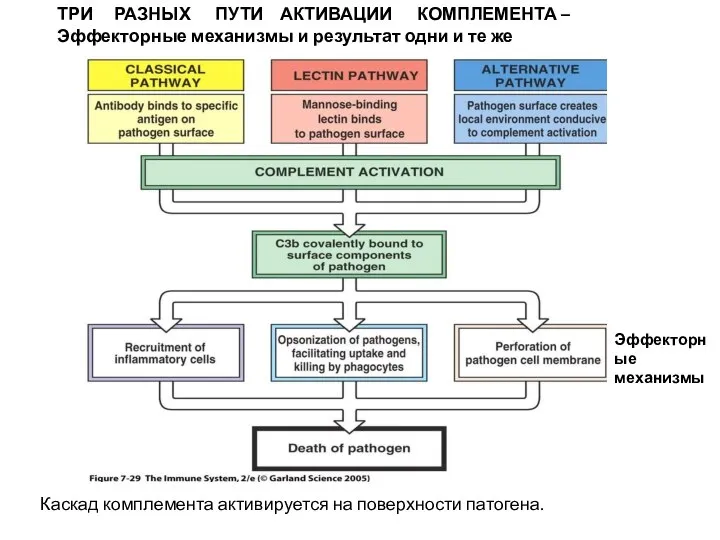
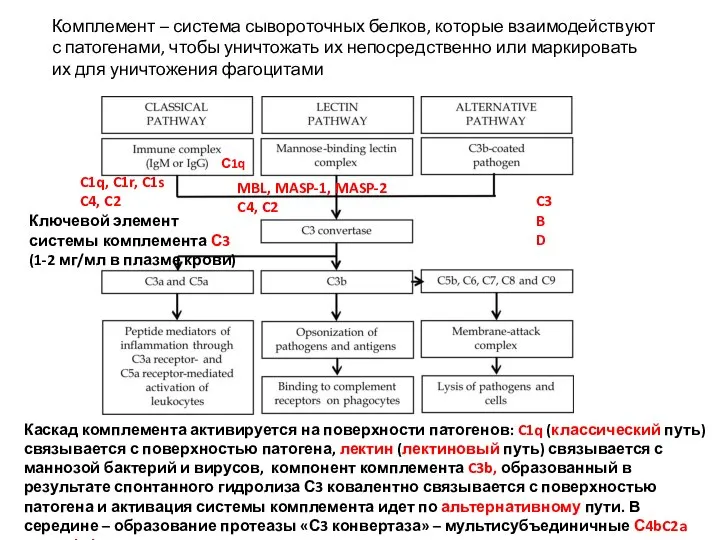
- 33. ТРИ РАЗНЫХ ПУТИ АКТИВАЦИИ КОМПЛЕМЕНТА – Эффекторные механизмы и результат одни и те же Каскад комплемента
- 34. Номенклатура белков системы комплемента. Белки классического пути открыты первыми – буква «С» с номером. Номера компонентов
- 35. C1q, C1r, C1s C4, C2 MBL, MASP-1, MASP-2 C4, C2 C3 B D Комплемент – система
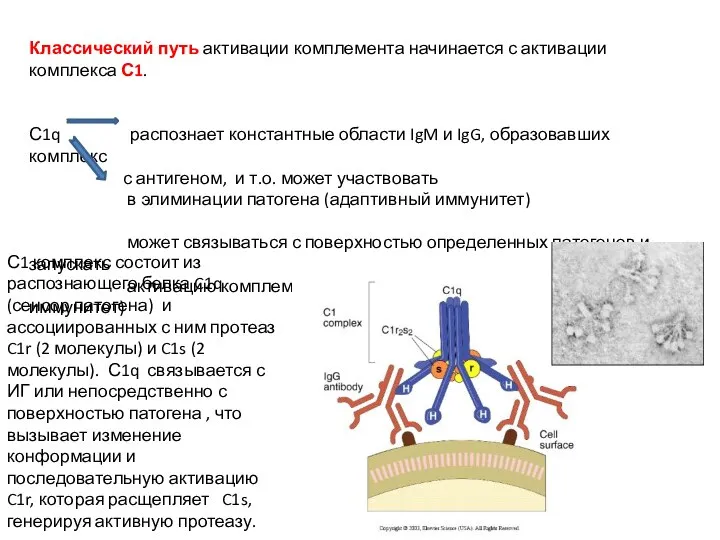
- 36. Классический путь активации комплемента начинается с активации комплекса С1. С1q распознает константные области IgM и IgG,
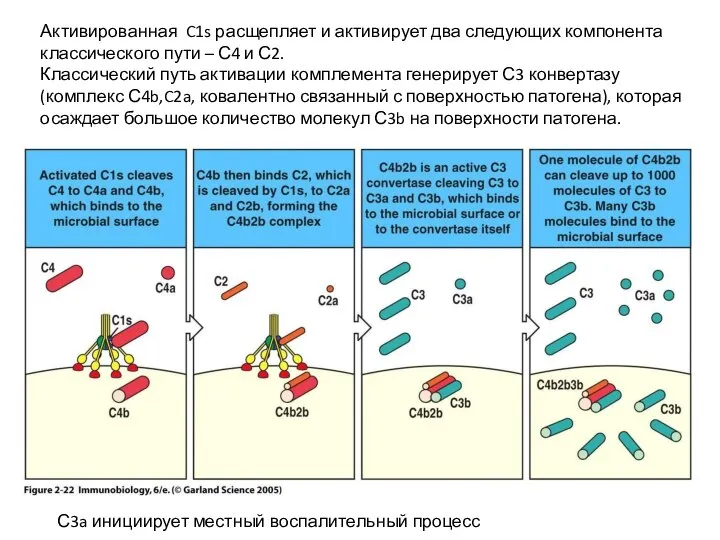
- 37. Активированная C1s расщепляет и активирует два следующих компонента классического пути – С4 и С2. Классический путь
- 38. Расщепление С3 на С3a и С3b – критический момент в активации комплемента, ведущий ко всем эффекторным
- 39. Лектиновый путь активации комплемента гомологичен классическому пути. Начало : Белок MBL (mannan-binding lectin), или белок фиколин,
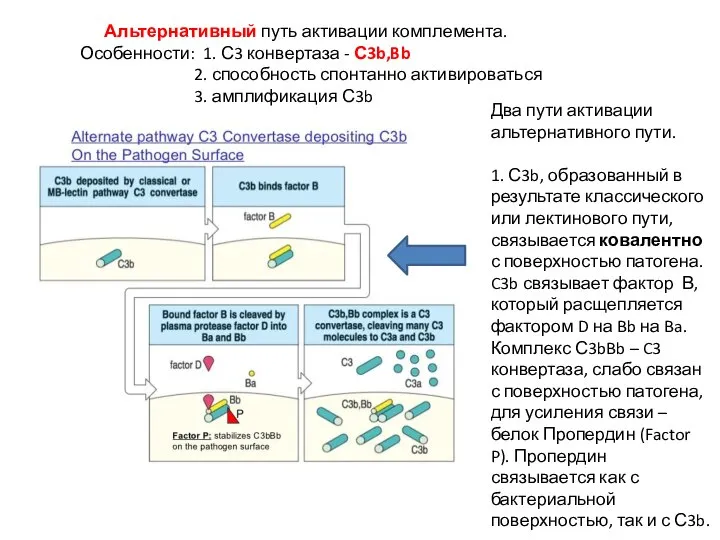
- 40. Альтернативный путь активации комплемента. Особенности: 1. С3 конвертаза - С3b,Bb 2. способность спонтанно активироваться 3. амплификация
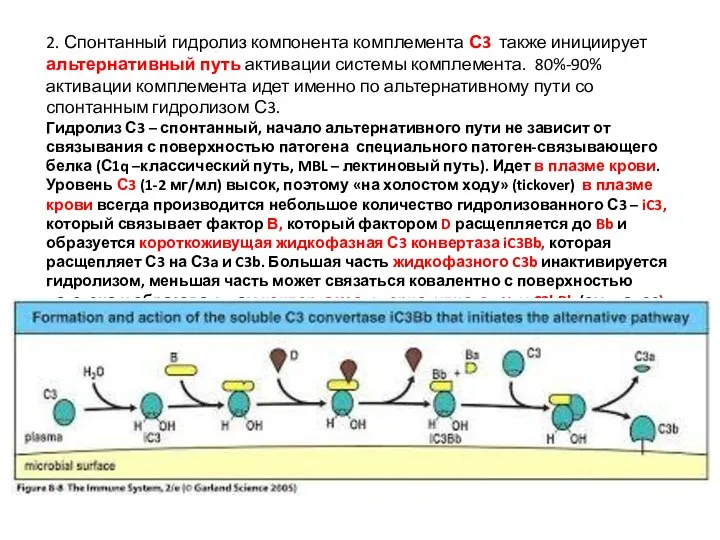
- 41. 2. Спонтанный гидролиз компонента комплемента С3 также инициирует альтернативный путь активации системы комплемента. 80%-90% активации комплемента
- 42. Что происходит дальше? - Зависит от типа поверхности, на которой сидит комплекс С3bBb.
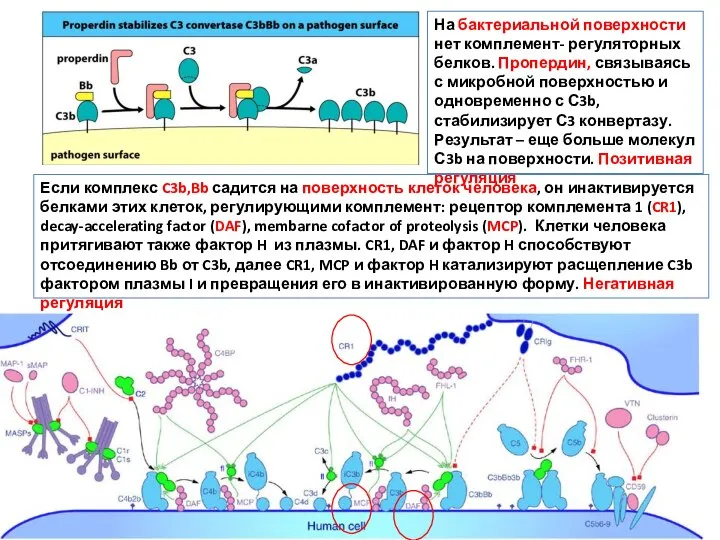
- 43. На бактериальной поверхности нет комплемент- регуляторных белков. Пропердин, связываясь с микробной поверхностью и одновременно с С3b,
- 44. C1q, C1r, C1s C4, C2 MBL, MASP-1, MASP-2 C4, C2 C3 B D Образование С3 конвертазы
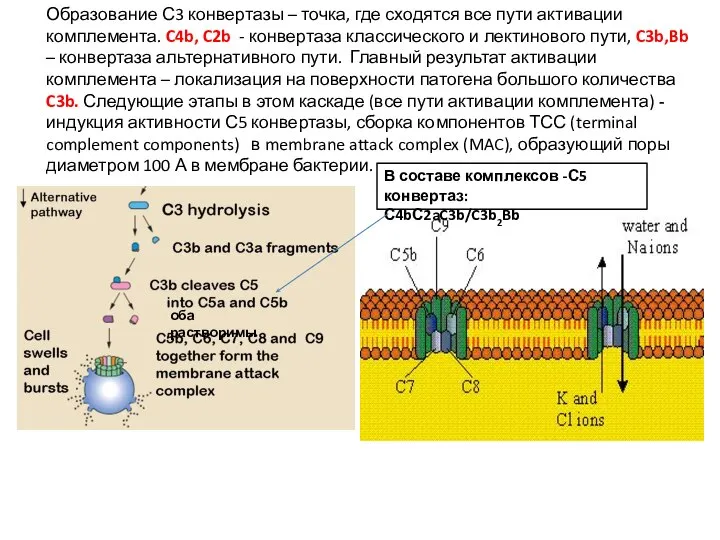
- 45. Образование С3 конвертазы – точка, где сходятся все пути активации комплемента. C4b, C2b - конвертаза классического
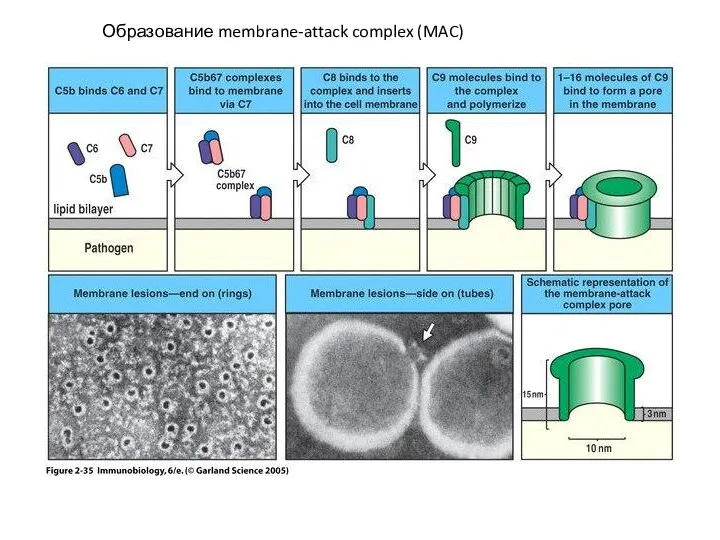
- 46. Образование membrane-attack complex (MAC)
- 47. Образование membrane-attack complex имеет для бактерии драматические последствия. Недостаточность MAC чувствительность к некоторым инфекциям: дефицит компонентов
- 48. Основной способ действия комплемента – облегчить захват и уничтожение патогена фагоцитирующими клетками. Это происходит после специфического
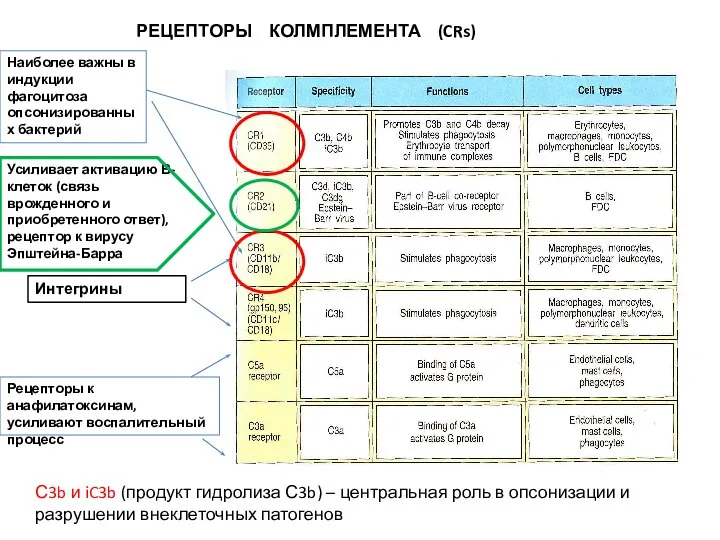
- 49. РЕЦЕПТОРЫ КОЛМПЛЕМЕНТА (CRs) Усиливает активацию В-клеток (связь врожденного и приобретенного ответ), рецептор к вирусу Эпштейна-Барра Рецепторы
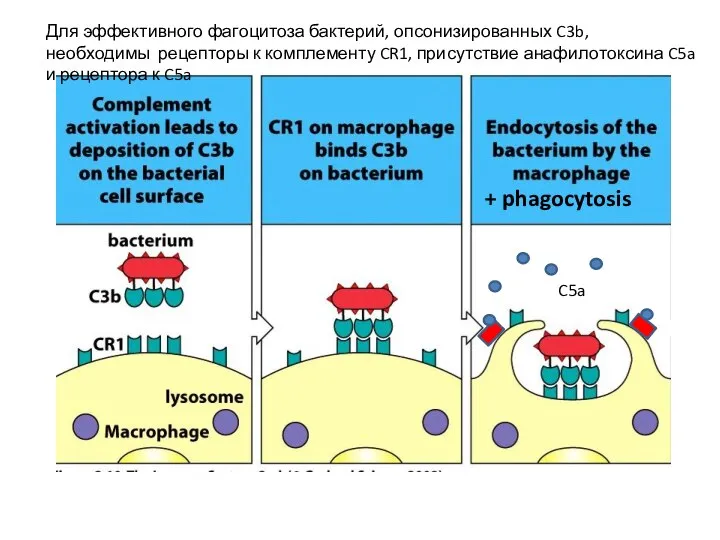
- 50. C5a Для эффективного фагоцитоза бактерий, опсонизированных C3b, необходимы рецепторы к комплементу CR1, присутствие анафилотоксина C5a и
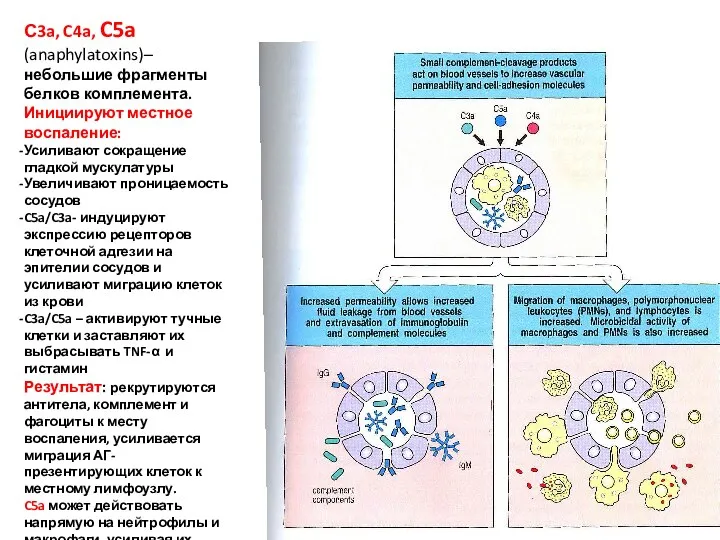
- 51. С3a, C4a, C5a (anaphylatoxins)– небольшие фрагменты белков комплемента. Инициируют местное воспаление: Усиливают сокращение гладкой мускулатуры Увеличивают
- 53. Скачать презентацию























 Сложные и нерешённые вопросы МСЭ в кардиологии
Сложные и нерешённые вопросы МСЭ в кардиологии Диффузные заболевания соединительной ткани: дерматологические аспекты
Диффузные заболевания соединительной ткани: дерматологические аспекты Холецистит - воспаление желчного пузыря
Холецистит - воспаление желчного пузыря Эпидемиология ВИЧ-инфекции
Эпидемиология ВИЧ-инфекции Клиническая медицина Европы Нового времени (XVIII-XIX вв.)
Клиническая медицина Европы Нового времени (XVIII-XIX вв.) Промывание желудка
Промывание желудка Фактори перинатального ризику і формування пре-перинатальної патології. Фактори, що негативно впливають на плід
Фактори перинатального ризику і формування пре-перинатальної патології. Фактори, що негативно впливають на плід Сестринский уход при острой сосудистой, острой сердечной недостаточности и ХНК
Сестринский уход при острой сосудистой, острой сердечной недостаточности и ХНК Хронический ларингит
Хронический ларингит Грибковые заболевания кожи
Грибковые заболевания кожи The lungs
The lungs Доступный тайм-менеджмент и целедостижение в профессиональной деятельности педагога для профилактики эмоционального выгорания
Доступный тайм-менеджмент и целедостижение в профессиональной деятельности педагога для профилактики эмоционального выгорания Техника расслабляющего массажа ног
Техника расслабляющего массажа ног Сыртқы құлақ жолында денені диагностикалау және алып шығару
Сыртқы құлақ жолында денені диагностикалау және алып шығару Генетикалық карталар
Генетикалық карталар Жыныстық жетілудің бұзылыстарының патоморфологиясы
Жыныстық жетілудің бұзылыстарының патоморфологиясы Серцеві хвороби
Серцеві хвороби Lung abscess
Lung abscess Сестринский процесс при воспалительных заболеваниях женских половых органов неспецифической, специфической этиологии, НМЦ
Сестринский процесс при воспалительных заболеваниях женских половых органов неспецифической, специфической этиологии, НМЦ Врачебно – физкультурная служба в Кабардино - Балкарской республике
Врачебно – физкультурная служба в Кабардино - Балкарской республике Физиология бактерий
Физиология бактерий Основы гигиены и физиологии труда
Основы гигиены и физиологии труда Психиатрическое обследование
Психиатрическое обследование Гиперплазия эмали
Гиперплазия эмали Системные микозы. Современные рекомендации по диагностике и лечению
Системные микозы. Современные рекомендации по диагностике и лечению Лечение паркинсонизма
Лечение паркинсонизма Сахара, соли, белки, аминокислоты и минералы – необходимость или зло в подростковом возрасте
Сахара, соли, белки, аминокислоты и минералы – необходимость или зло в подростковом возрасте Терапия. Разделы терапии
Терапия. Разделы терапии