Содержание
- 3. www.escmid.org ESCMID http://jac.oxfordjournals.org/ Journal of Antimicrobial Chemotherapy http://aac.asm.org/ Antimicrobial Agents and Chemotherapy http://cid.oxfordjournals.org/ Clinical Infectious Diseases
- 4. http://www.elsevier.com/journals/subjects/medicine http://www.ijidonline.com/home International Journal of Infectious Diseases http://onlinelibrary.wiley.com/ New microbes and new infections
- 5. Часть 1 Проблемы резистентности микроорганизмов к АБ
- 6. Микроорганизмы – возбудители инфекций в хирургии Грам (+) аэробы Staphylococcus Streptococcus Enterococcus Анаэробы Bacteroides Clostridium Грам
- 7. Особенности формирования антибиотикорезистентности в РФ (1) Избыточное потребление АМП в ОРИТ – США – 0,8 доз
- 8. Особенности формирования антибиотикорезистентности в РФ (2) Назначение АБ без учета спектра природной активности (АГ при внебольничной
- 9. Факторы риска наличия проблемных/ резистентных возбудителей Госпитализация в предшествующие 90 дней Перевод из другого стационара АБТ
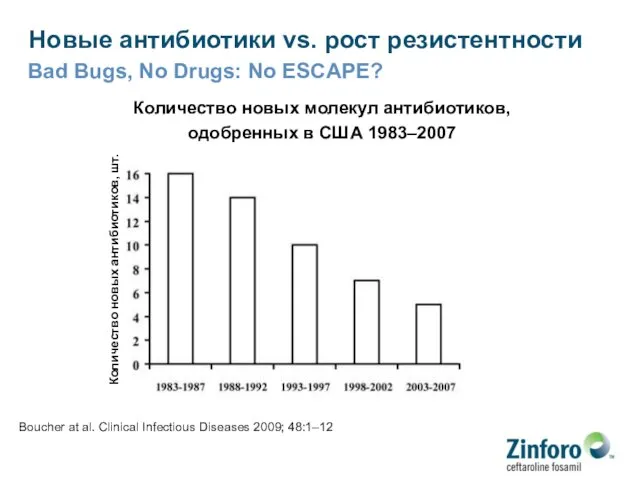
- 10. Новые антибиотики vs. рост резистентности Bad Bugs, No Drugs: No ESCAPE? Количество новых молекул антибиотиков, одобренных
- 11. Проблема: инфекционный контроль в стационаре
- 15. Терминология МПК90 Механизмы резистентности Ассоциированная резистентность Перекрестная R Инокулюм – эффект
- 16. Механизмы устойчивости бактерий к АБ Ферментативная инактивация антибиотика Бета-лактамазы Аминогликозид-модифицирующие ферменты Модификация мишени действия Пенициллинсвязывающие белки
- 17. S. aureus – эволюция резистентности Устойчивость к бета-лактамам 50-е - продукция плазмидных бета-лактамаз класса А 60-е
- 18. Устойчивость грамположительных бактерий к бензилпенициллину Пневмококки (модификация ПСБ) 1960-е годы – первый штамм 1990 – около
- 19. Бензилпенициллин (2008 г.) Стрептококковые инфекции КиМТ Рожа Клостридиальная инфекция Газовая гангрена Менингит (N.meningitidis)
- 20. Пенициллины
- 21. К этим терминам придется привыкать MRSA Methicillin-Resistant Staphylococcus Aureus Метициллин-резистентный стафилококк VRE Vancomycin-Resistant Enterococcus Ванкомицин-резистентный энтерококк
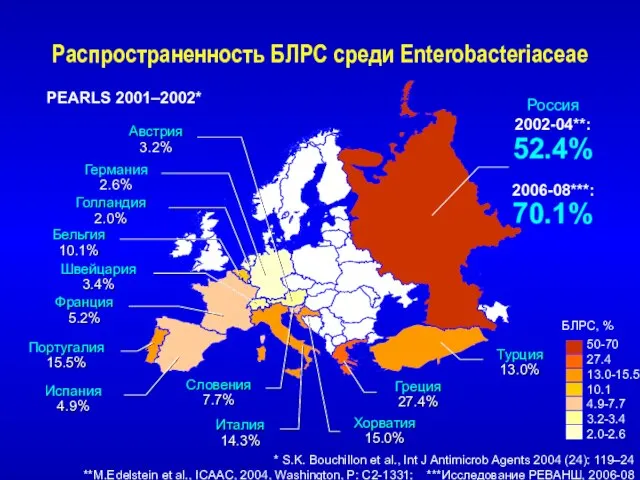
- 22. Распространенность БЛРС среди Enterobacteriaceae * S.K. Bouchillon et al., Int J Antimicrob Agents 2004 (24): 119–24
- 23. Как часто Вы получаете подобный результат для E. coli или K. pneumoniae из микробиологической лаборатории? Цефотаксим:
- 24. Что надо знать о БЛРС ? Возможны ошибки в детекции БЛРС (в т.ч. автомати-ческими анализаторами) в
- 26. Контроль возникновения и распространения устойчивых штаммов в стационаре Ограничение использования антибиотиков без обоснованных показаний Профилактическое назначение
- 27. Часть 2 Классификация АМП и АБ
- 28. Классификация антимикробных препаратов Антибактериальные препараты (АБ) Противогрибковые препараты Противопротозойные препараты Противотуберкулезные препараты Противопаразитарные препараты
- 29. Классификация антибиотиков (1) 1. Бета-лактамные АБ Пенициллины Цефалоспорины (ЦС) Монобактамы Карбапенемы 2. Аминогликозиды 3. Макролиды 4.
- 30. Классификация антибиотиков (2) 6. Линкозамиды 7. Тетрациклины 8. Оксазолидиноны (линезолид) 9. Липопептиды (даптомицин) 10. Глицилциклины (тигециклин)
- 31. Отличительные особенности антибиотиков как лекарственных средств Мишень действия – микроорганизм Снижение активности и эффективности со временем
- 32. Антистафилококковые пенициллины Оксациллин Эталон определения чувствительности стафилококков к бета-лактамам Эффективен только против MSSA MSSE – умеренная
- 33. Пенициллины расширенного спектра Ампициллин и амоксициллин Спектр активности – E.coli, P.mirabilis, H.influenzae Enterococcus faecalis, листерии Показания
- 34. Ампициллин
- 35. Ингибитор-защищенные бета-лактамы Амоксициллин/клавуланат Амоксициллин/сульбактам Внебольничные инфекции Абдоминальные Кожи и мягких тканей Респираторные Тикарциллин/ клавуланат Пиперациллин/ тазобактам
- 36. АМО/КК АМО/СБ Сильный ингибитор и сильный индуктор БЛРС Только в/в и per os 1,2 г х
- 37. Аугментин
- 38. Амоксиклав (амоксициллин + клавулановая кислота)
- 39. Антимикробная активность цефалоспоринов I поколение цефазолин II поколение ограниченный цефуроксим, цефокситин спектр преим. Грам(+) III поколение
- 40. Цефалоспорины I-II поколения Цефалоспорины I: цефазолин Staphylococci (MSSA) Streptococci Цефалоспорины II: цефуроксим Haemophilus influenzae Staphylococci: ЦС
- 41. Цефазолин, применение Периоперационная антибиотикопрофилактика Документированные MSSA – инфекции (S.aureus, чувствительный к оксациллину): ИКМТ, сепсис
- 42. Цефокситин (Анаэроцеф) ЦС II с антианаэробной активностью Стабилен к бета-лактамазам класса А и D (ТЕМ-1, ТЕМ-2,
- 43. Цефокситин (Анаэроцеф) Показания: Периоперационная АБ-профилактика в акушерстве, гинекологии, хирургии органов брюшной и грудной полостей Внебольничные интраабдоминальные
- 44. Цефалоспорины III поколения Группа IIIа Группа IIIb «Базовые» «Антисинегнойные» Цефотаксим Цефтазидим Цефтриаксон Цефоперазон Enterobacteriaceae + Streptococci
- 45. Цефалоспорины IV поколения Цефепим Спектр активности сходен с цефалоспоринами III = цефотаксим, цефтриаксон против стрептококков =
- 46. Проблема: БЛРС (ESBL) РФ занимает 1-е место в мире по продукции БЛРС 2008 год: устойчивость м/о
- 47. Цефоперазон/сульбактам (Сульперазон, Сульперацеф) Клиническое значение комбинации Расширение клинической активности цефоперазона на штаммы Грам(-) бактерий, продуцирующих БЛРС
- 48. Сульперазон
- 49. Активность ЦС в отношении Ps.aeruginosa Цефпиром > цефепим = цефтазидим > цефоперазон = ЦП/СБ
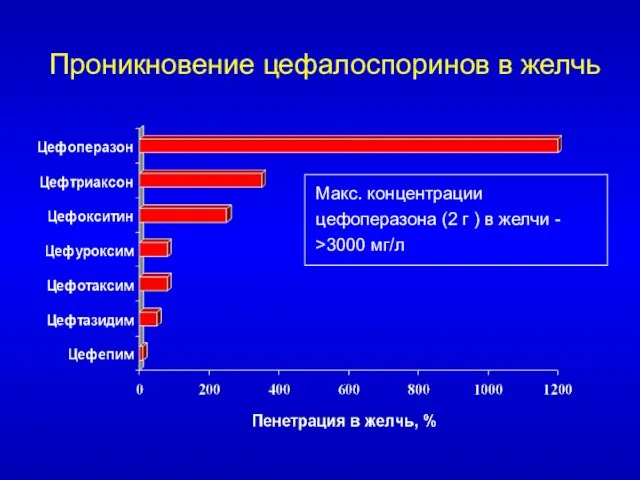
- 50. Проникновение цефалоспоринов в желчь Макс. концентрации цефоперазона (2 г ) в желчи - >3000 мг/л
- 51. Классификация карбапенемов Группа 1 – антипсевдомонадные Имипенем (1986) Меропенем (1995) Дорипенем (2008) Группа 2 – без
- 52. Тиенам (имипенем)
- 53. Эртапенем (ИНВАНЗ) Карбапенем без антисинегнойной активности Тяжелые внебольничные/ ранние госпитальные инфекции 1г х 1 р/сут в/в,
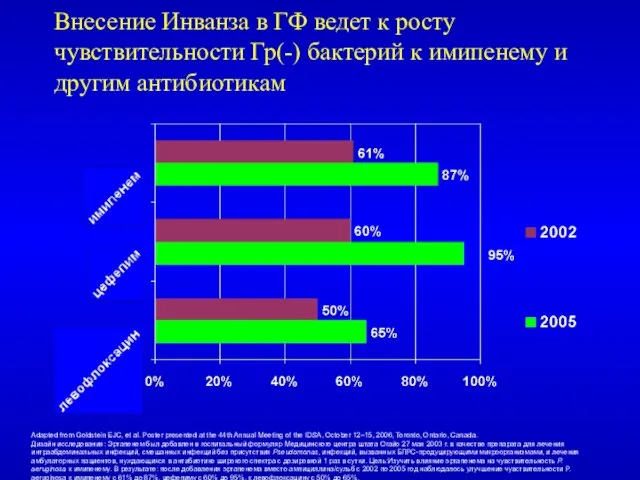
- 54. Внесение Инванза в ГФ ведет к росту чувствительности Гр(-) бактерий к имипенему и другим антибиотикам Adapted
- 55. Карбапенемы: имипенем, меропенем, дорипенем Наиболее широкий спектр антимикробной активности Практически 100% чувствительность Enterobacteriaceae Чувствительность P.aeruginosa и
- 56. Устойчивость к карбапенемам Грам(+) S.aureus: перекрестная Streptococci: не документирована Грам(-) E.coli, P.mirabilis, анаэробы – нет Acinetobacter
- 57. Имипенем (тиенам) Утрата OprD (пориновый белок - проникновение) Частота мутаций 10-7 МПК увеличивается с 1-2 до
- 58. Влияние типа мутации на развитие резистентности P. aeruginosa - Для развития устойчивости к Меронему необходимо сочетание
- 59. Современное значение антисинегнойных карбапенемов Эмпирическая терапия Госпитальный перитонит Холангит, билиарный сепсис Инфекции pancreas Пациенты с высоким
- 60. Фармакодинамически эквивалентные режимы дозирования меропенема и имипенема Меропенем 1,5 г/сут = имипенем 2 г/сут Меропенем 3
- 61. Оптимизация фармакодинамических параметров карбапенемов Увеличение дозы при сохранении интервалов введения Сокращение интервалов между введениями (более частое
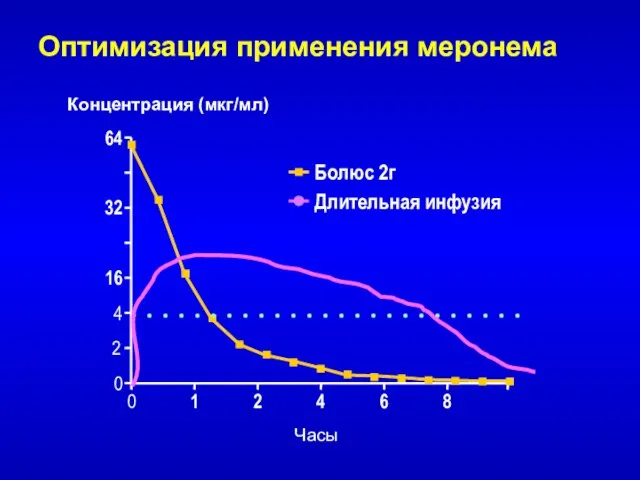
- 62. Оптимизация применения меронема при МПК = 4 мкг/мл : 30-минутная инфузия: 500 мг - %T>МПК ~
- 63. Обоснование продолжительной инфузии меропенема: стабильность в разных растворителях Физиологический (0,9%) раствор при комнатной температуре – 4-10
- 64. Оптимизация применения бета-лактамных антибиотиков В отношении P.aeruginosa с МПК 0.25-64 мкг/мл высокая доза в сочетании с
- 65. Оптимизация применения меронема В отношении P.aeruginosa с МПК 64 мкг/мл высокая доза (2 грамма) болюсом в
- 66. Болюс 2г Длительная инфузия Оптимизация применения меронема 0 64 4 16 32 0 4 8 1
- 67. Объективные причины повышения потребности в карбапенемах (1) По распространенности БЛРС в ОРИТ РФ на 1-м месте
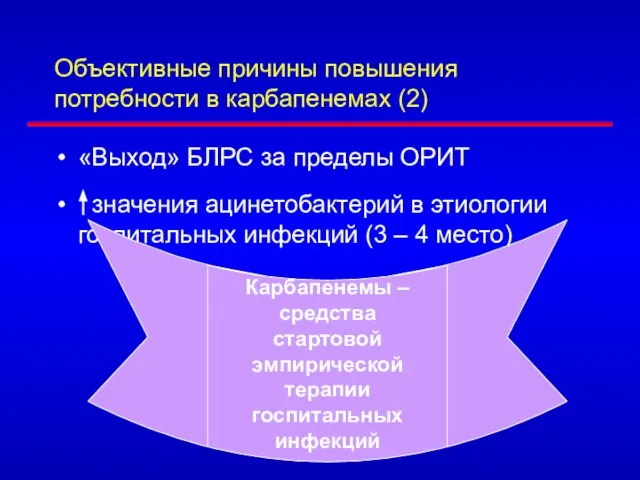
- 68. Объективные причины повышения потребности в карбапенемах (2) «Выход» БЛРС за пределы ОРИТ значения ацинетобактерий в этиологии
- 69. БЛРС: возможности лечения Наиболее надежны карбапенемы Фармакодинамически обоснован режим дозирования 1.5 г в сутки меропенем =
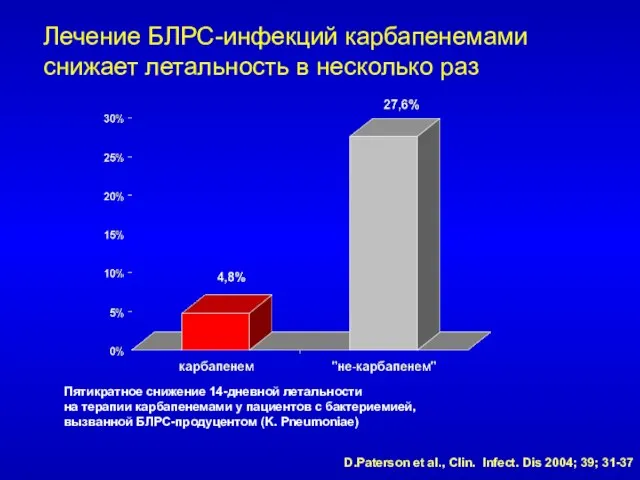
- 70. Лечение БЛРС-инфекций карбапенемами снижает летальность в несколько раз Пятикратное снижение 14-дневной летальности на терапии карбапенемами у
- 71. Резюме по антибактериальной активности карбапенемов Энтеробактерии: E.coli, Klebsiella spp., Proteus и др. Меропенем = дорипенем >
- 72. Сравнительные исследования оригинальных и воспроизведенных антибиотиков Фармакодинамическая/терапевтическая эквивалентность Имипенем: Тиенам vs генерик Тиенам = генерик по
- 73. Антибиотики генерики – фактор риска летальности в ОРИТ при инфекциях, вызванных ацинетобактериями [Torres J, 49th ICAAC,
- 74. Монобактамы /Азтреонам, Азтреабол/ Узкий спектр – грам(-) аэробы, вкл. Ps.aeruginosa, продуцирующую металло-беталактамазы Бактерицидный эф-т (нарушает образование
- 75. Азтреабол, азактам (азтреонам)
- 76. Монобактамы /Азтреабол/, показания Госпитальная пневмония Интраабдоминальные инфекции Инфекции органов малого таза Инфекции МВП ИКМТ, костей и
- 77. Аминогликозиды Природная активность Высокая: грам(-) бактерии Умеренная: стафилококки Слабая: энтерококки Природно устойчивы: Стрептококки, пневмококки, анаэробы НЕ
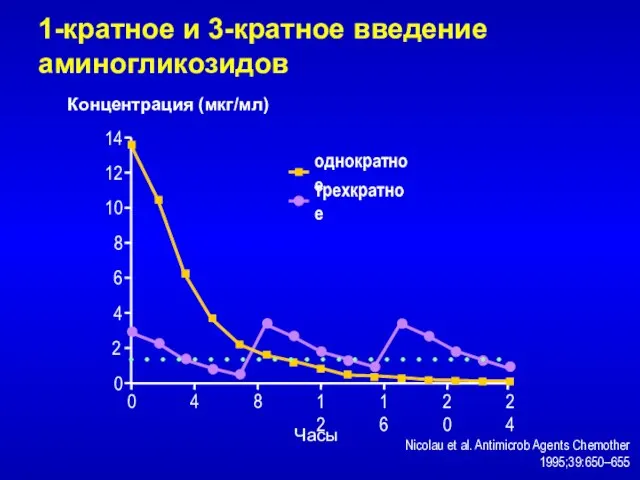
- 78. однократное трехкратное Nicolau et al. Antimicrob Agents Chemother 1995;39:650–655 1-кратное и 3-кратное введение аминогликозидов 0 8
- 79. Современное значение аминогликозидов в стационаре Высокий уровень устойчивости Грам(-) возбудителей и низкая тканевая пенетрация лимитируют применение
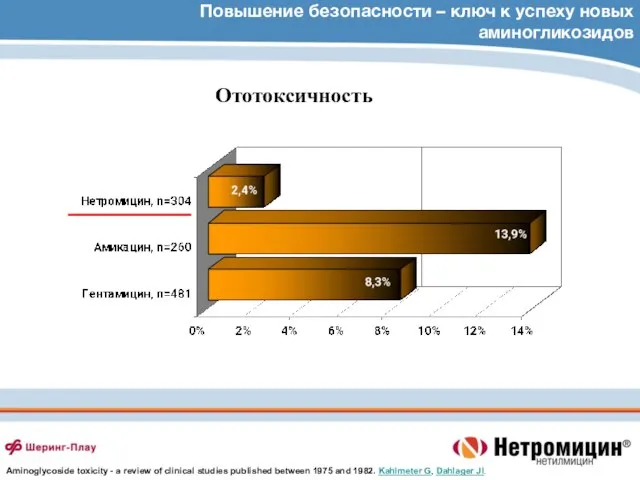
- 80. Повышение безопасности – ключ к успеху новых аминогликозидов Ототоксичность Aminoglycoside toxicity - a review of clinical
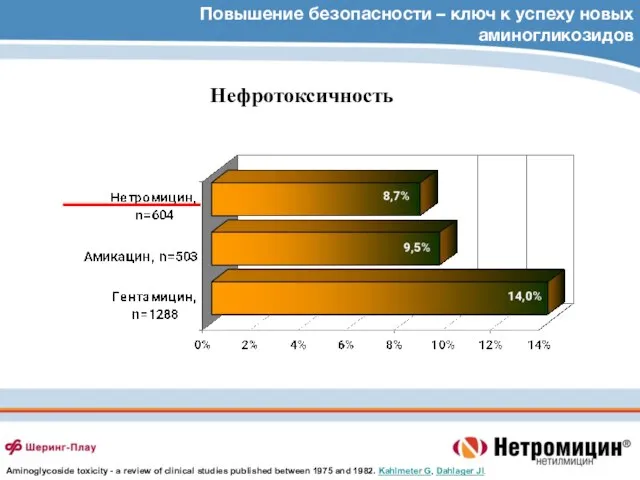
- 81. Повышение безопасности – ключ к успеху новых аминогликозидов Нефротоксичность Aminoglycoside toxicity - a review of clinical
- 82. Фторхинолоны Ранние: ципрофлоксацин Преим. Грам(-) офлоксацин Ципро > Офло=Пефло пефлоксацин Новые: левофлоксацин Более высокая против моксифлоксацин
- 83. Место новых фторхинолонов в стационаре Левофлоксацин, моксифлоксацинн Более выраженная активность против пневмококков/стрептококков, стафилококков, энтерококков Мокси >Лево
- 84. Левофлоксацин vs моксифлоксацин Моксифлоксацин – выше активность против Streptococcus pneumoniae Мокси - клинически эффективнее, чем лево
- 85. Авелокс (моксифлоксацин) Возможности использования в стационаре в современных условиях: ☑ Внебольничные инфекции Тяжелая внебольничная пневмония Внебольничный
- 86. Гликопептиды Ванкомицин Природная активность – Грамположительные бактерии Стафилококки, включая MRSA Энтерококки, включая резистентные к пенициллинам Резистентность
- 87. Эдицин (ванкомицин)
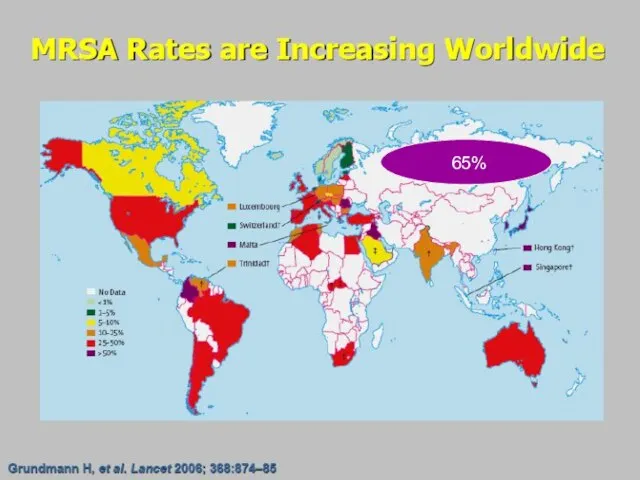
- 88. 65%
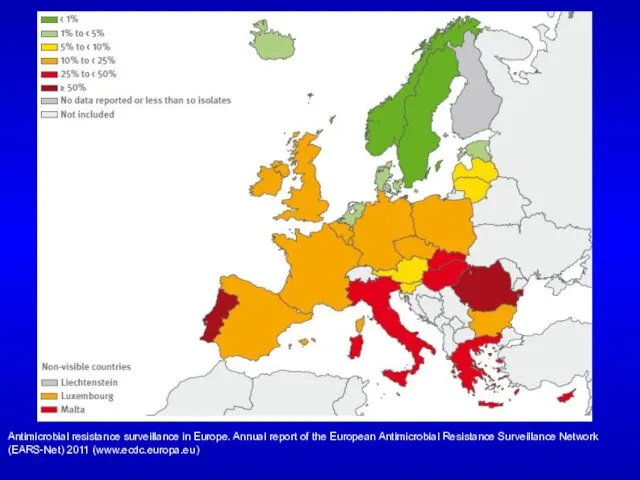
- 89. Доля MRSA штаммов в Европе, 2011 Antimicrobial resistance surveillance in Europe. Annual report of the European
- 90. Проблема MRSA в России Доля MRSA штаммов среди S.aureus в последние годы постоянно увеличивается и в
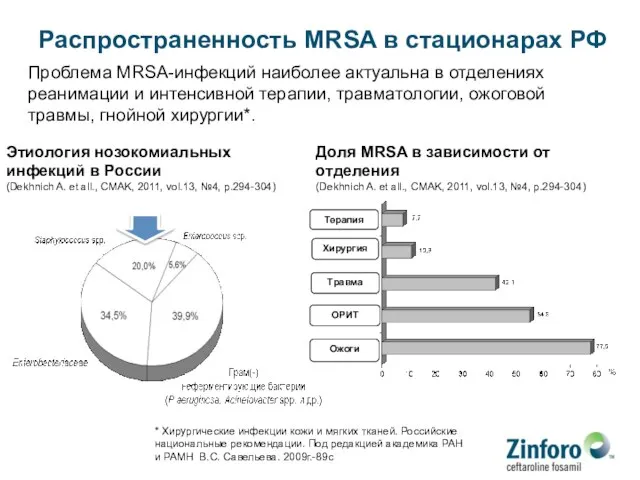
- 91. Распространенность MRSA в стационарах РФ Проблема MRSA-инфекций наиболее актуальна в отделениях реанимации и интенсивной терапии, травматологии,
- 92. Ванкомицин Показания к применению MRSA инфекции Энтерококковые инфекции (Амп, Пен – R) Режим дозирования: в/в (60-90
- 93. Ванкомицин «Проблемные» для ванкомицина локализации инфекций – Дыхательные пути, клапаны сердца, ЦНС Концентрации ванкомицина в %
- 94. Ванкомицин При использовании в теч. 14 дней появляются штаммы со сниженной чувствительностью клинической эффективности в виде
- 95. Условия безопасного применения ванкомицина Использовать хроматографически очищенные препараты – эдицин, ванкомабол, ванкомицин-Тева Медленная в/в инфузия (не
- 96. Оксазолидиноны Первый представитель класса – линезолид (зивокс) Антимикробная активность - Грам(+), вкл. MRSA Сохраняет активность в
- 97. Линезолид (Зивокс) Препарат выбора при НПивл, вызванной MRSA Превосходит ванкомицин по клинической эффективности в 3 раза
- 98. Линезолид (Зивокс) Другие клинические ситуации, при которых назначение линезолида целесообразно: Инфекционный эндокардит Всегда сохраняется чувствительность к
- 99. Зивокс (линезолид)
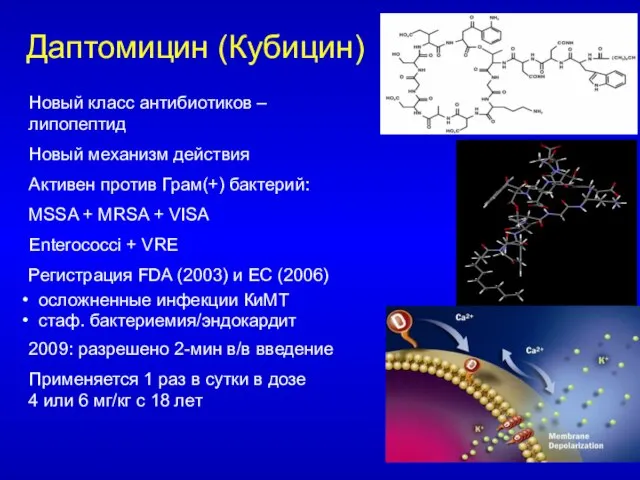
- 100. Даптомицин (Кубицин) Новый класс антибиотиков – липопептид Новый механизм действия Активен против Грам(+) бактерий: MSSA +
- 101. Антимикробные свойства даптомицина (Кубицина) Быстрое бактерицидное действие В течение 1 часа Дозозависимое Сохраняется в стационарной фазе
- 102. Новые анти-MRSA препараты: Тигециклин (Тигацил, Wyeth) Производное миноциклина С 18 лет Эффективен при инфекциях кожи и
- 103. Тигециклин: первый анти-MRSA антибиотик с широким спектром: возможность монотерапии? Анти-MRSA активность + Грам(+) Грам(-) VRE Enterobacteriaceae:
- 104. Отличительные свойства тицециклина Широкий спектр: Грам(+), Грам(-), анаэробы Возможность эмпирической монотерапии Активность против резистентных возбудителей: MRSA,
- 105. ЗинфороTM – цефалоспорин с расширенной Грам+ активностью Цефтаролин – антибиотик класса цефалоспоринов с in vitro активностью
- 106. Фосфомицин натрия (Урофосфабол) Бактерицидный АБ Медленное развитие резистентности Широкий спектр, вкл. синегнойную палочку Хорошее проникновение в
- 107. Фосфомицин натрия (УРОФОСФАБОЛ) Активен против БЛРС-продуцентов, ФХ-резистентных уропатогенов, Ps.aeruginosa (в комбинации с бета-лактамами, в/в) Суточная доза
- 108. Урофосфабол, показания Инфекции любой локализации, вкл. Сепсис MRSA-инфекции (+ ванкомицин) Инфекционный эндокардит Бактериальный менингит Нейтропения Полирезистентные
- 109. Урофосфабол, неантибактериальные свойства Способность проникать в биопленки Стимуляция фагоцитоза Иммуномодулирующий эффект Предупреждение ото- и нефротоксичности (АГ,
- 110. Метронидазол Спектр активности – только анаэробы Не применять вместе с ☑ ингибиторзащищенными АМП (амоксиклав, трифамокс, сульперазон,
- 111. Проблема резистентности анаэробов Карбапенемы 1 – 2% Амоксиклав 3 – 7% Цефокситин (Анаэроцеф) 6% Метронидазол 5
- 112. Полимиксин В (Вилимиксин) Эффективен в отношении грам(-) бактерий со множественной лекарственной устойчивостью: P.aeruginosa, Acinetobacter spp., Klebsiella
- 113. Полимиксин В (Вилимиксин), лекарственные взаимодействия Полимиксин + Имипенем + Рифампицин + Азитромицин Синергизм в отношении R
- 114. Макролиды Бактериостатики При аллергии на β-лактамы Постантибиотический, иммуномодулирующий эффекты (14- и 15-членные макролиды) Разрушение биопленок
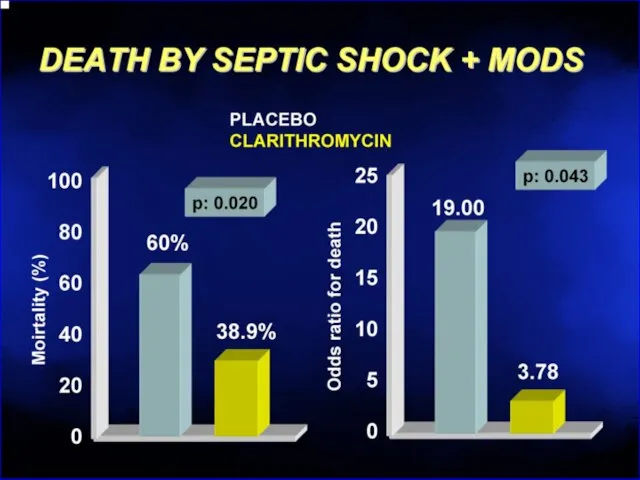
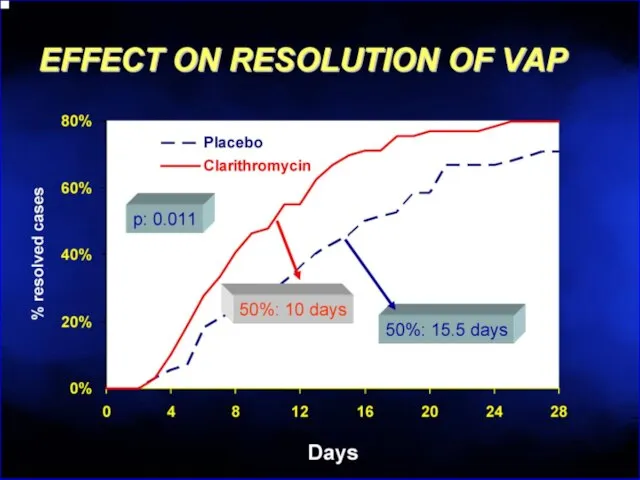
- 115. Рекомендуется ограничить использование Эритромицин - эффективная доза 2 г/сут в 100% тошнота, рвота невозможность продолжения терапии
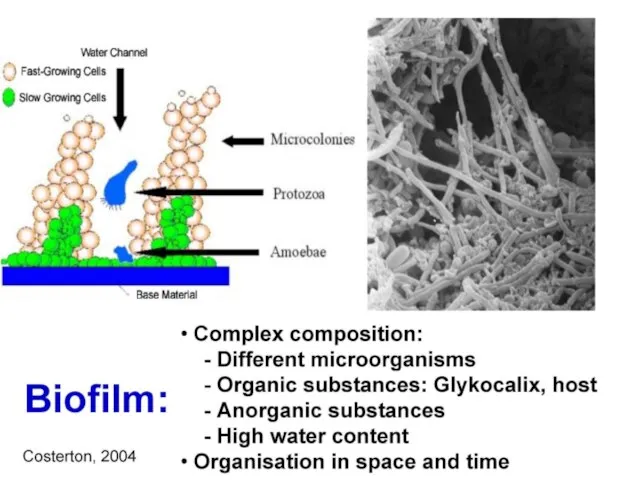
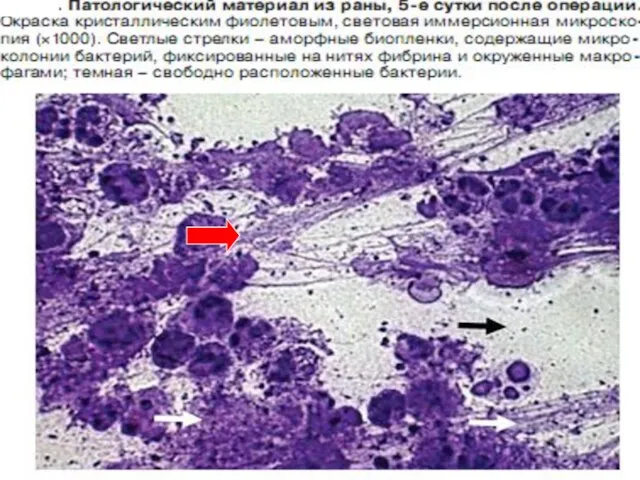
- 121. Клацид проникает в биопленки
- 127. Скачать презентацию








































































































 Особенности взаимоотношения и взаимодействия дошкольников разного возраста со взрослыми
Особенности взаимоотношения и взаимодействия дошкольников разного возраста со взрослыми Фармацевтикалық өнімді өткізудіынталандырудағы жарнаманың рөлі
Фармацевтикалық өнімді өткізудіынталандырудағы жарнаманың рөлі Общий план строения лимфатической системы
Общий план строения лимфатической системы Структурно-содержательные характеристики мотивационной сферы студентов-сирот
Структурно-содержательные характеристики мотивационной сферы студентов-сирот Өт қапшығы мен өт шығару жолдарының гистофункциялық сипаттамасы
Өт қапшығы мен өт шығару жолдарының гистофункциялық сипаттамасы Хронические гепатиты
Хронические гепатиты Виды реабилитации детей с ДЦП. Методики лечения детского церебрального паралича. Специфика гидрореабилитации
Виды реабилитации детей с ДЦП. Методики лечения детского церебрального паралича. Специфика гидрореабилитации Анемии: B12-дефицитные и гемолитические
Анемии: B12-дефицитные и гемолитические Суррогатное материнство
Суррогатное материнство Острая дыхательная недостаточность
Острая дыхательная недостаточность Высшие психические функции
Высшие психические функции Общие основы массажа
Общие основы массажа Иммунопрофилактика и иммунотерапия инфекционных заболеваний. Вакцины. Аллергены
Иммунопрофилактика и иммунотерапия инфекционных заболеваний. Вакцины. Аллергены Внутрибольничные инфекции и их профилактика
Внутрибольничные инфекции и их профилактика Экстренная реанимационная помощь
Экстренная реанимационная помощь Профилактика пролежней
Профилактика пролежней Остеоартроз
Остеоартроз Хронічні розлади харчування (діференційний діагноз, лікування)
Хронічні розлади харчування (діференційний діагноз, лікування) Токсикоз у беременных
Токсикоз у беременных Теория деятельности как методологический подход в психологии
Теория деятельности как методологический подход в психологии Гормоны. Механизм действия гормонов
Гормоны. Механизм действия гормонов С молоду береги почки
С молоду береги почки Инвагинация Кишечника.Гребенюк СВ-42
Инвагинация Кишечника.Гребенюк СВ-42 Аспирационная пневмония
Аспирационная пневмония Ультразвук в медицине
Ультразвук в медицине Понятие о микробиологии и эпидемиологии
Понятие о микробиологии и эпидемиологии Бронхоскопия. Показания
Бронхоскопия. Показания Аффективные нарушения психики
Аффективные нарушения психики