Содержание
- 2. Остановка кровотечения (гемостаз, Hemostasis) при повреждении сосуда происходит прежде всего за счет сокращения (спазма) сосуда, которое
- 3. Система гемостаза – защитная система организма, обеспечивающая сохранение крови в жидком состоянии в пределах кровеносных сосудов
- 4. Первый этап в процессе свертывания крови - адгезия тромбоцитов (прилипание тромбоцитов к месту повреждения, например, к
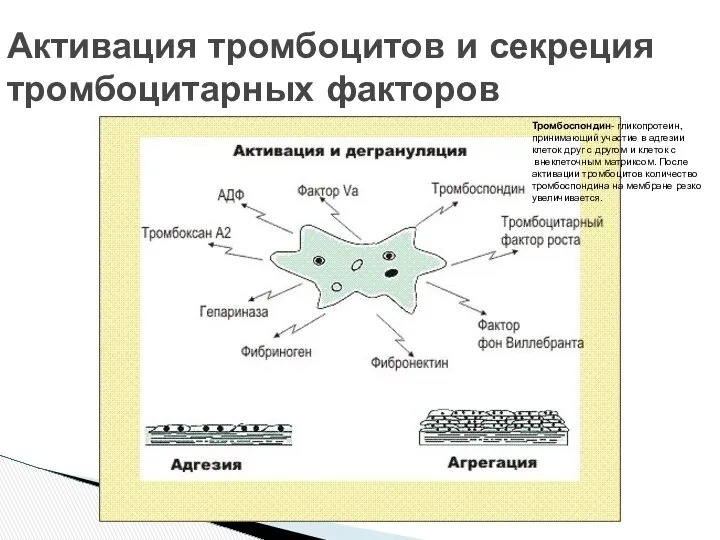
- 5. Активация тромбоцитов и секреция тромбоцитарных факторов Тромбоспондин- гликопротеин, принимающий участие в адгезии клеток друг с другом
- 6. В системе свертывания крови имеются плазменные и тромбоцитарные факторы. Международный комитет по гемостазу и тромбозу присвоил
- 7. В N-концевой части протромбина (II), факторов свертывания крови VII, IX, X, а также протеинов G и
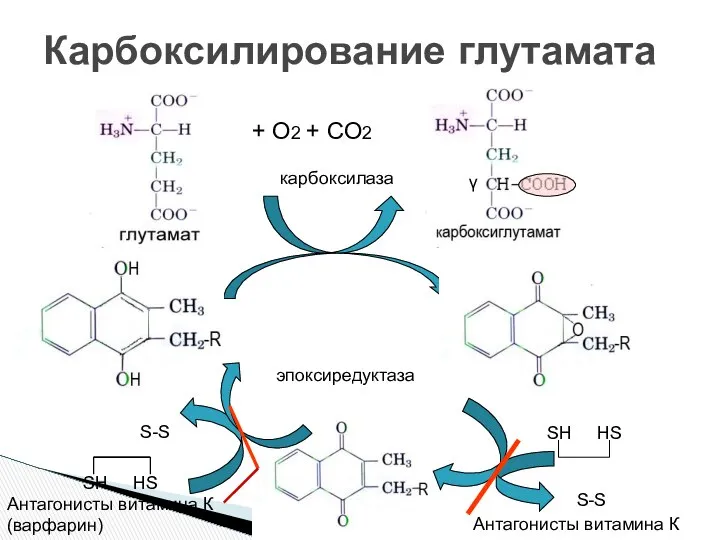
- 8. Карбоксилирование глутамата SH HS S-S Антагонисты витамина К Антагонисты витамина К (варфарин) SH HS S-S +
- 9. Витамин К и его антагонист варфарин о Варфарин применяется в медицине для терапии тромбозов
- 10. Крингл-домен. Протромбин (фактор XII ) и ферменты системы фибринолиза содержат участки с 80 аминокислотами, имеющими форму
- 11. Структура крингл-домена Крингл-домены в единственном числе обнаружены в урокиназе (протеолитическйм фермент, активатор плазминогена), факторе ХII, по
- 12. Домены фибронектина Фибронектин - гликопротеин, присутствующий в виде фибриллярной сети на поверхности клеток и в виде
- 13. ЕGF-домены. Факторы VII, IX, X и XII содержат последовательность из 50 аминокислот, гомологичную таковой для белков
- 14. Название Мол. Масса (кДа) время полужизни Функция Фибриноген (I) 340 3 дн. структурная Протромбин (II) 72
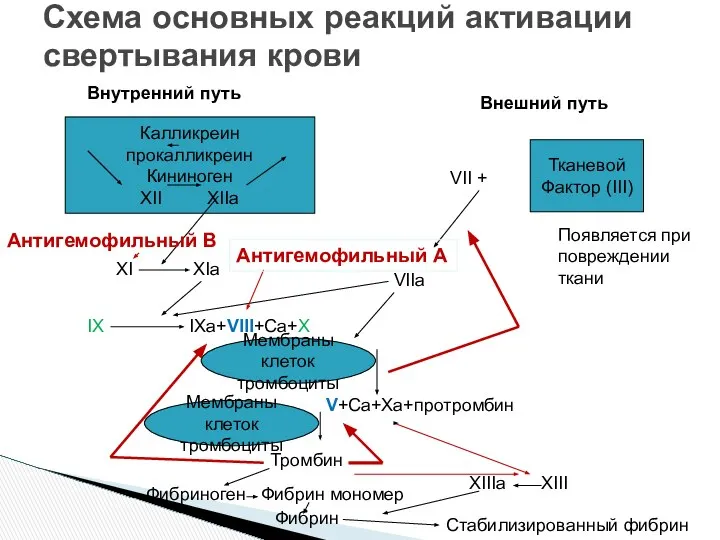
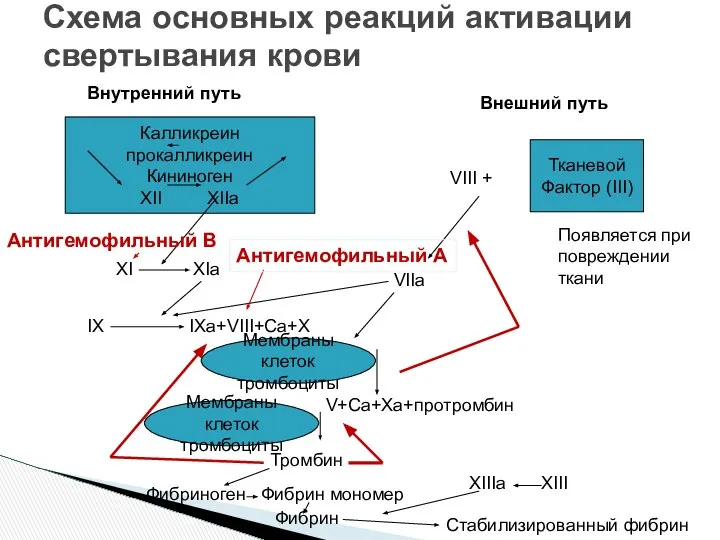
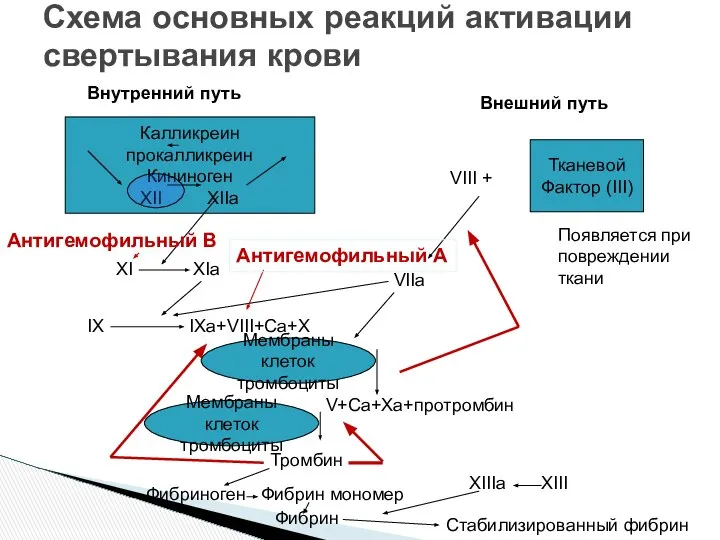
- 15. Схема основных реакций активации свертывания крови Калликреин прокалликреин Кининоген XII XIIa Тканевой Фактор (III) Внутренний путь
- 16. Каллекреин – сериновая протеаза, катализирующие образование кининов из кининогенов Кинины - группа биологически активных олигопептидов, к
- 17. Две формы: плазменная и тромбоцитарная. Плазменная: тетрамер из двух пар цепей (α и β), тромбоцитарный содержит
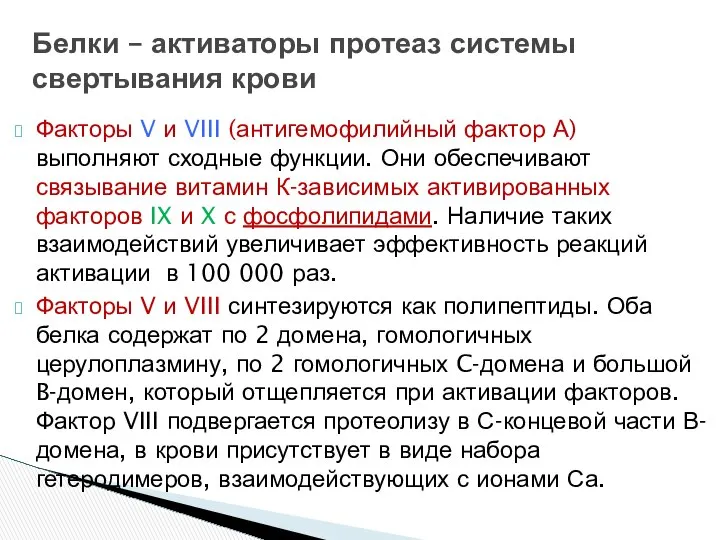
- 18. Факторы V и VIII (антигемофилийный фактор А) выполняют сходные функции. Они обеспечивают связывание витамин К-зависимых активированных
- 19. В свою очередь факторы V и VIII активируются под действием тромбина или фактора Xa. Тромбин расщепляет
- 20. В плазме крови фактор VIII циркулирует в виде комплекса с фактором фон Виллебранда (vWF) – адгезивным
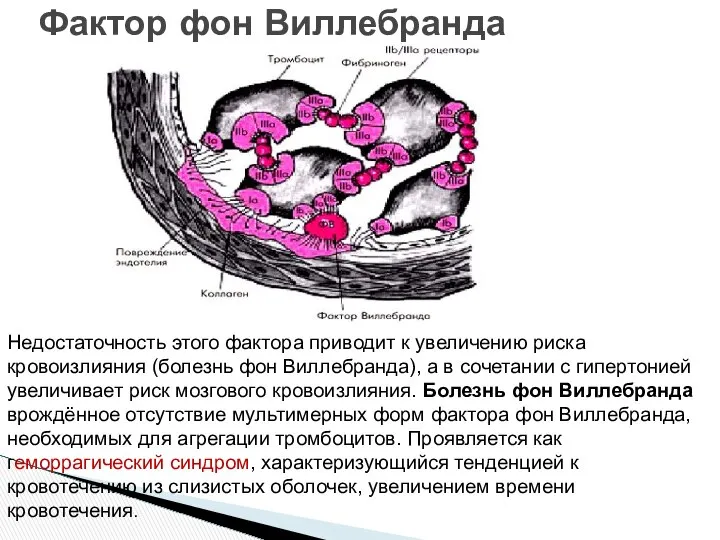
- 21. Фактор фон Виллебранда Недостаточность этого фактора приводит к увеличению риска кровоизлияния (болезнь фон Виллебранда), а в
- 22. Тканевой фактор III - трансмембранный гликопротеид, выполняющий функции рецептора фактора VII и модулирующий его активность. Активность
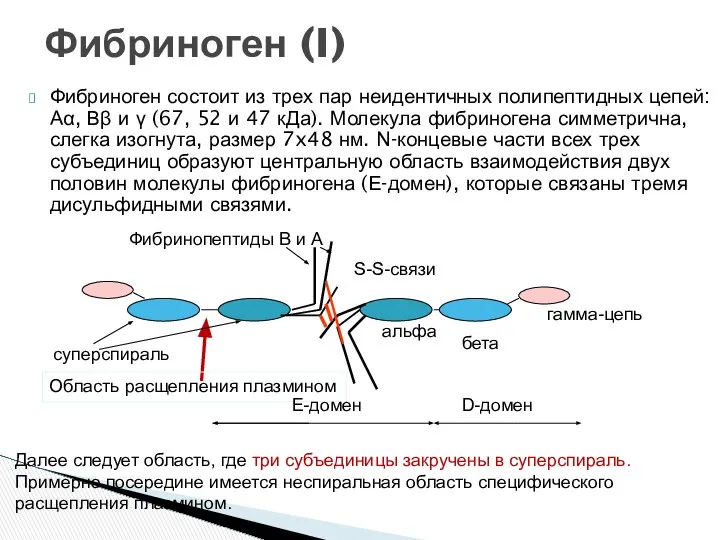
- 23. Фибриноген состоит из трех пар неидентичных полипептидных цепей: Аα, Вβ и γ (67, 52 и 47
- 24. Структура фибриногена
- 25. Полимеризация фибрина начинается после отщепления тромбином N-концевого 16 членного фибринопептида А в α-цепи, в результате чего
- 26. Последовательность каждой из цепей кодируется своим геном, которые возникли в результате дупликации одного гена-предшественника. γ-цепь существует
- 27. Фибриноген связывает три иона Са c Кд около 1 мкМ и около 10 ионов Са с
- 28. Синтез фибриногена значительно повышается при многих заболеваниях, он стимулируется ИЛ-6. Уровень фибриногена в крови увеличивается 1)
- 29. Свертывание крови – результат серии реакций, в которых путем ограниченного протеолиза образуются активные компоненты системы свертывания.
- 30. Схема основных реакций активации свертывания крови Калликреин прокалликреин Кининоген XII XIIa Тканевой Фактор (III) Внутренний путь
- 31. Кинин-калликреиновая система состоит из небольших полипептидов, а также набора активирующих и деактивирующих ее компоненты ферментов. Освобождение
- 32. В плазме крови человека присутствуют два кининогена: высокомолекулярный кининоген (ВМК) и низкомолекулярный кининоген (НМК), синтез которых
- 33. Связывание фактора XII (фактора Хагемана) с компонентами субэндотелиального слоя, активированными тромбоцитами, мицеллами из фосфолипидов или бактериальными
- 34. Далее фактор XIIa активирует фактор XI, расщепляя в нем связь с Arg369, образуя легкую и тяжелую
- 35. Фактор IX активируется в результате расщепления связей Arg145-Ala146 и Arg180-Val181 с освобождением пептида активации. Может происходить
- 36. Схема основных реакций активации свертывания крови Калликреин прокалликреин Кининоген XII XIIa Тканевой Фактор (III) Внутренний путь
- 37. Активация фактора X под действием фактора IXa происходит на поверхности фосфолипидов при участии ионов Са и
- 38. При контакте крови с клетками, экспрессирующими тканевой фактор (ТФ), фактор VII связывается с ТФ с Kd
- 39. Фактор X, активированный на поверхности фосфолипидов комплексом IXa-VIIIa или комплексом фактор VIII- TФ, образует комплекс с
- 40. Тромбин ускоряет свое образование, активируя тромбоциты, факторы V и VIII, и возможно VII и IX. Он
- 41. Схема основных реакций активации свертывания крови Калликреин прокалликреин Кининоген XII XIIa Тканевой Фактор (III) Внутренний путь
- 42. Ограничение свертывания крови участком повреждения достигается за счет локализации участников реакции на поверхности поврежденных или стимулированных
- 43. Аннексин V: секретируется из эндотелиальных клеток и оказывает локальное антикоагулянтное действие, связываясь с прокоагулянтными фосфолипидами (напр.
- 44. Серпины (включая овальбумин, ангиотензиноген, тироксин-связывающий белок) состоят из около 400 аминокислот, различия в м.м. обусловлены гликозилированием.
- 45. Антитромбин III ингибирует все протезы системы свертывания, а также плазмин, трипсин и CIs компонент системы комплемента.
- 46. Гепарин Повторяющиеся дисахариды Глюкозаминогликан Число дисахаридов на цепь Гепарин
- 47. Гиалуроновая кислота
- 48. Частота наследственного дефицита антитромбина III в популяциях (аутосомно-доминантный признак) составляет 1/2000-5000. Клинические проявления – тромбозы глубоких
- 49. Протеин С – профермент, который после активации тромбином расщепляет факторы Vа и VIIIa, прерывая каскад Тромбомодулин
- 50. Увеличивает скорость инактивации протеином C факторов Va и VIII в составе протромбиназного комплекса с X –фактором,
- 51. Дефицит этих белков приводит к развитию венозных тромбозов и тромбоэмболии. При гетерозиготной форме тромбозы появляются после
- 52. Резистентность к протеину С отмечается у 10-20% больных, страдающих тромбозом глубоких вен. Наиболее часто причина –
- 53. Фермент, расщепляющий фибрин – плазмин, образуется при активации плазминогена (24 S-S связи, 5 крингл-доменов). Крингл-домены связывают
- 54. Серпины — группа белков, которые имеют определённое структурное сходство между собой и многие из которых ингибируют
- 55. Приложение – механизм действия сериновых протеаз
- 56. Специфичность действия различных пептидаз (приложение) Трипсин Lys, Arg (C-конец) Химотрипсин Phe, Trp, Tyr (C) V8 (Staphylococcus
- 57. Механизм действия химотрипсина (приложение) цепь цепь цепь Химотрипсин – протеаза, катализирующая гидролиз пептидной связи, рядом с
- 58. Активный центр и субстрат химотрипсина Активный центр химотрипсина Субстрат (полипептид) Гидрофобный карман Активный центр карман для
- 59. Стадия 1: образование комплекса ES комплекс Взаимодействие Ser195 и His57 приводит к образованию сильного нуклеофила (электронная
- 60. Стадия 2: освобождение продукта 1 Освобождение первого продукта Нестабильность, обусловленная наличием заряда на карбонильном кислороде субстрата,
- 61. Стадия 3: образование ацилфермента Ацилированный фермент После ухода первого продукта оставшаяся часть полипептидной цепи остается связан-
- 62. Стадия 4: связывание воды Приходящая молекула воды депротонируется за счет взаимодействия с His57, образуя нуклео- фильный
- 63. Стадия 5: деацилирование При распаде второго ин- термедиата об- разуется второй продукт, карбогидрат- анион, и Н
- 65. Скачать презентацию






















































 Ультразвуковое исследование легких и плевры
Ультразвуковое исследование легких и плевры Предмет і завдання психіатрії та наркології. Класифікація психічних розладів і захворювань
Предмет і завдання психіатрії та наркології. Класифікація психічних розладів і захворювань Печень. Поджелудочная железа. Гистология
Печень. Поджелудочная железа. Гистология Спортивная медицина
Спортивная медицина Энцефалиты
Энцефалиты Завтрак школьника в условиях пандемии
Завтрак школьника в условиях пандемии Жұқпалы ауру және жүктілік
Жұқпалы ауру және жүктілік Антиген
Антиген Гемолитические анемии
Гемолитические анемии Мотивационно-потребностная сфера подростков(11-14 лет)
Мотивационно-потребностная сфера подростков(11-14 лет) Способности и прирожденные условия развития способностей
Способности и прирожденные условия развития способностей История и перспективы развития медико-социальной экспертизы Санкт-Петербурга. К 100-летию службы МСЭ
История и перспективы развития медико-социальной экспертизы Санкт-Петербурга. К 100-летию службы МСЭ Сердце. Физиология
Сердце. Физиология Агранулоцитарная ангина
Агранулоцитарная ангина Психология, патопсихология и психопатология сознания
Психология, патопсихология и психопатология сознания Ощущение, восприятие, память (занятие 14)
Ощущение, восприятие, память (занятие 14) Еңбек жағдайының гигиеналық бағалау критерийлері мен жіктелуі
Еңбек жағдайының гигиеналық бағалау критерийлері мен жіктелуі Гиповолемический шок
Гиповолемический шок Сестринский уход за пациентами с заболеваниями глотки
Сестринский уход за пациентами с заболеваниями глотки Патофизиология системы иммунобиологического надзора. Иммунодефицитные и иммунодепрессивные состояния. (Лекция 9, 10, 11)
Патофизиология системы иммунобиологического надзора. Иммунодефицитные и иммунодепрессивные состояния. (Лекция 9, 10, 11) Психологические особенности межличностных отношений в подростковом возрасте
Психологические особенности межличностных отношений в подростковом возрасте Топография таза и операции на органах таза
Топография таза и операции на органах таза Особенности новорожденного ребенка
Особенности новорожденного ребенка Высшая нервная деятельность
Высшая нервная деятельность ЭКГ в норме и при основных поражениях сердца
ЭКГ в норме и при основных поражениях сердца Анализ многолетней динамики заболеваемости в эпидемиологической диагностике
Анализ многолетней динамики заболеваемости в эпидемиологической диагностике Перфоративная язва желудка и двенадцатиперстной кишки
Перфоративная язва желудка и двенадцатиперстной кишки Темперамент
Темперамент