Содержание
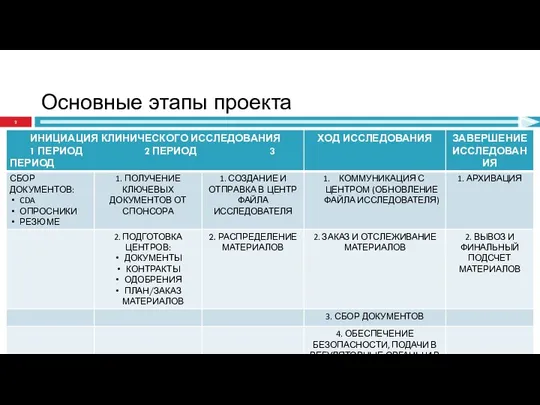
- 2. Основные этапы проекта
- 3. 1. ИНИЦИАЦИЯ КИ - 1 ПЕРИОД
- 4. 1. ИНИЦИАЦИЯ КИ - 1 ПЕРИОД ассистент/монитор: подготавливает CDA какое юр. лицо СДД подписывает? монитор: отправляет
- 5. 1. ИНИЦИАЦИЯ КИ - 1 ПЕРИОД визит отбора резюме ГИ оригинал CDA подписная страница протокола и
- 6. 1. ИНИЦИАЦИЯ КИ - 1 ПЕРИОД визит отбора Дополнительный список документов: резюме потенциальных СИ и других
- 7. 1. ИНИЦИАЦИЯ КИ - 1 ПЕРИОД визит отбора Дополнительный список документов: документация локальной лаборатории (лаб. нормы,
- 8. 2. ИНИЦИАЦИЯ КИ - 2 ПЕРИОД
- 9. 2. ИНИЦИАЦИЯ КИ - 2 ПЕРИОД сохранение документов на сервере
- 10. 2. ИНИЦИАЦИЯ КИ - 2 ПЕРИОД сохранение документов на сервере
- 11. 2. ИНИЦИАЦИЯ КИ - 2 ПЕРИОД сохранение документов на сервере
- 12. 2. ИНИЦИАЦИЯ КИ - 2 ПЕРИОД Получение ключевых документов от Спонсора Форма одобрения поставки препарата в
- 13. 2. ИНИЦИАЦИЯ КИ - 2 ПЕРИОД создание и Одобрение Оглавления Файла Спонсора и Файла Исследователя у
- 14. Чеклист по Файлу Спонсора
- 15. 2. ИНИЦИАЦИЯ КИ - 2 ПЕРИОД Подготовка центров документы подписание формы одобрения контракты поставки препарата одобрения
- 16. 2. ИНИЦИАЦИЯ КИ - 2 ПЕРИОД Подготовка центров документы адрес, где принимаются пациенты, должен быть указан
- 17. 2. ИНИЦИАЦИЯ КИ - 2 ПЕРИОД Подготовка центров документы Форма FDA 1572 документы форма заполняется в
- 18. 2. ИНИЦИАЦИЯ КИ - 2 ПЕРИОД Подготовка центров контракты подготовка драфта договора (скачать шаблон договора из
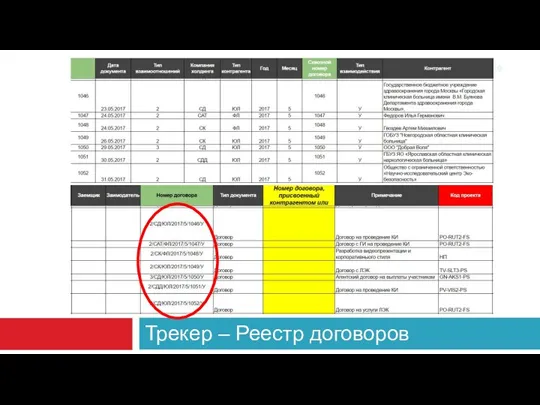
- 19. Трекер – Реестр договоров
- 20. 2. ИНИЦИАЦИЯ КИ - 2 ПЕРИОД Подготовка центров контракты отредактировать шаблон, исходя из нужд проекта обратить
- 21. 2. ИНИЦИАЦИЯ КИ - 2 ПЕРИОД Подготовка центров контракты Процесс одобрения и подписания договора: отправить драфт
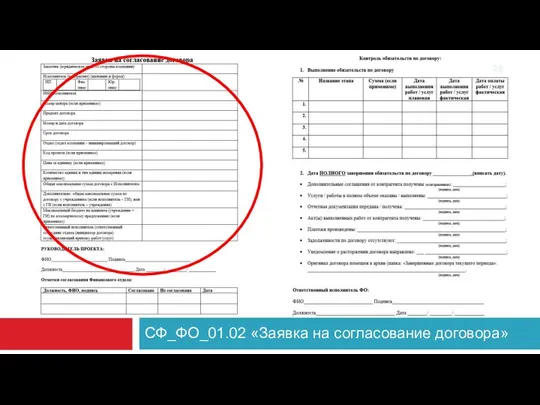
- 22. СФ_ФО_01.02 «Заявка на согласование договора»
- 23. 2. ИНИЦИАЦИЯ КИ - 2 ПЕРИОД перед подписанием договора необходимо заполнить и подписать заявку на согласование
- 24. 2. ИНИЦИАЦИЯ КИ - 2 ПЕРИОД Подготовка центров одобрения Резюме Главного исследователя для подачи в МЗ
- 25. 2. ИНИЦИАЦИЯ КИ - 2 ПЕРИОД Подготовка центров одобрения Резюме Главного исследователя для подачи в МЗ
- 26. 2. ИНИЦИАЦИЯ КИ - 2 ПЕРИОД Подготовка центров одобрения Резюме Главного исследователя для подачи в МЗ
- 27. 2. ИНИЦИАЦИЯ КИ - 2 ПЕРИОД Подготовка центров одобрения ЛЭК СОПы, Положение, Состав письмо-подача кворум выписка-одобрение
- 28. 2. ИНИЦИАЦИЯ КИ - 2 ПЕРИОД Подготовка центров план/заказ материалов пересчитать полученные материалы, внести в трекер
- 29. 2. ИНИЦИАЦИЯ КИ - 3 ПЕРИОД
- 30. 3. ИНИЦИАЦИЯ КИ - 3 ПЕРИОД Файл Исследователя отправка в центр - чеклист
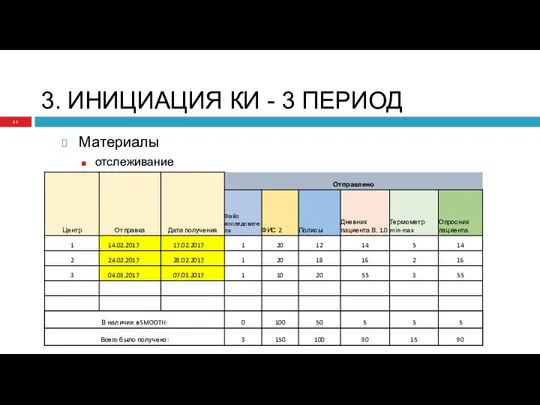
- 31. 3. ИНИЦИАЦИЯ КИ - 3 ПЕРИОД Материалы отслеживание
- 32. 3. ИНИЦИАЦИЯ КИ - 3 ПЕРИОД Формы Перечень оборудования для проведения исследования в ИЦ Перечень первичной
- 33. 4. ХОД ИССЛЕДОВАНИЯ
- 34. 4. ХОД ИССЛЕДОВАНИЯ мы отслеживаем отправку и получение: всех документов по КИ всех материалов по КИ
- 35. 4. ХОД ИССЛЕДОВАНИЯ во время КИ важно запрашивать и отслеживать следующие документы: подписные страницы новых версий
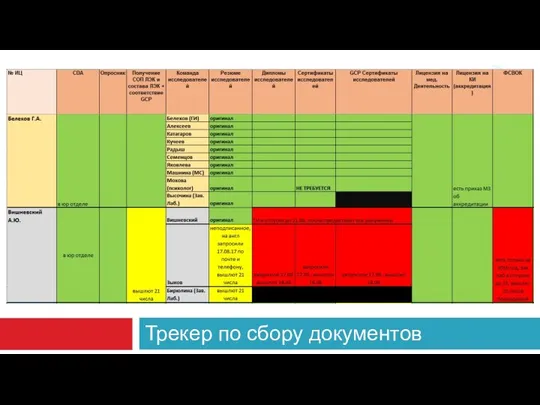
- 36. Трекер по сбору документов
- 37. 4. ХОД ИССЛЕДОВАНИЯ Во время КИ важно запрашивать и отслеживать следующие документы: заполненные в центре формы
- 38. 4. ХОД ИССЛЕДОВАНИЯ необходимо регулярно проверять Файл Спонсора и подписывать Форму подтверждения проверки Файла Спонсора эта
- 39. 4. ХОД ИССЛЕДОВАНИЯ Подачи в регуляторные органы и ЛЭКи уведомление о начале КИ (в МЗ) одобрение
- 40. 4. ХОД ИССЛЕДОВАНИЯ Безопасность – рапортирование СНЯ отправить форму на проверку монитору с копией РП направить
- 41. Выплаты
- 42. Счета
- 43. 5. ЗАВЕРШЕНИЕ ИССЛЕДОВАНИЯ
- 44. 5. ЗАВЕРШЕНИЕ ИССЛЕДОВАНИЯ Вывоз или уничтожение препарата/материалов/биообразцов в центре
- 45. 5. ЗАВЕРШЕНИЕ ИССЛЕДОВАНИЯ Подачи в регуляторные органы и ЛЭКи подача о завершении исследования в центре подготовка
- 46. 5. ЗАВЕРШЕНИЕ ИССЛЕДОВАНИЯ архивация Файла Исследователя после завершения КИ и проверки Файла Исследователя Монитором все папки
- 47. 5. ЗАВЕРШЕНИЕ ИССЛЕДОВАНИЯ существуют 2 варианта архивации Файла Спонсора: передача документов в течение КИ передача документов
- 48. Послесловие Коммуникация внутри проекта, выполнение заданий: кто? как? в какие сроки?
- 50. Скачать презентацию










































 Проектная деятельность как фактор повышения качества образовательного процесса в рамках реализации ФГОС
Проектная деятельность как фактор повышения качества образовательного процесса в рамках реализации ФГОС Аттестационная работа. Методическая разработка по выполнению исследовательской работы
Аттестационная работа. Методическая разработка по выполнению исследовательской работы Образотворче мистецтво. Підручник для 5 класу
Образотворче мистецтво. Підручник для 5 класу Индивидуальные образовательные маршруты на этапе дошкольного и начального образования
Индивидуальные образовательные маршруты на этапе дошкольного и начального образования История Кемеровского аграрного техникума
История Кемеровского аграрного техникума Аттестационная работа. Исследование, как метод обучения
Аттестационная работа. Исследование, как метод обучения Учебники и учебные пособия Лапыгина Юрия Николаевича, изданные в центральных издательствах
Учебники и учебные пособия Лапыгина Юрия Николаевича, изданные в центральных издательствах Учебный курс Основы научно-исследовательской деятельности
Учебный курс Основы научно-исследовательской деятельности Особенности проведения ГИА
Особенности проведения ГИА Государственный университет Дубна
Государственный университет Дубна Аттестационная работа. Процесс формирования навыков связных монологических высказываний с детьми с общим недоразвитием речи
Аттестационная работа. Процесс формирования навыков связных монологических высказываний с детьми с общим недоразвитием речи Программно-методический комплекс как условие разработки основной образовательной программы дошкольного образования
Программно-методический комплекс как условие разработки основной образовательной программы дошкольного образования Наука и образование
Наука и образование Аттестационная работа. Исследование для детей младшего школьного возраста Вулканы
Аттестационная работа. Исследование для детей младшего школьного возраста Вулканы Перспектива 24 в 2022 году. Вводная лекция
Перспектива 24 в 2022 году. Вводная лекция Организация обучения детей с ПР по ФГОС НОО ОВЗ
Организация обучения детей с ПР по ФГОС НОО ОВЗ прием в 1 класс 2021
прием в 1 класс 2021 Должностные обязанности классного руководителя и куратора
Должностные обязанности классного руководителя и куратора Организация исследовательской деятельности обучающихся как средство достижения метапредметных результатов образования
Организация исследовательской деятельности обучающихся как средство достижения метапредметных результатов образования Система государственно-общественного управления в образовательном учреждении
Система государственно-общественного управления в образовательном учреждении Воспитание и дополнительное образование в современном образовательном процессе
Воспитание и дополнительное образование в современном образовательном процессе The definition of intensive teaching. (Лекция 1)
The definition of intensive teaching. (Лекция 1) Людина з юридичною освітою - юрист
Людина з юридичною освітою - юрист Проектная деятельность студентов образовательной программы бакалавриата. Изучение научно-технической литературы по теме проекта
Проектная деятельность студентов образовательной программы бакалавриата. Изучение научно-технической литературы по теме проекта Введение в специальность. Бакалавриат СПбПДА. Часть первая: Создание академического текста
Введение в специальность. Бакалавриат СПбПДА. Часть первая: Создание академического текста Современные образовательные технологии и их роль в организации образовательного процесса в вузе
Современные образовательные технологии и их роль в организации образовательного процесса в вузе Аттестационная работа. Проектная деятельность на уроках технологии
Аттестационная работа. Проектная деятельность на уроках технологии Современные подходы к обучению письменной речи и эссе
Современные подходы к обучению письменной речи и эссе