Содержание
- 2. КАТИОН АМОНИЯ Катион аммония NH4 играет роль катиона метала и образует с кислотными остатками соли: NH4NO3
- 3. СОЛИ АММОНИЯ СОЛИ АММОНИЯ – ТВЁРДЫЕ КРИСТАЛИЧЕСКИЕ ВЕЩЕСТВА, ХОРОШО РАСТВОРИМЫЕ В ВОДЕ. по ряду свойств они
- 4. Соли аммония обладают всеми свойствами солей, обусловленными наличием кислотных остатков. Карбонат аммония взаимодействует с кислотами, так
- 5. Третья группа свойств солей аммония – это их способность разлагаться при нагревании с выделением газообразного аммиака,
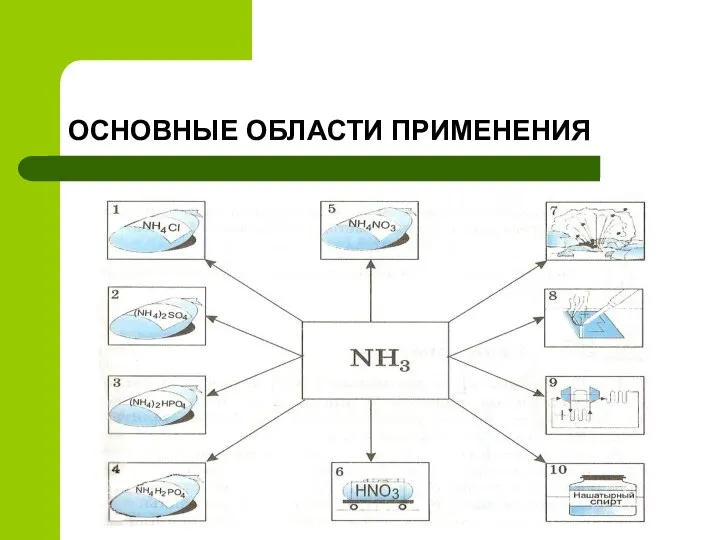
- 6. ОСНОВНЫЕ ОБЛАСТИ ПРИМЕНЕНИЯ
- 8. Скачать презентацию




 Вода – растворитель. Растворимость веществ в воде
Вода – растворитель. Растворимость веществ в воде Классификация металлов
Классификация металлов Растворение. Растворимость веществ в воде
Растворение. Растворимость веществ в воде Анализ качества лекарственных и косметических веществ из группы алифатических кислот и аминокислот
Анализ качества лекарственных и косметических веществ из группы алифатических кислот и аминокислот Диены. Сопряженные диены
Диены. Сопряженные диены Соединения алюминия
Соединения алюминия Количественное определение лекарственных средств
Количественное определение лекарственных средств Комплексные соединения
Комплексные соединения Микробиологическое производство лекарственных средств, регуляторов роста и средств защиты растений
Микробиологическое производство лекарственных средств, регуляторов роста и средств защиты растений Технология получения полимеров
Технология получения полимеров Неметаллы, особенности строения
Неметаллы, особенности строения  Закон сохранения массы вещества и химические уравнения (8 класс)
Закон сохранения массы вещества и химические уравнения (8 класс) Валентность
Валентность Классификация минералов + самородные элементы. Занятие 5
Классификация минералов + самородные элементы. Занятие 5 Методы синтеза коллоидных кристаллов. (Лекция 13)
Методы синтеза коллоидных кристаллов. (Лекция 13) Аттестационная работа. Методика по химии 9 класс Исследовательская деятельность в решении экспериментальных задач
Аттестационная работа. Методика по химии 9 класс Исследовательская деятельность в решении экспериментальных задач Способы очистки воды в быту
Способы очистки воды в быту Щелочные металлы
Щелочные металлы Строение атома
Строение атома Строение атома и периодический закон. (Тема 2)
Строение атома и периодический закон. (Тема 2) Полистирол. Свойства полистирола
Полистирол. Свойства полистирола Липопротеины плазмы крови
Липопротеины плазмы крови Липиды молока и молочных продуктов. Группы липидов
Липиды молока и молочных продуктов. Группы липидов Альдегиды и кетоны
Альдегиды и кетоны Физико-химический процесс элелктролиз. (11 класс)
Физико-химический процесс элелктролиз. (11 класс) Презентация по Химии "ПЛАСТМАСА" - скачать смотреть бесплатно
Презентация по Химии "ПЛАСТМАСА" - скачать смотреть бесплатно Химия липидов
Химия липидов 5 группа элементов
5 группа элементов