Содержание
- 2. Аминокислоты – это бифункциональные органические соединения, в молекулах которых содержатся карбоксильная группа СООН и аминогруппа NH2
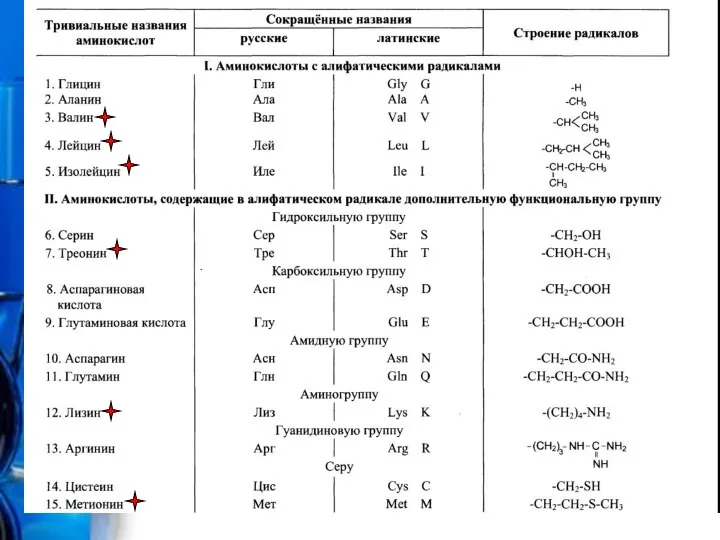
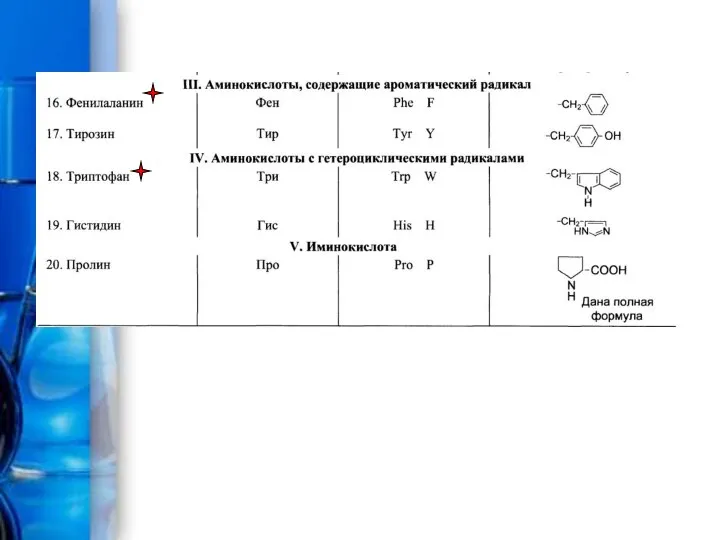
- 3. Протеиногенные аминокислоты Протеиногенными называются 20 аминокислот, которые кодируются генетическим кодом и включаются в белки в процессе
- 6. Химические свойства аминокислот Аминокислоты – амфотерные вещества Как кислоты реагируют: а) с основаниями NH2-CH-COOH + NaOH
- 7. б) со спиртами (этерификация) NH2-CH-COOH+С2Н5ОН NH2-CH-COOС2Н5 + H2O | | R R этиловый эфир аминокислоты Как
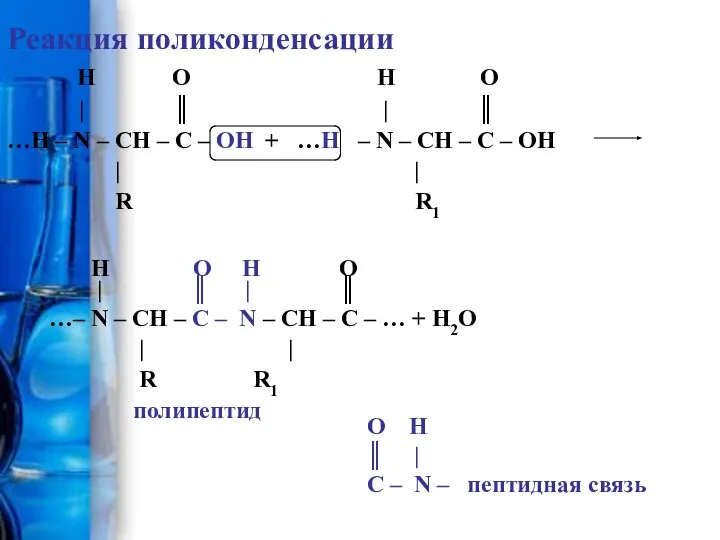
- 8. Реакция поликонденсации H O H O | ║ | ║ …H – N – CH –
- 9. Применение аминокислот Аминокислоты широко используются в современной фармакологии. Некоторые из них выступают в качестве нейромедиаторных веществ.
- 10. Белки белки представляют собой высокомолекулярные органические соединения, построенные из остатков α- аминокислот, соединенных между собой пептидными
- 11. Значение белков белками образованы многие клеточные компоненты, а в комплексе с липидами они входят в состав
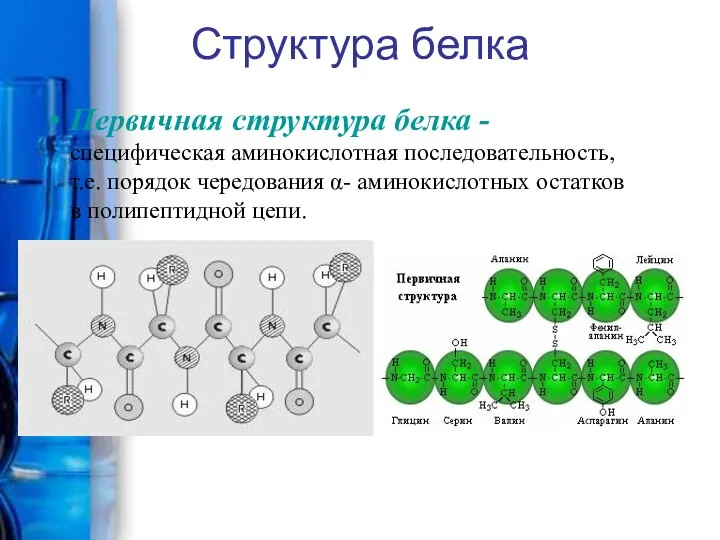
- 12. Структура белка Первичная структура белка - специфическая аминокислотная последовательность, т.е. порядок чередования α- аминокислотных остатков в
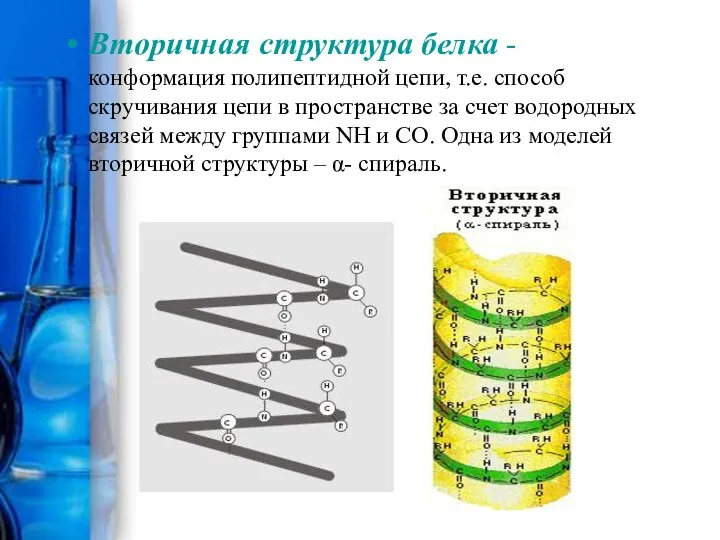
- 13. Вторичная структура белка - конформация полипептидной цепи, т.е. способ скручивания цепи в пространстве за счет водородных
- 14. Третичная структура белка - форма закрученной спирали в пространстве, образованная главным образом за счет дисульфидных мостиков
- 15. Четвертичная структура белка – агрегаты нескольких белковых макромолекул (белковые комплексы), образованные за счет взаимодействия разных полипептидных
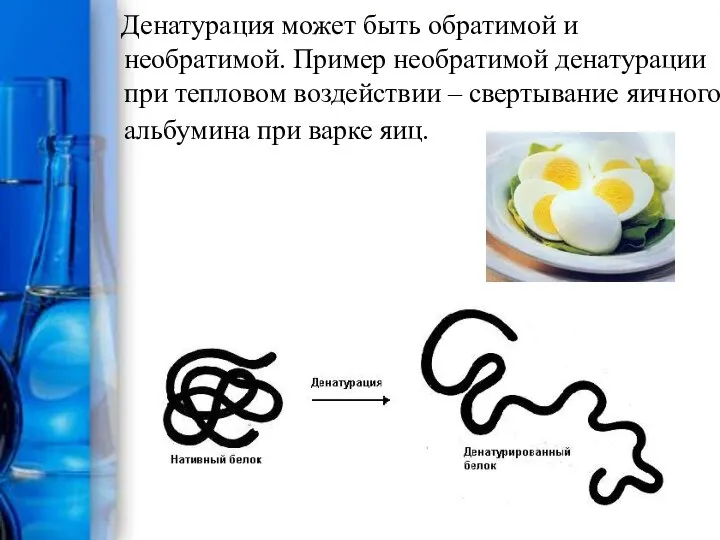
- 16. Денатурация белков Утрата белком природной конформации, сопровождающаяся обычно потерей его биологической функции, называется денатурацией. С точки
- 17. Денатурация может быть обратимой и необратимой. Пример необратимой денатурации при тепловом воздействии – свертывание яичного альбумина
- 18. Гидролиз белков – разрушение первичной структуры белка под действием кислот, щелочей или ферментов, приводящее к образованию
- 20. Скачать презентацию











 Ферменти. Історія вчення про ферменти
Ферменти. Історія вчення про ферменти Генетическая связь между классами неорганических веществ
Генетическая связь между классами неорганических веществ Биогеохимия: основные понятия, история развития, практическое значение идей биогеохимии
Биогеохимия: основные понятия, история развития, практическое значение идей биогеохимии Диоксины, глобальные экотоксиканты
Диоксины, глобальные экотоксиканты Электроматериаловедение
Электроматериаловедение Мило. Синтетичні миючі засоби.
Мило. Синтетичні миючі засоби.  Аминокислоты
Аминокислоты Изменение в составе ядер атомов. Изотопы
Изменение в составе ядер атомов. Изотопы Презентация по Химии "Отчет по месячнику химии" - скачать смотреть
Презентация по Химии "Отчет по месячнику химии" - скачать смотреть  Дисперсные системы: общая характеристика и классификация
Дисперсные системы: общая характеристика и классификация Кристаллы
Кристаллы История развития контролируемой радикальной полимеризации. Управление ростом полимерной цепи нитроксильными радикалами
История развития контролируемой радикальной полимеризации. Управление ростом полимерной цепи нитроксильными радикалами Нитраты в продуктах
Нитраты в продуктах Антибиотики-аминогликозиды: получение, свойства, исследование и применение. Связь между химическим строением и действием
Антибиотики-аминогликозиды: получение, свойства, исследование и применение. Связь между химическим строением и действием Элементы химической термодинамики и биоэнергетики
Элементы химической термодинамики и биоэнергетики Алюминий – металл будущего
Алюминий – металл будущего Тема : Спирты Презентация по химии Ученицы 11 «Б» класса ЗОШ №41 Зануды Татьяны
Тема : Спирты Презентация по химии Ученицы 11 «Б» класса ЗОШ №41 Зануды Татьяны  Предельные углеводороды и их галогенопроизводные. Спирты, эфиры, альдегиды и их производные
Предельные углеводороды и их галогенопроизводные. Спирты, эфиры, альдегиды и их производные Полиазометины (полишиффовы основания)
Полиазометины (полишиффовы основания) Химия и производство. Химическая промышленность и химические технологии
Химия и производство. Химическая промышленность и химические технологии Химическое равновесие
Химическое равновесие Алкалоиды. Классификация алкалоидов:
Алкалоиды. Классификация алкалоидов: Растворы
Растворы Хімія та обмін ліпідів
Хімія та обмін ліпідів Водорастворимые витамины
Водорастворимые витамины Теория сплавов
Теория сплавов Серебро - химический элемент в периодической таблице с атомным номером 47. 8 класс
Серебро - химический элемент в периодической таблице с атомным номером 47. 8 класс Моя профессия химик-аналитик
Моя профессия химик-аналитик