Содержание
- 2. Электролизом называют совокупность окислительно-восстановительных процессов, происходящих на электродах под действием постоянного электрического тока.
- 3. ЭЛЕКТРОЛИЗЕР – электрохимическая ячейка, в которой проводят электролиз растворов или расплавов веществ.
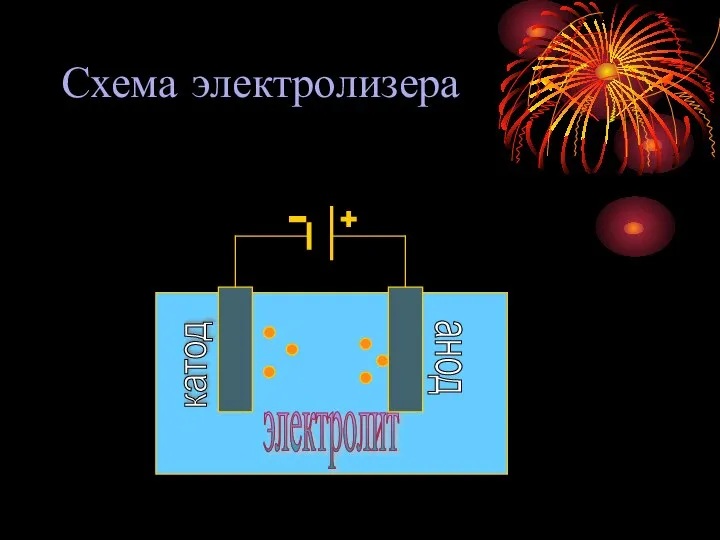
- 4. СОСТАВ ЭЛЕКТРОЛИЗЕРА ЭЛЕКТРОЛИТ – раствор или расплав вещества, который проводит электрический ток вследствие распада молекул данного
- 5. АНОД – электрод, который подключен к положительному полюсу источника питания (ПРОЦЕСС ОКСИЛЕНИЯ) КАТОД - электрод, который
- 6. Схема электролизера анод катод электролит
- 7. ЭЛЕКТРОЛИЗ РАСПЛАВОВ ПРИМЕР: схема электролиза расплава хлорида магния MgCl2 В расплаве данного электролита содержатся ионы: Mg
- 8. КАТОД (-) : процесс восстановления Mg + 2e Mg АНОД (+) : процесс окисления 2Сl -
- 9. ЭЛЕКТРОЛИЗ РАСТВОРОВ В данном случае в окислительно-восстановительных процессах, происходящих на электродах возможно участие молекул ВОДЫ (Н2О)
- 10. Возможные процессы на катоде Если металл расположен в ряду напряжений после водорода (Cu, Hg, Ag, Pt,
- 11. 2. Если металл расположен от начала ряда напряжений до Al включительно (Li, Na, K, Mg и
- 12. 3. Если металл расположен в ряду напряжений между Al и водородом (Zn, Fe, Ni, Mn и
- 14. Возможные процессы на аноде Если анод растворимый (Fe, Zn, Al, Сu и др.), то окисляется металл
- 15. 2. Если анод не растворяется (инертный – графит, Au, Pt и др.), то: анионы, не содержащие
- 16. ПРИМЕР: схема электролиза раствора сульфата магния MgSO4 В растворе существуют ионы Mg и SO4 КАТОД (-)
- 18. Скачать презентацию














 Занимательные опыты
Занимательные опыты Великий Ломоносов Работу выполнила учитель химии МБОУ «СОШ №27 с углубленным изучением отдельных предметов» Карташова Л.А.
Великий Ломоносов Работу выполнила учитель химии МБОУ «СОШ №27 с углубленным изучением отдельных предметов» Карташова Л.А. Круговорот воды в природе
Круговорот воды в природе Белки простые и сложные
Белки простые и сложные Олиго- и гомополисахариды
Олиго- и гомополисахариды Презентация по теме”химик- технолог.”
Презентация по теме”химик- технолог.” Щелочноземельные металлы Учитель МОУ СОШ № 130 Разнополова О.П.
Щелочноземельные металлы Учитель МОУ СОШ № 130 Разнополова О.П. Краун-эфиры
Краун-эфиры Rb-Sr метод
Rb-Sr метод Белки. Изучение органических веществ в 9-10 классе
Белки. Изучение органических веществ в 9-10 классе Исследовательская работа на тему: Лед и соль
Исследовательская работа на тему: Лед и соль Презентация по Химии "Химия в разных науках" - скачать смотреть
Презентация по Химии "Химия в разных науках" - скачать смотреть  Предмет химии
Предмет химии Введение в геологию и минералогию
Введение в геологию и минералогию Номенклатура и изомерия алканов. Углерод и водород
Номенклатура и изомерия алканов. Углерод и водород Живая и мертвая вода
Живая и мертвая вода Вуглецеві матеріали
Вуглецеві матеріали Адсорбция-фазалар бөлу беттерінде жүретін бір компоненттің екінші компонентке сіңуі
Адсорбция-фазалар бөлу беттерінде жүретін бір компоненттің екінші компонентке сіңуі Эфиры. 10 класс
Эфиры. 10 класс Общая и неорганическая химия. Введение
Общая и неорганическая химия. Введение Кислоты в свете ТЭД их классификация и свойства
Кислоты в свете ТЭД их классификация и свойства Альдегиды и кетоны. Карбоновые и дикарбоновые кислоты
Альдегиды и кетоны. Карбоновые и дикарбоновые кислоты Коллоидтық химия және беттік құбылыстар химиясының негізгі түсініктемелері
Коллоидтық химия және беттік құбылыстар химиясының негізгі түсініктемелері Природные и синтетические красители и ароматизаторы
Природные и синтетические красители и ароматизаторы Свойства растворов ВМС
Свойства растворов ВМС Многоядерные Арены
Многоядерные Арены Строение и свойства аминокислот и белков
Строение и свойства аминокислот и белков Effect of anodizing parameters on growth of selfordering TiO2
Effect of anodizing parameters on growth of selfordering TiO2