Содержание
- 2. Al 13 Алюміній (лат. Aluminium) 3 8 2 26,9815 3s2 3p1 Порядковий номер. Хімічний елемент III
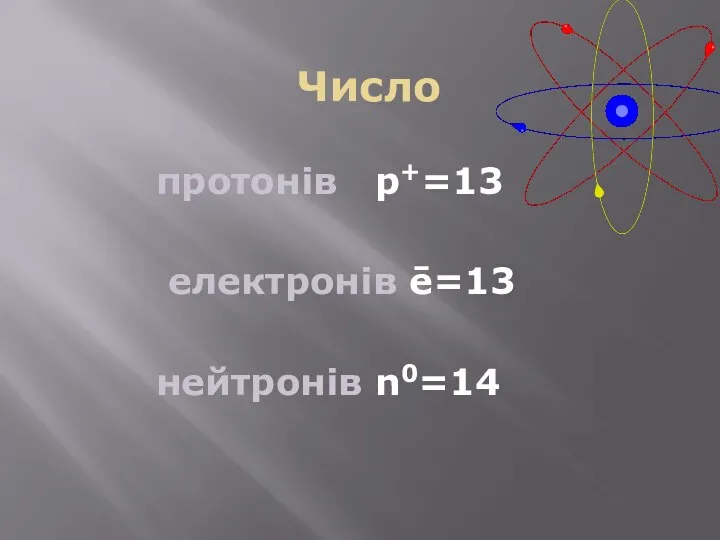
- 3. Число протонів p+=13 електронів ē=13 нейтронів n0=14
- 4. Схема розташування електронів на енергетичних рівнях +13Al 1s2 2s2 2p6 3s2 3p1 1s 2s 2p 3s
- 5. Al – типовий амфотерний елемент Відновлювальні властивості Al 0- 3ē Al+3 Тип хімічного зв'язку - металевий
- 6. Фізичні властивості речовини Al – срібно-білий метал, пластичний, легкий, добре проводить тепло и електричний струм, легко
- 7. Особливості фізичних і хімічних властивостей алюмінія, його місце в природі і застосування: Алюміній – найросповсюдженіший метал
- 8. Алюміній реагує з простими речовинами - неметалами 4Al+3O2 = 2Al2O3 Поверхня покривається плівкою оксиду, в подрібеному
- 9. Алюміній реагує з складними речовинами : Алюміній розчиняється в розчинах кислот 2Al + 6HCl = 2AlCl3
- 10. Алюміній реагує з складними речовинами 3. Алюміній при високій температурі реагує з оксидами менш активних металів
- 11. Алюміній реагує з складними речовинами 4.Так як алюміній – амфотерний метал, він реагує з розчинами лугів.
- 12. Добування алюмінію Алюміній добувають електролізом розчину глинозему у розплавленому кріоліті (Na3AlF6) і електролізом розплаву AlCl3
- 13. Застосування Al
- 14. Поширеність алюмінію В природі алюміній зустрічається тільки в виді сполук і по розповсюдженості в земній корі
- 15. Оксид алюмінію Al2О3: Дуже твердий (корунд, рубін) в кристалічному стан, порошок білого кольору, тугоплавкий - 20500С.
- 16. Гідроксид алюмінію Al(ОН)3 Білий нерозчинний в воді порошок. Проявляє амфотерні властивості, взаємодіє: а) з кислотами Al
- 18. Скачать презентацию













 История изучения структуры белка Лайнус Полинг считается первым учёным, который смог успешно предсказать вторичную структуру
История изучения структуры белка Лайнус Полинг считается первым учёным, который смог успешно предсказать вторичную структуру Метаболизм липидов. Характеристика липидов. Значение. Представители. Эйкозаноиды. (Лекция 1-2)
Метаболизм липидов. Характеристика липидов. Значение. Представители. Эйкозаноиды. (Лекция 1-2) Алюминий
Алюминий Хиральные производные тиомочевины и скуарамидов в асимметрическом катализе
Хиральные производные тиомочевины и скуарамидов в асимметрическом катализе Углеводы. Структуры углеводов
Углеводы. Структуры углеводов Строение белков
Строение белков Жидкие кристаллы
Жидкие кристаллы Радиоактивный распад. Чернобыль
Радиоактивный распад. Чернобыль Процессы в растворах: электролитическая диссоциация (ЭД) Презентация подготовлена учителем биологии и химии МОУ СОШ д.Городищ
Процессы в растворах: электролитическая диссоциация (ЭД) Презентация подготовлена учителем биологии и химии МОУ СОШ д.Городищ Нуклеїнові кислоти
Нуклеїнові кислоти Соли
Соли Презентация по Химии "Органічні речовини в живій природі. Рівні структурної організіції органічних речовин" - скачать смотре
Презентация по Химии "Органічні речовини в живій природі. Рівні структурної організіції органічних речовин" - скачать смотре Углеводы: простые и сложные. Строение, свойства и биологическая роль
Углеводы: простые и сложные. Строение, свойства и биологическая роль Кристаллы. Монокристалл
Кристаллы. Монокристалл Предмет коллоидной химии. Общая характеристика дисперсных систем
Предмет коллоидной химии. Общая характеристика дисперсных систем Аттестационная работа. Программа элективного курса «Исследовательская проектная деятельность при изучении химии»
Аттестационная работа. Программа элективного курса «Исследовательская проектная деятельность при изучении химии» Алкадиены (диены)
Алкадиены (диены) Горение. Подводный факел
Горение. Подводный факел Взаимодействие кислоты с основанием
Взаимодействие кислоты с основанием Углеводороды нефти. Алканы. Парафины Циклоалканы. Нафтены Ароматические углеводороды. Арены
Углеводороды нефти. Алканы. Парафины Циклоалканы. Нафтены Ароматические углеводороды. Арены Современные углеродные наноматериалы: технологии получения и применения в промышленности Сергей Филатов
Современные углеродные наноматериалы: технологии получения и применения в промышленности Сергей Филатов  Пептиды. Белки
Пептиды. Белки Анилин. Строение. Физические и химические свойства
Анилин. Строение. Физические и химические свойства Механізми та наслідки ураження людини небезпечними хімічними речовинами та бойовими отруйними речовинами
Механізми та наслідки ураження людини небезпечними хімічними речовинами та бойовими отруйними речовинами ОВР в органической химии
ОВР в органической химии Растворы жидкие, твердые, газообразные
Растворы жидкие, твердые, газообразные Оксиды Na
Оксиды Na Свинец
Свинец