Содержание
- 2. Изотопы (изос - одинаковый, топос - место) - нуклиды (виды, разновидности атомов) с разным массовым числом
- 3. Нуклиды, атомы с одинаковым числом нейтронов (n0), но разным массовым числом (М) и числом протонов (р),
- 4. Нуклиды, атомы с одинаковым массовым числом (М), но разным числом протонов (р) и нейтронов (n0), называются
- 5. В природе известно около 350 изотонов и более 150 изобаров. Более тысячи изотопов получены искусственно и
- 6. Особенности изотопов Природные изотопы делятся на 2 группы - стабильные и радиоактивные. До № 83 (Bi)
- 7. У легких элементов с четным порядковым номером или четным числом протонов широко распространены самые легкие изотопы
- 8. Наибольшее число изотопов отмечено у четных элементов середины таблицы (Хе - 9 изотопов, Sn - 10
- 9. Радиоактивность Радиоактивность – способность некоторых изотопов самопроизвольно распадаться с испусканием элементарных частиц и образованием ядра другого
- 10. Ядра, обладающие свойством самопроизвольно распадаться, называются радиоактивными. Ядра, не имеющие таких свойств, называются стабильными. Радиоактивный распад
- 11. α-распад - вид радиоактивного распада ядра, в результате которого происходит испускание альфа-частицы. α-распад заключается в способности
- 12. β -распад — тип радиоактивного распада, обусловленного слабым взаимодействием и изменяющего заряд ядра на единицу. При
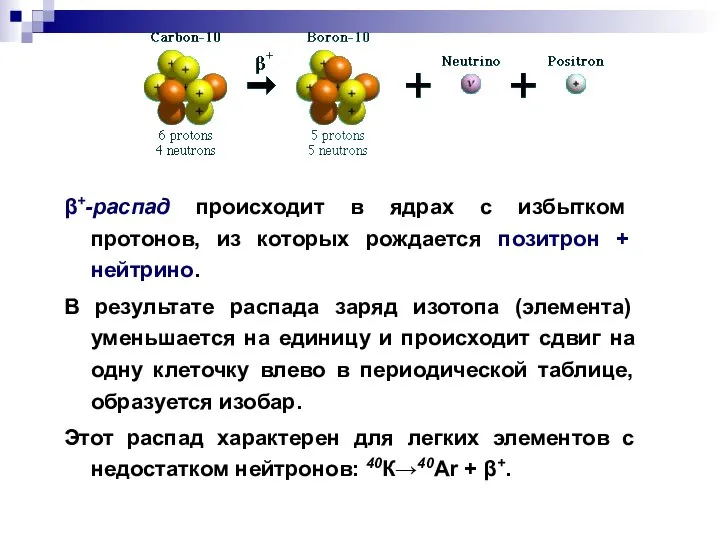
- 13. β+-распад происходит в ядрах с избытком протонов, из которых рождается позитрон + нейтрино. В результате распада
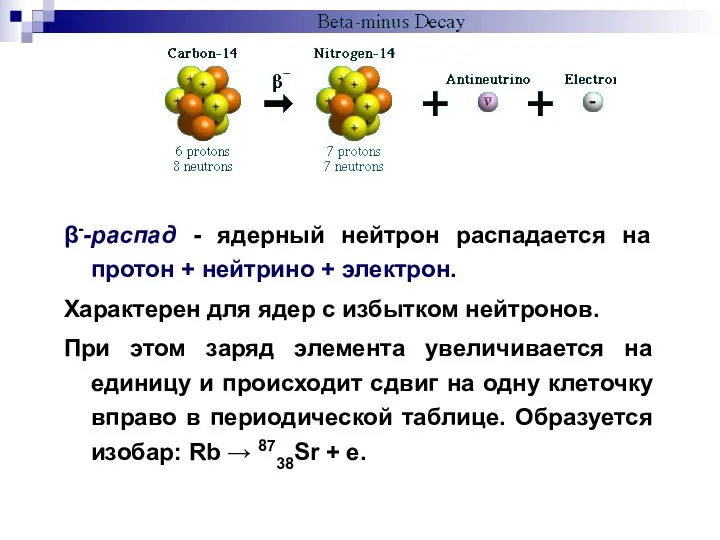
- 14. β--распад - ядерный нейтрон распадается на протон + нейтрино + электрон. Характерен для ядер с избытком
- 15. «К-захват» характерен для ядер с избытком протонов, которые превращаются в нейтроны в результате захвата орбитального электрона
- 16. При «К-захвате» образуется изобар, происходит сдвиг на одну клеточку влево в периодической таблице. Пример: 4019К +
- 17. γ-излучение - не приводит к изменению ядра, обусловлено переходом возбужденного (радиоактивного) ядра в основное (стабильное) состояние,
- 18. Это жесткое излучение, с очень короткими длинами волн (10-8 см), обладает большой проникающей способностью. При γ-распаде
- 19. Спонтанное деление – деление или раскалывание на два сравнимых по массе осколка с испусканием нескольких нейтронов,
- 21. Радиоактивный распад – явление статистическое. Скорость распада радиоактивных ядер не зависит от внешних причин, т.е. процессов,
- 22. За определенный период времени распадается какое-то количество радиоактивных ядер и образуются стабильные изотопы, т.е. распад происходит
- 23. Закон радиоактивного распада: 1) N0 = Nt*eλt или 2) Nt = N0*e-λt, где N0 - первоначальное
- 24. – константа распада является специфической для каждого радионуклида. не зависит от формы химического соединения, в которое
- 25. Т-период полураспада - это время, за которое количество атомов радиоактивного элемента убывает, уменьшается вдвое, т.е. скорость
- 26. Период полураспада Т можно вычислить по той же формуле радиоактивного распада, так как постоянная распада обратно
- 27. Основной закон радиоактивного распада: Число распавшихся атомов за единицу времени пропорционально первоначальному числу атомов Со временем
- 28. Абсолютная геохронология Зная скорость распада радиоактивного элемента (изотопа), соотношение его изотопов (распространенности, %), продукты распада –
- 29. Для элементов конца периодической таблицы характерны сложные серии или ряды распада. Детально изучены три ряда радиоактивного
- 30. Урановый ряд В результате перехода в стабильный радиогенный свинец произошла потеря 8 α-частиц ([238-206]/4=8), что сопровождалось
- 31. Актино-урановый ряд в результате α- и β--распада 235U образовался стабильный радиогенный изотоп 207Pb и произошла потеря
- 32. Ториевый ряд В результате α- и β--распада 232Th образовался стабильный радиогенный изотоп 208Pb и освободилось 6
- 33. Характерной особенностью радиоактивных превращений является их необратимость и смена тяжелых атомов более легкими.
- 34. Свинцово-свинцовый метод, или метод обыкновенного (породного) свинца Используются отношения радиогенных изотопов свинца к первичному, нерадиогенному 204Рb,
- 35. Возраст определяется по независимым отношениям 206Pb/204Pb, 207Pb/204Pb, 208Pb/204Pb в свинцовых минералах, в основном – в галените.
- 36. Допускается, что изотопный состав руд после отделения его от магмы в составе гидротерм не изменяется и
- 37. Метод датирования по породному свинцу был применен для определения возраста железных и каменных метеоритов, свинец которых
- 38. В основе Sm - Nd модельного метода лежит процесс превращения радиоактивного изотопа самария 147Sm в радиогенный
- 39. Sm и Nd являются редкоземельными элементами и входят в состав основных породообразующих минералов, а также большинство
- 40. Калий-аргоновый метод. Калий - 3 изотопа (это исключение для нечетного элемента), распространенность в %: 3919К –
- 41. 40К распадается двумя путями: Первый вид «К-захват»: 4019К → 4020Са в результате β-–распада образуется изобар 40Са.
- 42. Этот метод получил широкое распространение, использовались преимущественно калиевые полевые шпаты и слюды. Скоро было замечено, что
- 43. Устойчивыми к потере аргона являются амфиболы. При оценке возраста осадочных пород, особенно протерозойских (рифейских, синийских), исключительное
- 44. Рубидий-стронциевый метод Рубидий - 2 изотопа (нечетный элемент), распространенность (в %): 8537Rb – 72,15 – стабильный
- 45. В результате β- -распада 87Rb переходит в 87Sr образуется изобар: Распад рубидия происходит очень медленно, поэтому
- 46. При выборе минералов необходимо учитывать, что пути рубидия и стронция расходятся к концу магматического процесса и
- 47. Рубидий не дает своих минералов и, являясь полным геохимическим аналогом калия, следует за ним в виде
- 48. За время существования Земли прирост радиогенного стронция (87Sr) составил 7 %. За эталон прироста 87Sr взят
- 49. Доля первоначального стронция, захваченного минералом в процессе кристаллизации, оценивается измерением отношения 87Sr/86Sr в сосуществующих неизмененных минералах,
- 50. За первичное отношение, характеризующее первоначальный стронций земной коры, принято отношение 87Sr/86Sr в ахондритовых метеоритах – 0,698;
- 51. Рубидий-стронциевый метод применим для датировки возраста магматических и метаморфических пород. Для последних наиболее надежны валовые изохроны,
- 52. Отношение 87Sr/86Sr было использовано для решения вопроса о происхождении карбонатитов. Rb-Sr-метод успешно используется для определения возраста
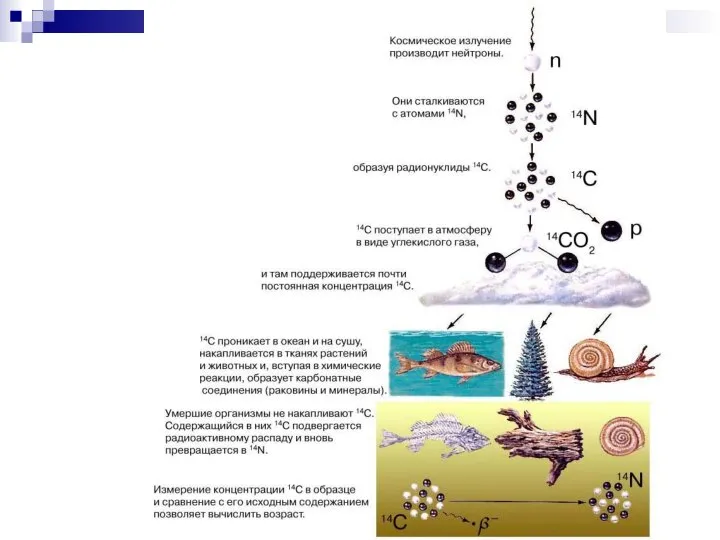
- 53. Радиоуглеродный метод Углерод - 3 изотопа: 126C (98,892 %), 136C (1,11 %) – стабильные изотопы и
- 55. Период полураспада 14С – 5730 лет, что позволяет использовать его только для определения возраста молодых объектов:
- 56. В основе всех методов лежат следующие положения: радиоактивный распад протекает с определенной постоянной скоростью; известны постоянные
- 57. известны конечные продукты – стабильные радиогенные изотопы – как сложных изотопных превращений (ряды распада), так и
- 58. известны все ныне существующие и существовавшие радиоактивные элементы. В основе всего должны лежать достоверные геологические наблюдения
- 59. Изотопный анализ геологических объектов
- 60. Изотопное отношение характеризуется величиной отклонения от стандарта (δ), измеряемой в промилле (‰) (десятая часть процента): No
- 61. Надежность методов изотопной геохимии обусловлена достоверностью знаний о фракционировании изотопов в конкретных геологических процессах. Причем важно
- 62. Фракционирование легких стабильных изотопов вызывается внешними процессами, зависит от них и носит обратимый характер, в отличие
- 63. I. Физико-химические процессы Реакции изотопного обмена при подвижных равновесных процессах Абсорбция и катионный обмен Диффузия газов
- 64. II. Биогенные процессы Биогенные процессы: фотосинтез, жизнедеятельность организмов (в частности, бактерий) и др.
- 65. Стабильные изотопы в геологии Изотопы углерода Углерод имеет 3 изотопа: 126C, 136C – стабильные изотопы 14С
- 66. За стандарт принято отношение 13С/12С углерода карбоната кальция (белемнит из меловых отложений Южной Каролины) – PDB.
- 67. Избыточная δ13С по отношению к стандарту обозначается знаком «+», а дефицитная - знаком «−». Прирост тяжелого
- 68. Весовой кларк С в земной коре небольшой – 0,35, атомный – 0,51, однако соединения углерода являются
- 69. Однонаправленные химические реакции и равновесные процессы приводят к разделению изотопов. Так, реакции изотопного обмена происходят в
- 70. Бикарбонатные анионы морской воды обогащены 13С и морские осадки, состоящие из органического вещества (раковины, скелеты) отличаются
- 71. Соотношение изотопов 12С и 13С в карбонатных циклах [Дегенс, 1967]
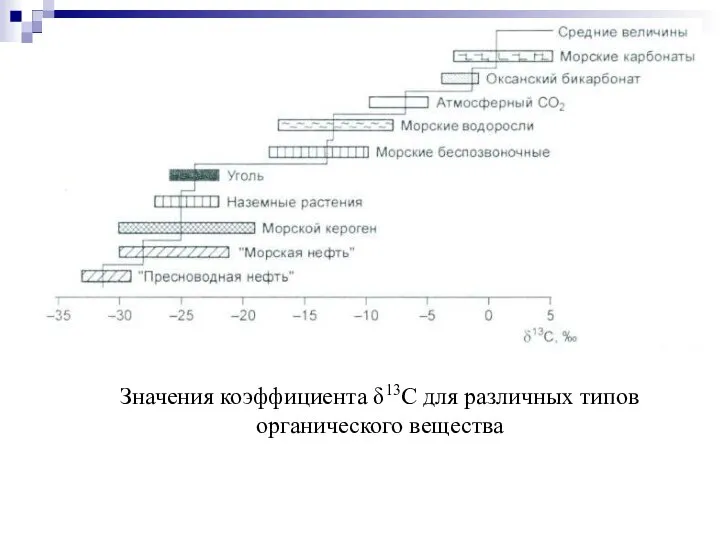
- 72. Значения коэффициента δ13С для различных типов органического вещества
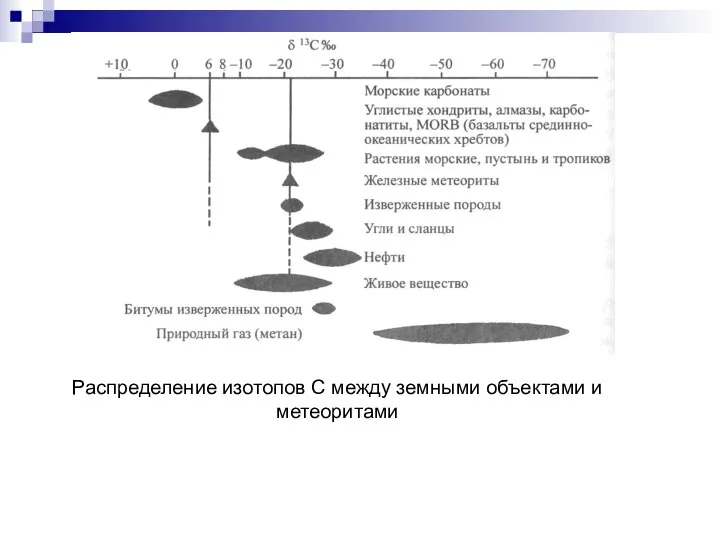
- 73. Распределение изотопов С между земными объектами и метеоритами
- 74. Отмечено, что фракционирование (разделение) изотопов С интенсивнее протекает при низких температурах, т.е. углерод осадочных известняков более
- 75. Изотопы серы Сера - это четный элемент типа 4q, весовой кларк – 0,10 %, атомный =
- 76. Прирост тяжелого изотопа серы определяется по формуле δ34S со знаком «+» показывает на обогащение 34S или
- 77. Эффективное фракционирование серы отмечается при окислительно–восстановительных процессах, которые могут проходить как при участии живых организмов (биогенное
- 78. Сера в природе выступает в нескольких валентных состояниях: S0 – нулевая валентность самородной серы, S2- –
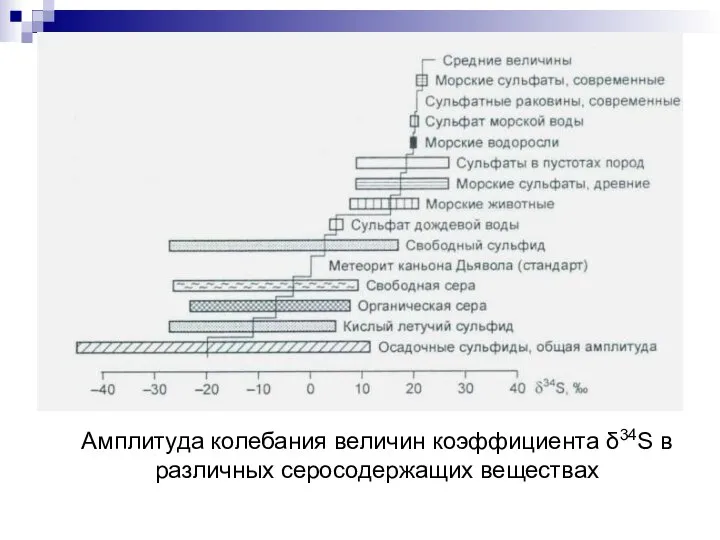
- 79. Амплитуда колебания величин коэффициента δ34S в различных серосодержащих веществах
- 80. Распределение изотопов S между различными объектами (сводная таблица)
- 81. Изотопы кислорода Кислород - самый распространенный элемент в земной коре. У кислорода три изотопа: 16О (распространенность
- 82. На практике пользуются отношением 18O/16O В качестве мантийного стандарта (хондриты, ультраосновные породы) принято значение 5,7.
- 83. Разделение изотопов кислорода является следствием обменных реакций изотопного равновесия. Вариации состава (δ18O) в породах, минералах, воде,
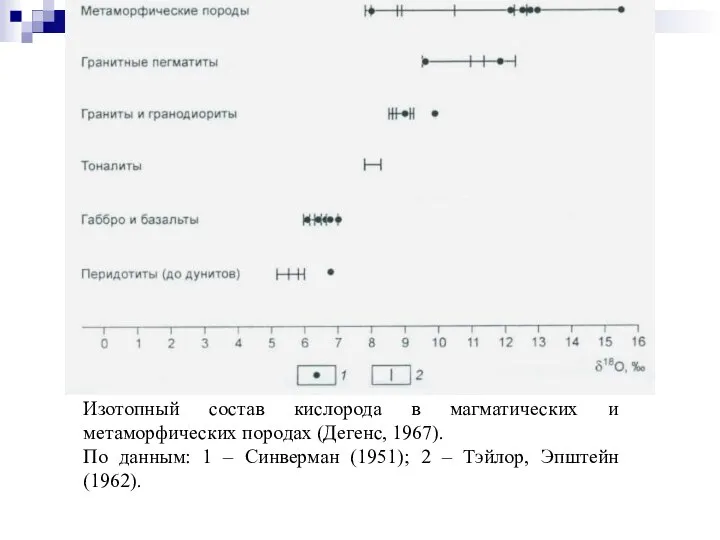
- 84. Изотопный состав кислорода в магматических и метаморфических породах (Дегенс, 1967). По данным: 1 – Синверман (1951);
- 85. Изменение величины 18O/16O в карбонатах и кремнистых породах с геологическим возрастом [Дегенс, 1967]
- 86. Утяжеление кислорода атмосферы происходило за счет тяжелого кислорода воды, поступающей из глубин земли (ювениальная вода). Изотопный
- 88. Скачать презентацию

































































![Соотношение изотопов 12С и 13С в карбонатных циклах [Дегенс, 1967]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1398046/slide-70.jpg)









![Изменение величины 18O/16O в карбонатах и кремнистых породах с геологическим возрастом [Дегенс, 1967]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1398046/slide-84.jpg)

 Строение атома. Строение электронных оболочек атомов
Строение атома. Строение электронных оболочек атомов Анализ лекарственных средств неорганических соединений натрия: натрия гидрокарбонат, натрия тиосульфат, натрия нитрит
Анализ лекарственных средств неорганических соединений натрия: натрия гидрокарбонат, натрия тиосульфат, натрия нитрит Тема урока: СЕРНАЯ КИСЛОТА И ЕЁ СВОЙСТВА
Тема урока: СЕРНАЯ КИСЛОТА И ЕЁ СВОЙСТВА Коррозия металлов
Коррозия металлов Презентация по химии Общая характеристика реакций органических соединений. Классификация органических реакций и реагентов.
Презентация по химии Общая характеристика реакций органических соединений. Классификация органических реакций и реагентов.  Верхівцевький НВК. Верхівцевький НВК. Учитель хімії Кукса Наталія Миколаївна
Верхівцевький НВК. Верхівцевький НВК. Учитель хімії Кукса Наталія Миколаївна  Атомно-кристаллическое строение материалов
Атомно-кристаллическое строение материалов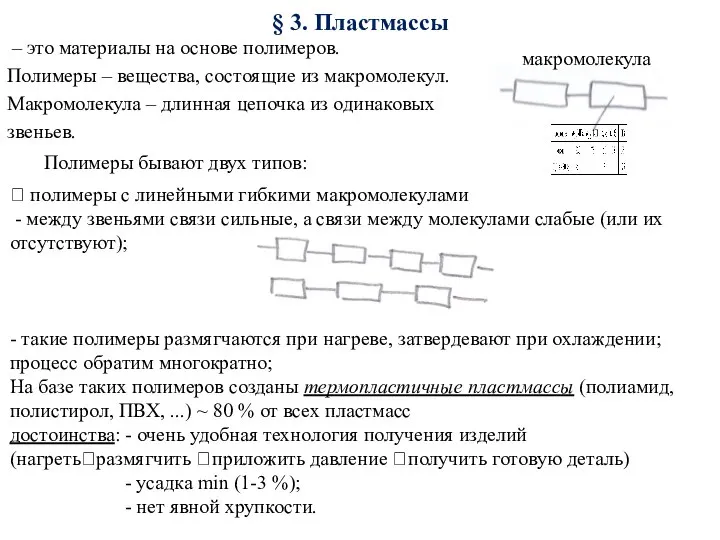 Пластмассы. Материалы, устойчивые против агрессивой среды
Пластмассы. Материалы, устойчивые против агрессивой среды Структурные превращения стали 15Х5М при различных режимах термической обработки
Структурные превращения стали 15Х5М при различных режимах термической обработки Курс «Неорганическая химия» Лектор: Третьяков Юрий Дмитриевич Расписание лекций: вторник – 10:50 – 12:25 пятни
Курс «Неорганическая химия» Лектор: Третьяков Юрий Дмитриевич Расписание лекций: вторник – 10:50 – 12:25 пятни Физические и химические свойства железа Учитель химии МОУ СОШ №97 Новикова Ирина Владимировна Урок химии в 9 классе
Физические и химические свойства железа Учитель химии МОУ СОШ №97 Новикова Ирина Владимировна Урок химии в 9 классе Методы защиты металлов от электрохимической коррозии
Методы защиты металлов от электрохимической коррозии Презентация на тему: Хром
Презентация на тему: Хром Химический элемент фосфор. Фосфор в составе ДНК и РНК
Химический элемент фосфор. Фосфор в составе ДНК и РНК Методика изучения периодического закона, периодической системы Д.И. Менделеева и строения атома
Методика изучения периодического закона, периодической системы Д.И. Менделеева и строения атома Классы неорганических веществ
Классы неорганических веществ Пищевая сода
Пищевая сода Вакуумная перегонка мазута
Вакуумная перегонка мазута Галогены
Галогены Углеводы. Классификация углеводов
Углеводы. Классификация углеводов Амфотерность. Амфотерные соединения
Амфотерность. Амфотерные соединения Обмен липидов
Обмен липидов 热塑性复合材料的分类及特性
热塑性复合材料的分类及特性 Эквиваленты веществ. Жидкое состояние, растворы
Эквиваленты веществ. Жидкое состояние, растворы Электронное строение атома
Электронное строение атома Органические соединения в атмосфере
Органические соединения в атмосфере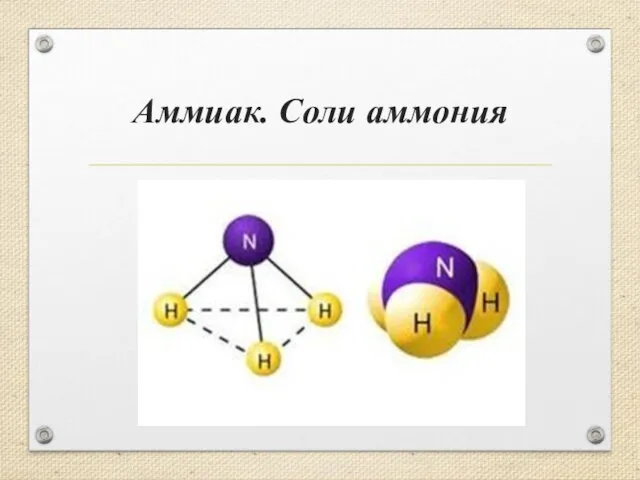 урок
урок Вещества, входящие в состав живых организмов
Вещества, входящие в состав живых организмов