Содержание
- 2. Цель: определить характер оксидов металлов, имеющихся в школьной лаборатории (оксиды бария, железа, кальция, меди, свинца), изучить
- 3. Внешний вид оксидов Оксид кальция - легкий белый порошок, похожий на муку, тугоплавкий. Температура плавления 26270С,
- 4. Оксид свинца (II) – «массикот»- желтый порошок. Плотность 9,5 г/см3. Термически устойчив, температура плавления 8880С, температура
- 5. Растворение в воде
- 6. Оксиды меди, свинца и железа не растворяются в воде. Оксиды кальция и бария растворяются в воде,
- 7. Реакция оксида бария с водой сопровождается наибольшим выделением теплоты среди всех оксидов металлов второй группы. Этот
- 8. Оксид кальция Как основный оксид реагирует с кислотными оксидами и кислотами, образуя соли: CaO + SO2
- 9. Оксид бария Как основный оксид реагирует с кислотными оксидами и кислотами, образуя соли: ВaO + СO2
- 10. Оксид железа Амфотерный оксид с большим преобладанием основных свойств. Медленно реагирует с кислотами и щелочами. Fe2О3
- 11. Оксид меди При взаимодействии с кислотами образуются соли: CuO + H2SO4 = CuSO4 + H2O С
- 12. Оксид свинца Проявляет амфотерные свойства, реагирует с кислотами и щелочами. PbО + 2СН3СООН = Pb (СН3СОО)2
- 13. Выводы Оксиды кальция и бария растворяются в воде с образованием оснований. Оксиды меди, свинца и железа
- 15. Скачать презентацию












 1_Bazovye_raschetnye_formuly
1_Bazovye_raschetnye_formuly Гетерофункциональные органические соединения
Гетерофункциональные органические соединения Свойства катализатора. Влияние массы катализатора на скорость реакции
Свойства катализатора. Влияние массы катализатора на скорость реакции Отбор проб товаров для анализа. Химико-аналитический контроль
Отбор проб товаров для анализа. Химико-аналитический контроль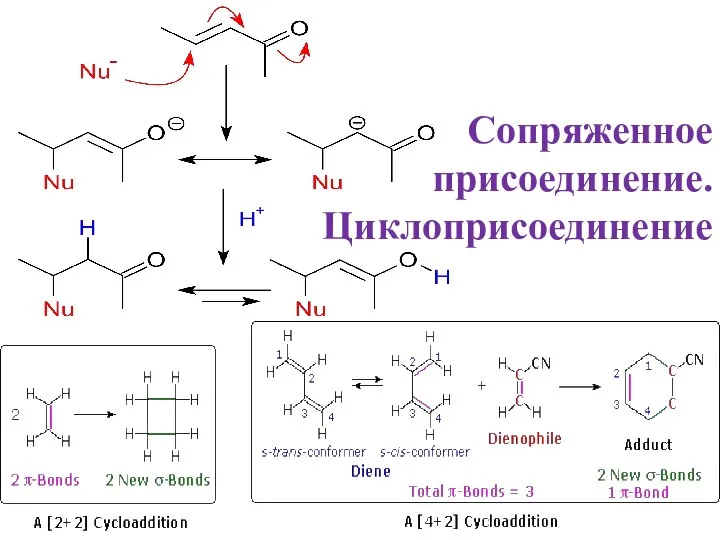 Сопряженное присоединение. Циклоприсоединениеie
Сопряженное присоединение. Циклоприсоединениеie Масс-спектрометрия (МС)
Масс-спектрометрия (МС) Классификации, номенклатура, строение и свойства органических соединений
Классификации, номенклатура, строение и свойства органических соединений Великие ученые XIX-XX веков
Великие ученые XIX-XX веков Презентация Электролиты
Презентация Электролиты Атоми і хімічні елементи. Молекули, їх рух. Дифузія
Атоми і хімічні елементи. Молекули, їх рух. Дифузія Производство шампуня. Технология
Производство шампуня. Технология 140 лет дому, который построил Д.И. Менделеев
140 лет дому, который построил Д.И. Менделеев 160198375
160198375 Презентация Лекарства дома
Презентация Лекарства дома Биохимия. Введение
Биохимия. Введение Углеводы (моносахариды, олигосахариды, полисахариды)
Углеводы (моносахариды, олигосахариды, полисахариды) Автомобильные бензины
Автомобильные бензины Силикатная промышленность
Силикатная промышленность Кислоты
Кислоты Виробництво біогазу Виконав: студент IV курсу групи БЛБ-43з Вила Віктор
Виробництво біогазу Виконав: студент IV курсу групи БЛБ-43з Вила Віктор  Хроматографические методы анализа
Хроматографические методы анализа Электролиз
Электролиз Оксиды. Химические свойства
Оксиды. Химические свойства Основные законы химии. Законы и формулировки
Основные законы химии. Законы и формулировки Метод крутого восхождения или метод Бокса-Уилсона. Симплексный метод оптимизации
Метод крутого восхождения или метод Бокса-Уилсона. Симплексный метод оптимизации Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Кислород. Свойства кислорода
Кислород. Свойства кислорода Валентность химических элементов (8 класс)
Валентность химических элементов (8 класс)