Содержание
- 2. химические элементы металлы неметаллы (Ca,Na,Mg) (S, P,Cl) основные оксиды кислотные оксиды (CaO,Na2O) (SO3, P2O5) основания кислоты
- 3. Простые вещества металлы неметаллы (Ca,Na,Mg) (S, P,Cl) 1. Твердые (искл.Hg) 1.Твердые,жидкие,газы 2.Металлический блеск 2.Не имеют мет.
- 4. Группы сходных элементов (естественные семейства) Щелочные металлы - Li, Na, K, Rb, Cs (самые активные металлы,
- 5. Открытие периодического закона Днём открытия периодического закона считается 1 марта (17 февраля по старому стилю) 1869
- 6. Открытие периодического закона Написав на карточках основные свойства каждого элемента Менделеев начинает многократно переставлять эти карточки,
- 7. Закономерности в изменении свойств элементов, простых веществ и соединений В рядах элементов, которые начинаются щелочным металлом
- 8. Формулировка периодического закона Д.И. Менделеева Свойства простых тел, а также формы и свойства соединений элементов находятся
- 9. Значение периодического закона Д.И. Менделеева Открытие периодического закона и создание Периодической таблицы химических элементов имеет огромное
- 11. Скачать презентацию








 Природные и попутные нефтяные газы
Природные и попутные нефтяные газы Майлардың анықтамасы
Майлардың анықтамасы Общая радиохимия. Свойства радиоколлоидов
Общая радиохимия. Свойства радиоколлоидов Строение атома углерода
Строение атома углерода Да здравствует мыло душистое
Да здравствует мыло душистое Химические и физико-химические методы анализа. Сущность и методы качественного анализа
Химические и физико-химические методы анализа. Сущность и методы качественного анализа Фосфорні добрива. Технології збагачення фосфоровмісної сировини
Фосфорні добрива. Технології збагачення фосфоровмісної сировини Уравнения химических реакций
Уравнения химических реакций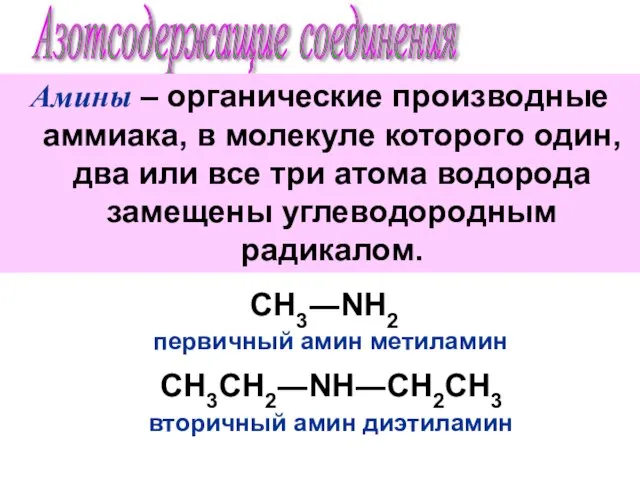 Азотсодержащие соединения. Амины
Азотсодержащие соединения. Амины Оборудование для дистилляции мисцеллы
Оборудование для дистилляции мисцеллы Гидролиз. Сущность процесса гидролиза
Гидролиз. Сущность процесса гидролиза Электронные эффекты заместителей. Типы химических реакций
Электронные эффекты заместителей. Типы химических реакций Исследовательский проект «Кристаллы»
Исследовательский проект «Кристаллы» Минералы. Классы минералов
Минералы. Классы минералов Спирты
Спирты Гидролиз. Виды гидролиза
Гидролиз. Виды гидролиза Пищевые добавки
Пищевые добавки Основания и кислоты. Тема 2
Основания и кислоты. Тема 2 Зміна ліпідів за технологічної обробки
Зміна ліпідів за технологічної обробки Презентация по Химии "Степень окисления" - скачать смотреть бесплатно_
Презентация по Химии "Степень окисления" - скачать смотреть бесплатно_ Презентация по Химии "Высшие природные полимеры - Белки и Нуклеиновые кислоты" - скачать смотреть
Презентация по Химии "Высшие природные полимеры - Белки и Нуклеиновые кислоты" - скачать смотреть  Области применения спиртов
Области применения спиртов Применение синтетических полимеров в вооружении
Применение синтетических полимеров в вооружении Пластик, пластмасса
Пластик, пластмасса Распознавание химических соединений
Распознавание химических соединений Основы безопасности при уничтожении химического оружия
Основы безопасности при уничтожении химического оружия Сера и ее аллотропные модификации. (9 класс)
Сера и ее аллотропные модификации. (9 класс) Виды химической связи
Виды химической связи