Содержание
- 2. Лекция 2 Неравновесные электрохимические методы. Полярография постоянного тока. Вольтамперометрия.
- 3. Полярография и Вольтамперометрия Вольтамперометрия (ВА) – электрохимический метод анализа, основанный на интерпретации зависимости между силой тока
- 4. Возникновение метода Ярослав Гейровский, 1922 г., Прага (Чехия) Полярограф Я. Гейровского и М. Шикаты 1959 г.
- 5. Схема полярографической установки 1 — источник напряжения; 2 — реохорд; 3 — вольтметр; 4 — анод
- 6. Полярографическая ячейка Состоит из двух или (чаще) из трех электродов: Индикаторного электрода – Ртутно-капающего электрода (РКЭ)
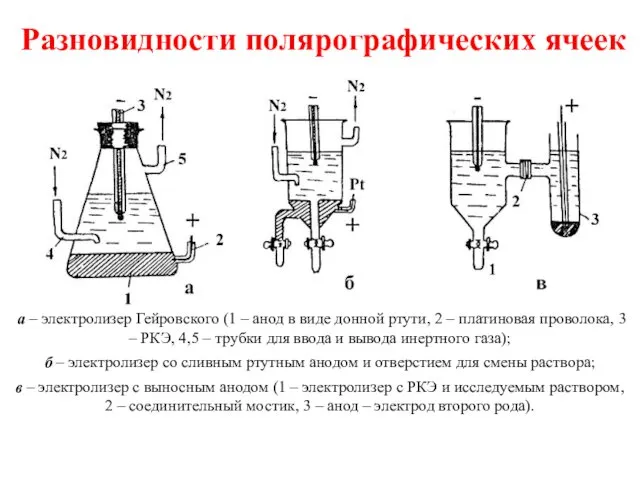
- 7. Разновидности полярографических ячеек а – электролизер Гейровского (1 – анод в виде донной ртути, 2 –
- 8. Ртутно-капающий электрод Внешний вид коммерческого РКЭ, производства фирмы Metrohm (Швейцария) «Особенности» РКЭ Жидкая Высокое поверхностное натяжение
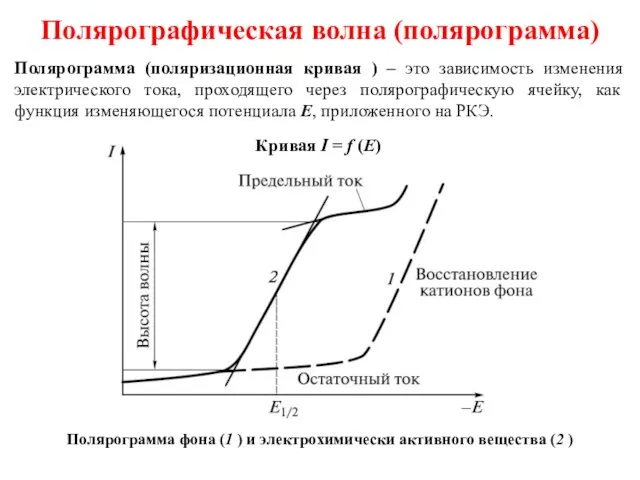
- 9. Полярографическая волна (полярограмма) Полярограмма (поляризационная кривая ) – это зависимость изменения электрического тока, проходящего через полярографическую
- 10. Потенциал полуволны Потенциалом полуволны E1/2 называется значение потенциала, при котором происходит возрастание силы тока до половины
- 11. Остаточный ток Остаточный ток (Iост). состоит из фарадеевского тока IF и тока заряжения IC (емкостного тока).
- 12. Модель двойного электрического слоя Величина IC зависит от потенциала и площади поверхности электрода: Ic = k
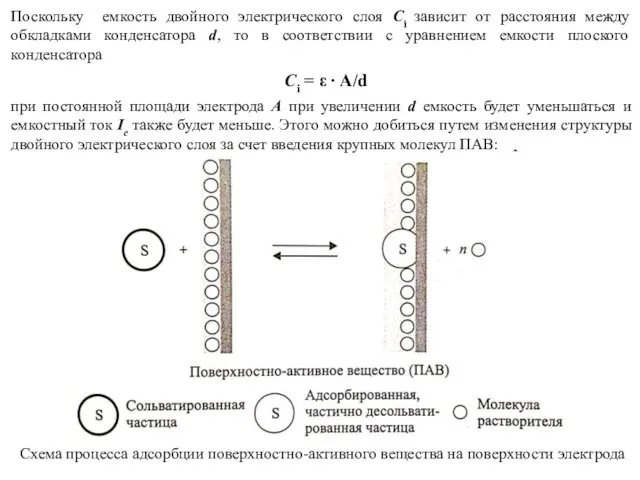
- 13. Поскольку емкость двойного электрического слоя Ci зависит от расстояния между обкладками конденсатора d, то в соответствии
- 14. ПАВы, применяемые в ВА Triton X-100 Агар-агар
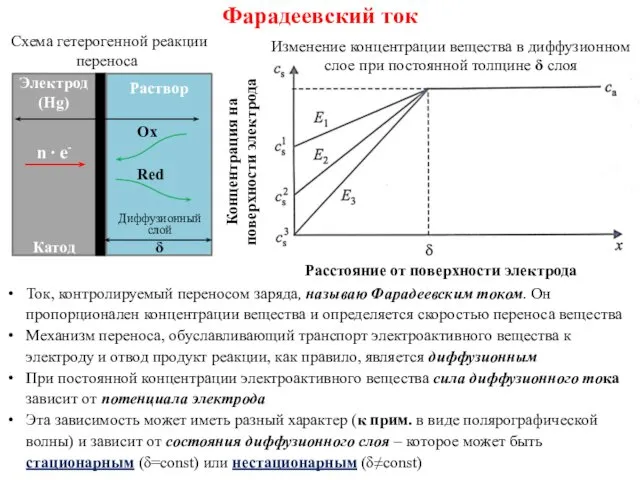
- 15. Фарадеевский ток Ток, контролируемый переносом заряда, называю Фарадеевским током. Он пропорционален концентрации вещества и определяется скоростью
- 16. Предельный ток
- 17. Уравнение Д. Ильковича
- 18. Уравнение Гейровского-Ильковича где aM(Hg), CM(Hg) — соответственно активность и концентрация металла в амальгаме; fМ(Hg), fMn+ —
- 20. Графическое решение уравнения обратимой волны => При температуре 25 °С наклон должен быть равен 0,059/n В
- 23. Природа предельного тока Доставка электрохимически активного вещества из глубины раствора к поверхности электрода (массоперенос) может осуществляться
- 24. Устранение конвекционного и миграционного токов Для устранения конвекционного тока Iк измерения проводят без перемешивания раствора! Для
- 25. Факторы, влияющие на величину диффузионного тока
- 26. Кинетические и каталитические токи CE-процесс: ЕС-процесс:
- 27. Если кинетический ток усиливается за счет протекания последующей химической реакции, то он называется каталитическим током Iкат
- 28. Факторы, влияющие на форму полярограммы При измерении диффузионного тока Id необходимо учитывать, что на форму полярограммы
- 29. Максимумы первого рода вызваны неравномерной поляризацией поверхности ртутной капли. Максимумы первого рода в свою очередь подразделяют
- 30. Присутствие растворенного кислорода В фоновом растворе, контактирующем с воздухом, присутствует растворенный кислород, концентрация которого в насыщенных
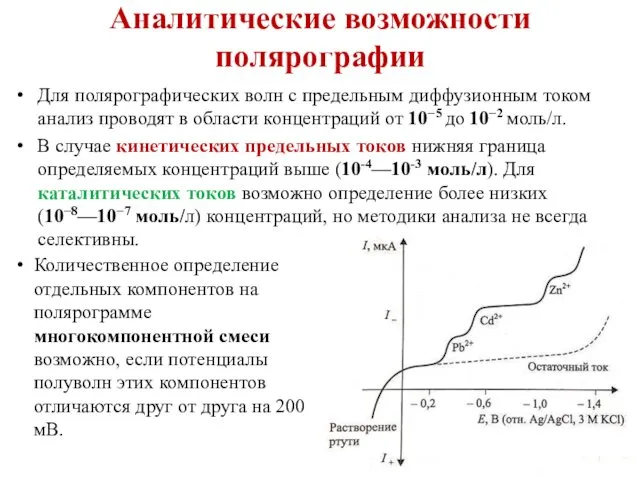
- 31. Аналитические возможности полярографии Для полярографических волн с предельным диффузионным током анализ проводят в области концентраций от
- 32. Приборы в полярографии
- 34. Скачать презентацию


























 Органикалық қосылыстардың химиялық құрылыс теориясы, органикалық қосылыстардың структурасы және қосылыстары
Органикалық қосылыстардың химиялық құрылыс теориясы, органикалық қосылыстардың структурасы және қосылыстары Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях Технология коллоидов и наносистем. Лекция 4. Физико-химические основы нуклеации и технологии формирования новой фазы
Технология коллоидов и наносистем. Лекция 4. Физико-химические основы нуклеации и технологии формирования новой фазы Каустобиолиты, горючие полезные ископаемые органического происхождения
Каустобиолиты, горючие полезные ископаемые органического происхождения Әртүрлі заттардың кристаллдық тор энергиясын, сольваттану энергиясын, гидратация жылуын есептеу
Әртүрлі заттардың кристаллдық тор энергиясын, сольваттану энергиясын, гидратация жылуын есептеу Определение химии, как науки
Определение химии, как науки Коррозия металлов
Коррозия металлов Методика проведения исследовательской части работы по химии и экологии учитель химии и биологии высшей
Методика проведения исследовательской части работы по химии и экологии учитель химии и биологии высшей Химические свойства хрома
Химические свойства хрома Железо в сплавах и природе. Состав железа
Железо в сплавах и природе. Состав железа λ-MnO2 as material with pseudocapacitive properties
λ-MnO2 as material with pseudocapacitive properties Disperse systems. True solution
Disperse systems. True solution Витамин В2 (рибофлавин)
Витамин В2 (рибофлавин) Полімери
Полімери Синтез Aspergillin PZ
Синтез Aspergillin PZ Radical reactions. Decarboxylative alkenylations and alkynylations
Radical reactions. Decarboxylative alkenylations and alkynylations Презентация по Химии "Углеводы" - скачать смотреть
Презентация по Химии "Углеводы" - скачать смотреть  Нанопорошки металлов и их применение в технологии керамических материалов
Нанопорошки металлов и их применение в технологии керамических материалов Иерархия основных классов технологических процессов. Выражение составов фаз
Иерархия основных классов технологических процессов. Выражение составов фаз s-елементи ІІ А групи: Берилій, Магній і лужноземельні елементи. Властивості елементів ІІ А групи
s-елементи ІІ А групи: Берилій, Магній і лужноземельні елементи. Властивості елементів ІІ А групи Электролиз: его применение
Электролиз: его применение Презентация на тему: «Глюкоза» ученицы 11 класса Широковской ООШ Галаган Юлии Юрьевны
Презентация на тему: «Глюкоза» ученицы 11 класса Широковской ООШ Галаган Юлии Юрьевны  Жидкостная хроматография
Жидкостная хроматография Приемы обращения с лабораторным оборудованием. Строение пламени
Приемы обращения с лабораторным оборудованием. Строение пламени Жири, склад жирів, їх утворення. Гідроліз та гідрування жирів. Жири в природі. Біологічна роль жирів
Жири, склад жирів, їх утворення. Гідроліз та гідрування жирів. Жири в природі. Біологічна роль жирів Исследование равновесия в системе газ-жидкость
Исследование равновесия в системе газ-жидкость ИЗОМЕРИЯ И СТРОЕНИЕ КС. СПОСОБНОСТЬ АТОМОВ РАЗЛИЧНЫХ ЭЛЕМЕНТОВ К КОМПЛЕКСООБРАЗОВАНИЮ. УСТОЙЧИВОСТЬ КС Лектор: канд. хим. н
ИЗОМЕРИЯ И СТРОЕНИЕ КС. СПОСОБНОСТЬ АТОМОВ РАЗЛИЧНЫХ ЭЛЕМЕНТОВ К КОМПЛЕКСООБРАЗОВАНИЮ. УСТОЙЧИВОСТЬ КС Лектор: канд. хим. н Застосування неметалів
Застосування неметалів