Содержание
- 2. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
- 3. КРИТЕРИИ ОЦЕНИВАНИЯ Ответ правильный и полный, содержит следующие элементы: (2 балла): -выбраны вещества и записано уравнение
- 4. КРИТЕРИИ ОЦЕНИВАНИЯ Ставится 1 балл, если выбраны вещества из списка и составлено молекулярное уравнение окислительно-восстановительной реакции
- 5. КРИТЕРИИ ОЦЕНИВАНИЯ Дополнительные рекомендации, которые необходимо учитывать в случае проблемных ситуаций: в качестве исходных веществ (окислителя
- 6. КРИТЕРИИ ОЦЕНИВАНИЯ Дополнительные рекомендации, которые необходимо учитывать в случае проблемных ситуаций. степень окисления 0 может не
- 7. КРИТЕРИИ ОЦЕНИВАНИЯ Экзаменуемый может: в качестве окислителя и восстановителя указать элементы в соответствующей строчке электронного баланса,
- 8. КАК СПРАВИТЬСЯ? Ищем соединения с низшими степенями окисления (типичные восстановители) и с высшими степенями (типичные окислители)
- 9. КАК СПРАВИТЬСЯ?
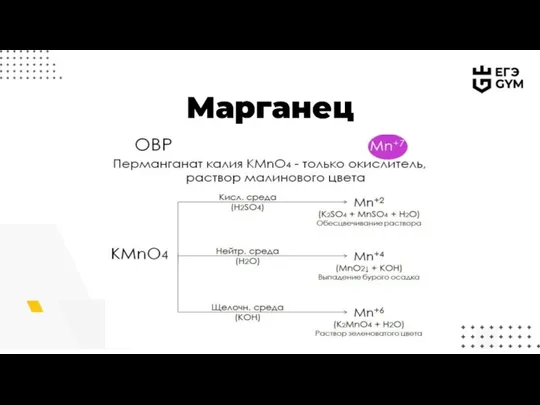
- 10. Марганец
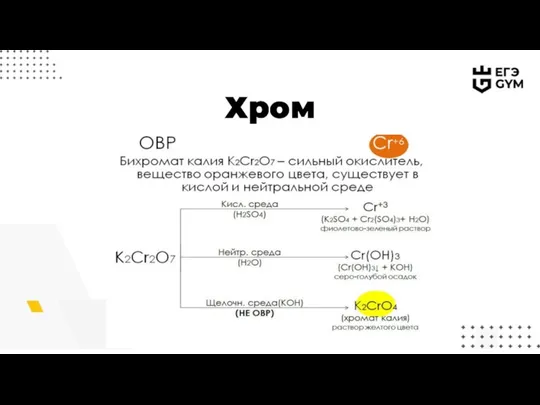
- 11. Хром
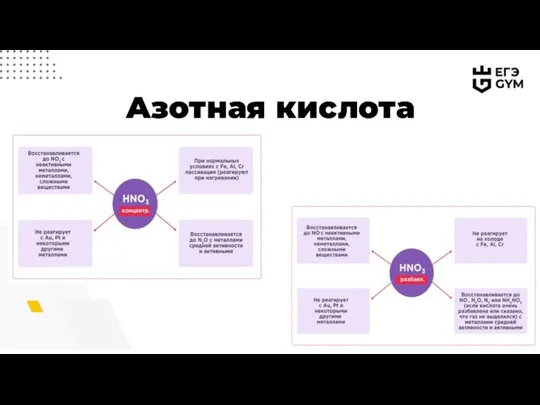
- 12. Азотная кислота
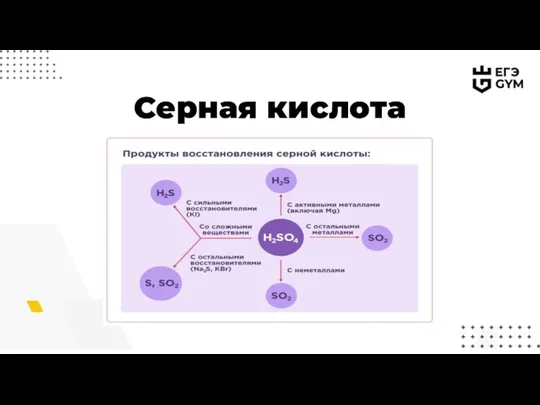
- 13. Серная кислота
- 14. Галогены
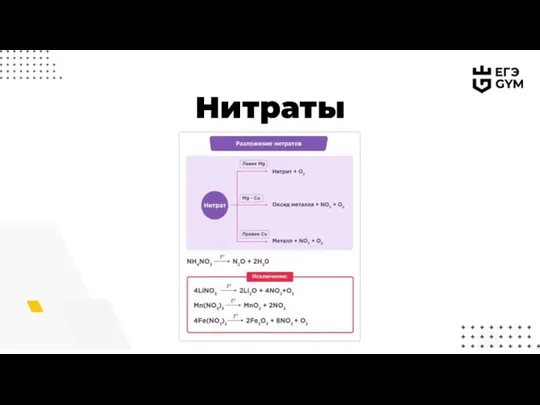
- 15. Нитраты
- 16. Фосфор C кислотами-окислителями: P + HNO3(конц.) → PH3 + HNO3(конц.) → P + H2SO4(конц.) → P
- 17. Сера C кислотами-окислителями: S/H2S + HNO3(конц.) → S/H2S + H2SO4(конц.) → S + HNO3(разб.) →
- 18. КАК СПРАВИТЬСЯ? Что видим? -Щёлочь На что обращаем внимание? -Есть ли галоген, ведь на холоду или
- 19. КАК СПРАВИТЬСЯ? Что видим? -Нитриты, сульфиты На что обращаем внимание? -Если есть марганцовка – ОВР готово.
- 20. КАК СПРАВИТЬСЯ? Что видим? -Галоген На что обращаем внимание? -Щелочь (диспропорционирование) или галогенид другого галогена, стоящего
- 21. КАК СПРАВИТЬСЯ? Что видим? -Галогеноводород На что обращаем внимание? -Окислители (KMnO4, K2MnO4, MnO2, K2Cr2O7, PbO2) -
- 22. КАК СПРАВИТЬСЯ? Что видим? -Галогениды На что обращаем внимание? -Вытеснение галогена из его соли более активным
- 23. КАК СПРАВИТЬСЯ? Что видим? -Марганцовка На что обращаем внимание? -Нитриты, сульфиты (см. пункт выше), галогеноводород (получение
- 24. КАК СПРАВИТЬСЯ? Что видим? -Конц. азотная или серная кислоты На что обращаем внимание? -Подойдут металлы (как
- 25. КАК СПРАВИТЬСЯ? Что видим? -Аммиак На что обращаем внимание? -Взаимодействие с оксидом меди (II), можно марганцовку
- 26. КАК СПРАВИТЬСЯ? Что видим? -Сера На что обращаем внимание? -Взаимодействие с щёлочью (образование сульфида и сульфита),
- 27. КАК СПРАВИТЬСЯ? Что видим? -Сероводород На что обращаем внимание? -Взаимодействие с окислителями (KMnO4, K2Cr2O7, конц. HNO3
- 28. КАК СПРАВИТЬСЯ? Что видим? -Сульфиды На что обращаем внимание? -Окислители (KMnO4, K2Cr2O7) - до чистой серы.
- 30. Скачать презентацию






















 Вклад Д.И. Менделеева и Г. Менделя в развитие наук
Вклад Д.И. Менделеева и Г. Менделя в развитие наук Основы коррозии и защиты металлов. Виды коррозии металлов
Основы коррозии и защиты металлов. Виды коррозии металлов Электролитическая диссоциация
Электролитическая диссоциация Органическая химия: «Жиры» Орлова Ольга Николаевна Школа №357 Приморского р-на.
Органическая химия: «Жиры» Орлова Ольга Николаевна Школа №357 Приморского р-на.  Описание оврага или обнажения (методика проведения практической работы на контрольном туристском маршруте, в походе)
Описание оврага или обнажения (методика проведения практической работы на контрольном туристском маршруте, в походе) Polivinilpirrolidon-limon turşusunun Na duzu-su ikifazalı sisteminin fizikikimyəvi xassələri
Polivinilpirrolidon-limon turşusunun Na duzu-su ikifazalı sisteminin fizikikimyəvi xassələri Химические свойства алканов
Химические свойства алканов Презентация по Химии "Амінокислоти" - скачать смотреть
Презентация по Химии "Амінокислоти" - скачать смотреть  Основы химической коррозии
Основы химической коррозии Химические свойства и получение насыщенных одноатомных спиртов
Химические свойства и получение насыщенных одноатомных спиртов Презентация по Химии "Соли" - скачать смотреть
Презентация по Химии "Соли" - скачать смотреть  Конструкционные функциональные волокнистые композиты
Конструкционные функциональные волокнистые композиты Ртуть. История
Ртуть. История Периодический закон и периодическая система Д.И. Менделеева (Лекция 2)
Периодический закон и периодическая система Д.И. Менделеева (Лекция 2) Процессы коксования
Процессы коксования Презентация по Химии "Органическая химия" - скачать смотреть бесплатно
Презентация по Химии "Органическая химия" - скачать смотреть бесплатно Малоугловое рассеяние нейтронов и рентгеновских лучей в исследованиях золь-гель материалов
Малоугловое рассеяние нейтронов и рентгеновских лучей в исследованиях золь-гель материалов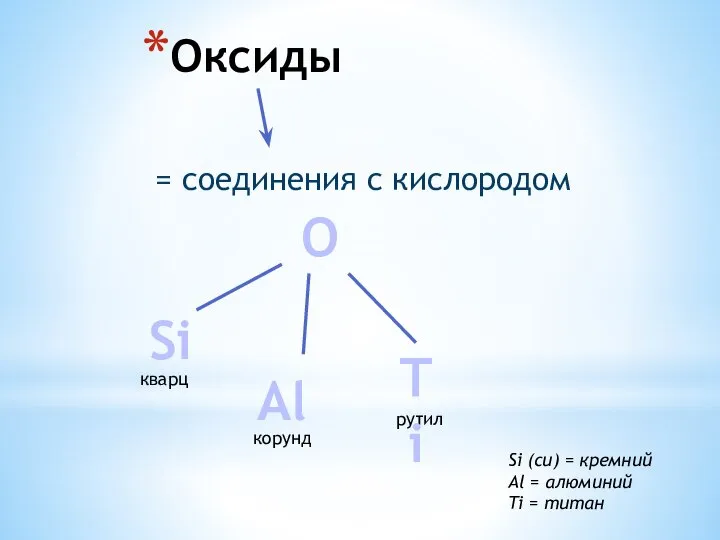 Оксиды. Кварц (SiO2). Корунд (Al2O3)
Оксиды. Кварц (SiO2). Корунд (Al2O3) Аминокислоты
Аминокислоты Электронное строение атома. Периодический закон
Электронное строение атома. Периодический закон Вода. Физические и химические свойства
Вода. Физические и химические свойства Общие способы получения металлов
Общие способы получения металлов Fiber. Iron. Calcium
Fiber. Iron. Calcium Гидролиз. Лекция 03-2
Гидролиз. Лекция 03-2 Періодична система Д.І.Менделєєва
Періодична система Д.І.Менделєєва Комплексономертиялық титрлеу. Дәріс № 6
Комплексономертиялық титрлеу. Дәріс № 6 Обмен нуклеотидов
Обмен нуклеотидов Муниципальное образовательное учреждение «Лицей №3» Секция: Химия НАУЧНО-ИССЛЕДОВАТЕЛЬСКАЯ РАБОТА «ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ ИНД
Муниципальное образовательное учреждение «Лицей №3» Секция: Химия НАУЧНО-ИССЛЕДОВАТЕЛЬСКАЯ РАБОТА «ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ ИНД