Содержание
- 2. Условие задачи Существует мнение, что в металлической посуде вредно готовить и хранить кислую еду, например, капустные
- 3. Цель: выявить, возможность химических процессов между металлами-материалами посуды и кислыми щами Задачи: Определить, какие химические процессы
- 4. Ограничения Состав материалов кастрюль определяется названием материала и не загрязнен дополнительными примесями: Медь = чистая медь
- 5. Классификация щей Полные (богатые) Зеленые Постные Рыбные Сборные Серые Суточные 7. В.В. Похлебкин. Большая кулинарная книга.
- 6. Ограничения Щи — это заправочный многокомпонентный суп. В полный набор продуктов для щей входят следующие компоненты:
- 7. Теоретическая часть решения задачи
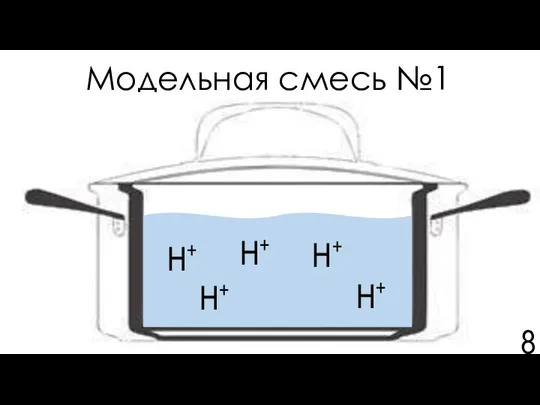
- 8. Модельная смесь №1 Представляем вам модельную смесь №1 – водный раствор слабой кислоты.
- 9. Обоснование выбора модельной смеси Щи = гетерогенная смесь, состоящая из водной фазы и органосодержащих фаз и
- 10. Чем определяется рН модельной смеси? Михайлов В.А., Сорокина О.В., Савинкина Е.В., Давыдова М.Н.; под ред. Академика
- 11. рН щей = рН модельной смеси. Какой он? Самый надежный рН-метр находится у каждого во рту.
- 12. Куда пропала часть кастрюли? 2Cu0+ 4H+ + O2(р-р) = 2Cu2+ + 2H2O 2Sn0+ 4H+ + O2(р-р)
- 13. Куда пропала часть кастрюли? 2Sn0+ 4H+ = 2Sn2+ + 2H2 4Al0+ 12H+ = 4Al3+ + 6H2
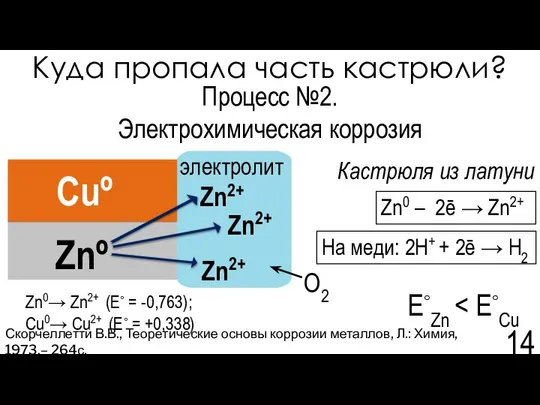
- 14. Куда пропала часть кастрюли? Скорчеллетти В.В., Теоретические основы коррозии металлов, Л.: Химия, 1973,– 264с. Процесс №2.
- 15. Куда пропала часть кастрюли? Скорчеллетти В.В., Теоретические основы коррозии металлов, Л.: Химия, 1973,– 264с. Процесс №2.
- 16. Модельная смесь №2 [Ме+n(орг.л-ды)-k2n]n-2kn Н+ Которая представляет собой водный раствор слабой кислоты с органическими лигандами
- 17. Обоснование выбора модельной смеси Ионы металлов в водном растворе могут связываться координационные соединения – комплексы Мы
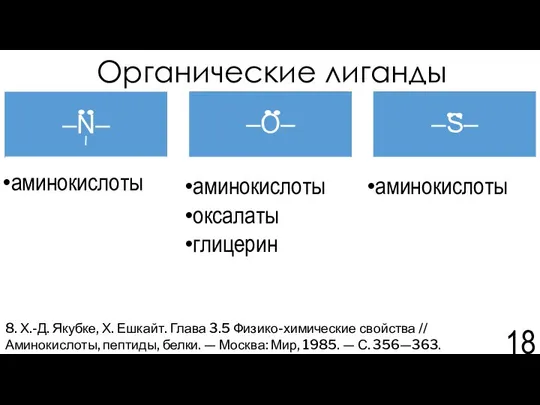
- 18. Органические лиганды 8. Х.-Д. Якубке, Х. Ешкайт. Глава 3.5 Физико-химические свойства // Аминокислоты, пептиды, белки. —
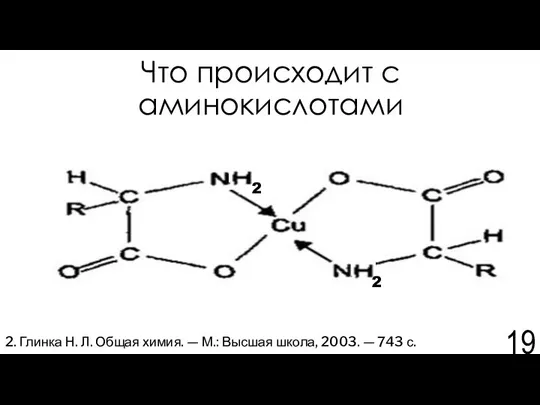
- 19. Что происходит с аминокислотами 2. Глинка Н. Л. Общая химия. — М.: Высшая школа, 2003. —
- 20. Методика экспериментальной проверки Часть 1. Создание исследуемого раствора создать в стеклянной или эмалированной посуде модельную смесь
- 21. Методика экспериментальной проверки Часть 2. Исследование полученного раствора измерение электропроводности и сравнение с электропроводностью исходной модельной
- 22. Методика экспериментальной проверки Славгородская М.В., Имсырова А.Ф., Сячинова Н.В. – Аналитическая химия. Методические указания к лабораторно-практическим
- 23. Методика экспериментальной проверки Славгородская М.В., Имсырова А.Ф., Сячинова Н.В. – Аналитическая химия. Методические указания к лабораторно-практическим
- 24. Экспериментальная часть решения задачи
- 25. ЕЁ НЕТ! Почему? Потому что она нецелесообразна! по данным модельным смесям сделать КОЛИЧЕСТВЕННЫЕ выводы о протекающих
- 26. Выводы: I. При приготовлении и хранении щей протекают следующие процессы: 1. окисление металла и переход его
- 27. Выводы: II. Предложены две модельные смеси III. Предложена методика экспериментальной проверки IV. Обоснована нецелесообразность проведения самого
- 28. Березов Т.Т., Коровкин Б.Ф. Классификация аминокислот // Биологическая химия. — 3-е изд., перераб. и доп..-М.: Медицина,
- 29. Спасибо за внимание!
- 30. Ограничения (дубль 2) Будем считать это (из условия) – выявленными химическими процессами, а не вредность приготовления
- 31. пусть жидкость человек получает только из щей. В сутки необходимо потреблять 2 л. предположим, что количество
- 32. ПДК (алюминий) = 0,5 мг/л ПДК (железо) = 0,1 мг/л ПДК (медь) = 1 мг/л ПДК
- 33. Гидролиз жиров С3H5(COO)3-R + 3H2O ↔ C3H5(OH)3 + 3RCOOH
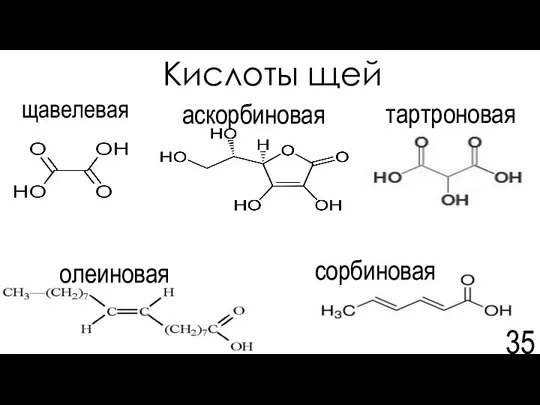
- 34. Кислоты щей Новый справочник химика и технолога.Основные свойства неорганических, органических и элементорганических соединений. СПб.: АНО НПО
- 35. Кислоты щей щавелевая аскорбиновая сорбиновая олеиновая тартроновая
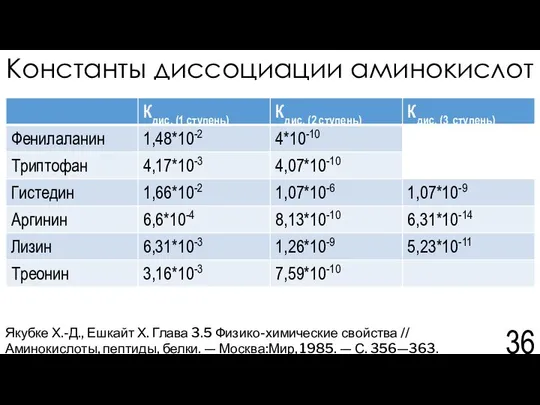
- 36. Константы диссоциации аминокислот Якубке Х.-Д., Ешкайт Х. Глава 3.5 Физико-химические свойства // Аминокислоты, пептиды, белки. —
- 37. Константы диссоциации аминокислот Якубке Х.-Д., Ешкайт Х. Глава 3.5 Физико-химические свойства // Аминокислоты, пептиды, белки. —
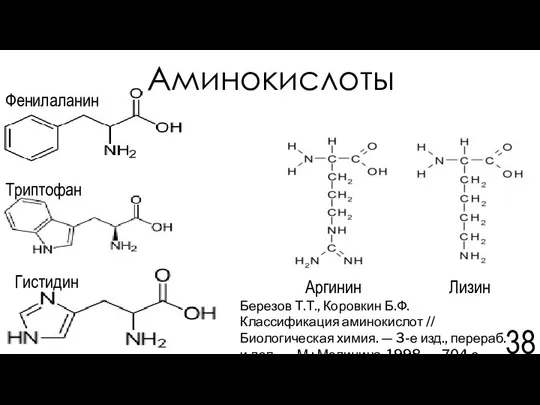
- 38. Аминокислоты Фенилаланин Лизин Аргинин Гистидин Триптофан Березов Т.Т., Коровкин Б.Ф. Классификация аминокислот // Биологическая химия. —
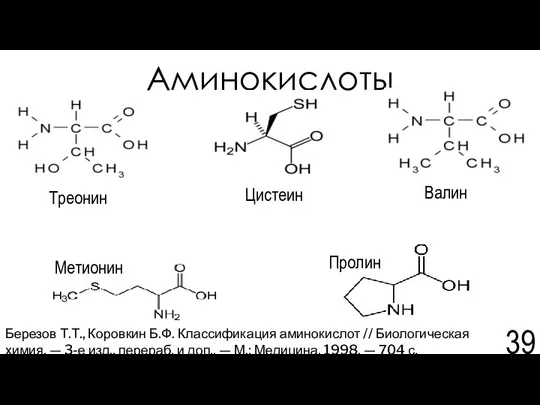
- 39. Аминокислоты Цистеин Валин Пролин Метионин Треонин Березов Т.Т., Коровкин Б.Ф. Классификация аминокислот // Биологическая химия. —
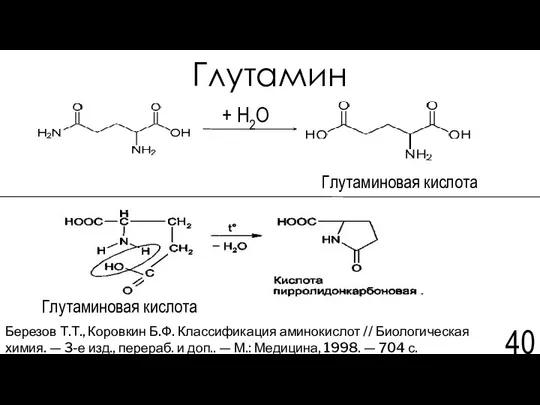
- 40. Глутамин Глутаминовая кислота Березов Т.Т., Коровкин Б.Ф. Классификация аминокислот // Биологическая химия. — 3-е изд., перераб.
- 41. Пространственное строение комплексов Глинка Н. Л. Общая химия. — М.: Высшая школа, 2003. — 743 с.
- 42. Процесс №3. Образование координационных соединений Координационные числа металлов: Al: 4; 6; Zn: 4; 6 Sn: 4;
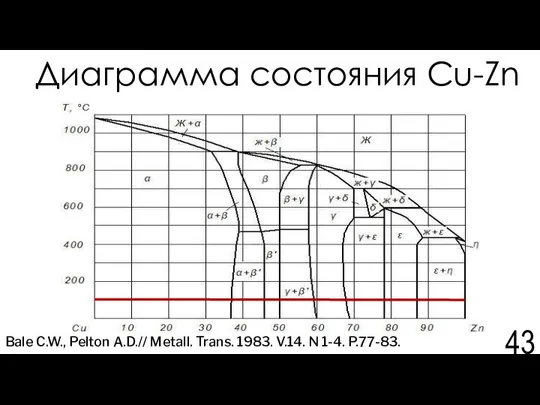
- 43. Диаграмма состояния Cu-Zn Bale C.W., Pelton A.D.// Metall. Trans. 1983. V.14. N 1-4. P.77-83.
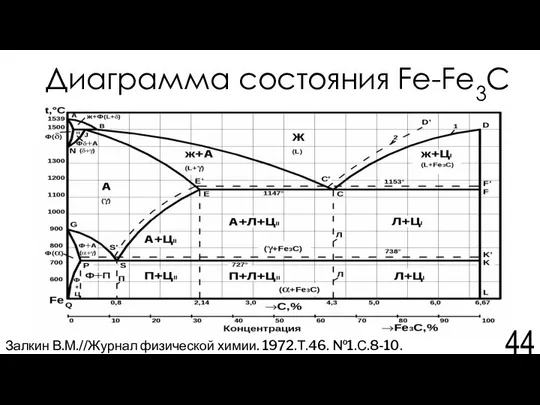
- 44. Диаграмма состояния Fe-Fe3C Залкин В.М.//Журнал физической химии. 1972.Т.46. №1.С.8-10.
- 45. Clark J.B., Richter P.W. //igh Ptessure Science and Technology:Proc.7-th Int. AIRAPT Conf., Le Creusot. 1979, Oxford:
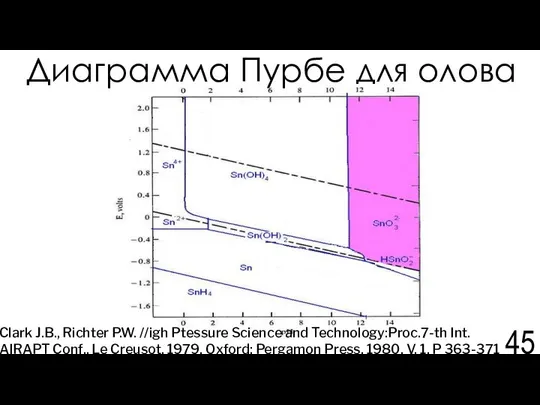
- 46. Диаграмма Пурбе для алюминия Залкин В.М.//Журнал физической химии. 1972.Т.46. №1.С.8-10.
- 48. Скачать презентацию












![Модельная смесь №2 [Ме+n(орг.л-ды)-k2n]n-2kn Н+ Которая представляет собой водный раствор слабой кислоты с органическими лигандами](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1392702/slide-15.jpg)




















 Ароматические углеводороды
Ароматические углеводороды Основные понятия и определения. Хроматография
Основные понятия и определения. Хроматография Электрохимические производства
Электрохимические производства Лекарственные средства, производные пиридина и пиперазина. (Тема 3)
Лекарственные средства, производные пиридина и пиперазина. (Тема 3) Гидролиз. Виды гидролиза
Гидролиз. Виды гидролиза Химиялық байланыстың табиғаты
Химиялық байланыстың табиғаты Оксид металлов
Оксид металлов Галогены. Способы получения, применение
Галогены. Способы получения, применение Камни и Козерог
Камни и Козерог Понятие об адсорбционной влаге
Понятие об адсорбционной влаге Фосфор Материал для повторения и подготовки к ГИА Учитель химии МОУ «Гимназия №1» г. Саратов Шишкина И.Ю.
Фосфор Материал для повторения и подготовки к ГИА Учитель химии МОУ «Гимназия №1» г. Саратов Шишкина И.Ю.  Enantioselective Total Synthesis
Enantioselective Total Synthesis Производство самодельного мыла: технология, экономика
Производство самодельного мыла: технология, экономика Чипсы: Вред или польза?. 9 класс
Чипсы: Вред или польза?. 9 класс Кислоты и классы химических веществ. 8 класс
Кислоты и классы химических веществ. 8 класс Тема 1.4 Закономерности химических процессов. Основы химической термодинамики и биоэнергетики
Тема 1.4 Закономерности химических процессов. Основы химической термодинамики и биоэнергетики Сырьевая база парфюмерно-косметической промышленности
Сырьевая база парфюмерно-косметической промышленности Возбудители колибактериоза
Возбудители колибактериоза Материаловедение и технология конструкционных материалов
Материаловедение и технология конструкционных материалов Предельные углеводороды. Метан как представитель предельных углеводородов
Предельные углеводороды. Метан как представитель предельных углеводородов Качественный анализ (часть 1)
Качественный анализ (часть 1) Соляная кислота (HCI)
Соляная кислота (HCI) Пестицидтердің жіктелуі
Пестицидтердің жіктелуі Органические вещества: липиды
Органические вещества: липиды Соли серной кислоты
Соли серной кислоты Общая характеристика металлов. Металлическая связь
Общая характеристика металлов. Металлическая связь Химическая связь 11 класс
Химическая связь 11 класс  Неорганические соединения серы
Неорганические соединения серы