Содержание
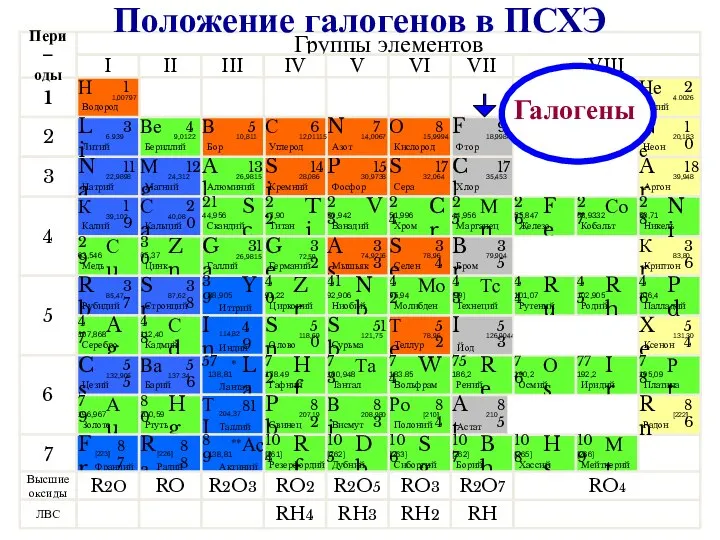
- 2. Галогены Положение галогенов в ПСХЭ
- 3. К элементам VII группы, главной подгруппы относятся фтор F, хлор Cl, бром Br, иод I, астат
- 4. В свободном виде не встречаются
- 5. Галит NaCl
- 7. Нахождение галогенов в природе Апатит 3Ca(PO4 ) 2*CaF2
- 8. AgI (йодаргирит)- примесь к другим минералам
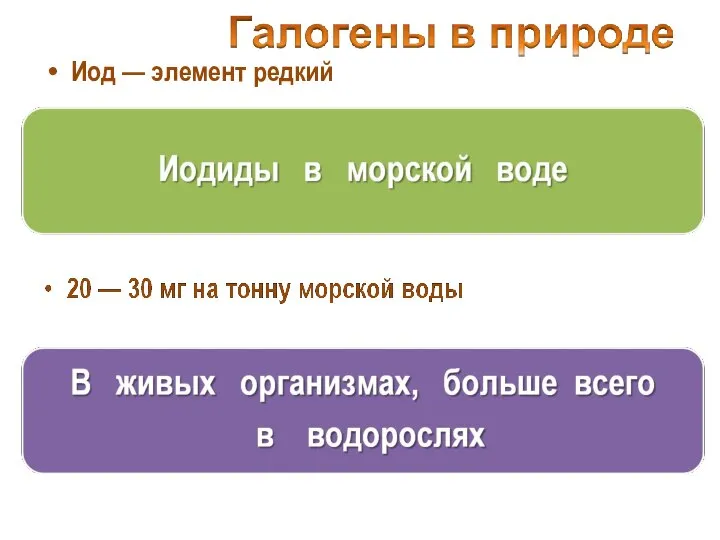
- 9. Иод — элемент редкий
- 10. 5 кг на тонну высушенной морской капусты (ламинарии)
- 13. Галогены
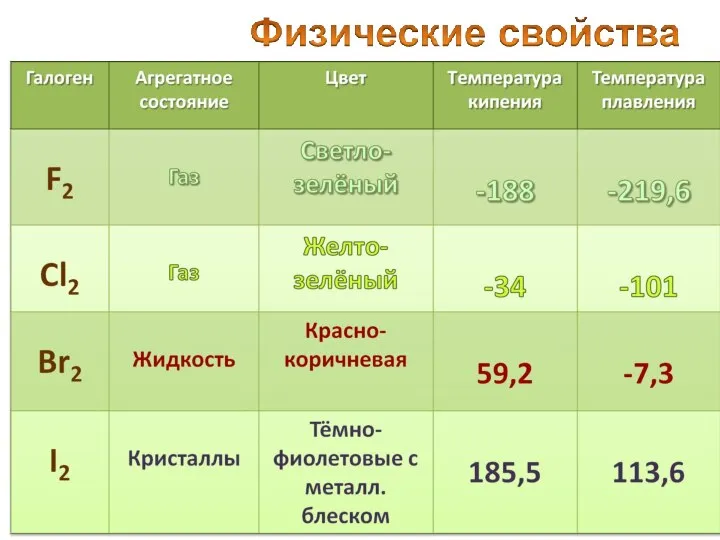
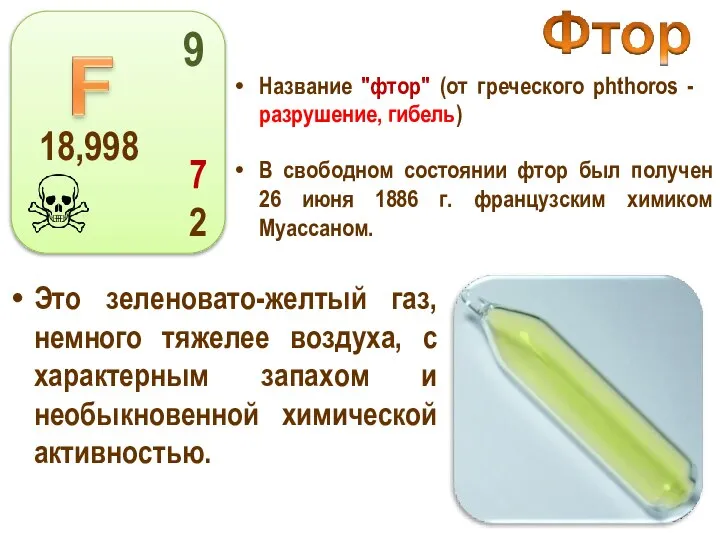
- 14. Название "фтор" (от греческого phthoros - разрушение, гибель) Это зеленовато-желтый газ, немного тяжелее воздуха, с характерным
- 15. Хлор был открыт шведским химиком Карлом Шееле в 1774 г. Газ желто-зеленого цвета с резким запахом,
- 16. от греч. bromos – зловоние единственный неметалл, жидкий при комнатной температуре 79Вr (50,56%) 81Вr (49,44%) пары
- 17. от греч. iodes—имеющий фиалковый цвет в парообразное состояние переходит при комнатной t°, не плавясь (сублимация); пары
- 18. Превращение в пары, минуя жидкое состояние
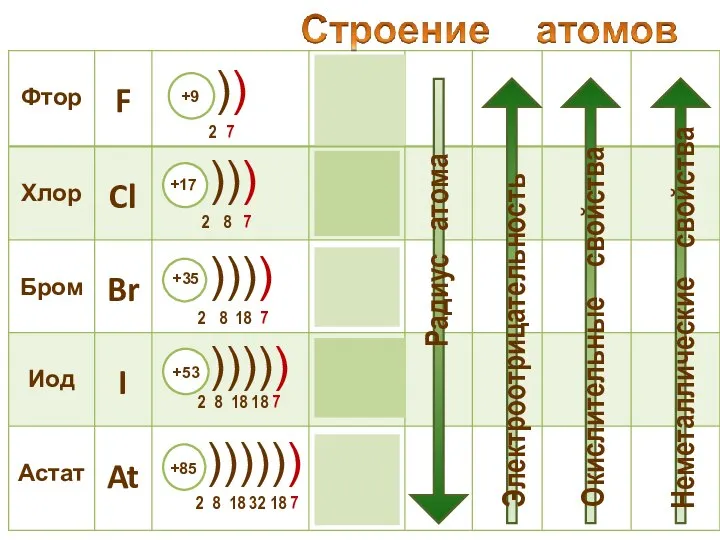
- 19. Молекулы галогенов состоят из двух атомов. Связь – ковалентная неполярная
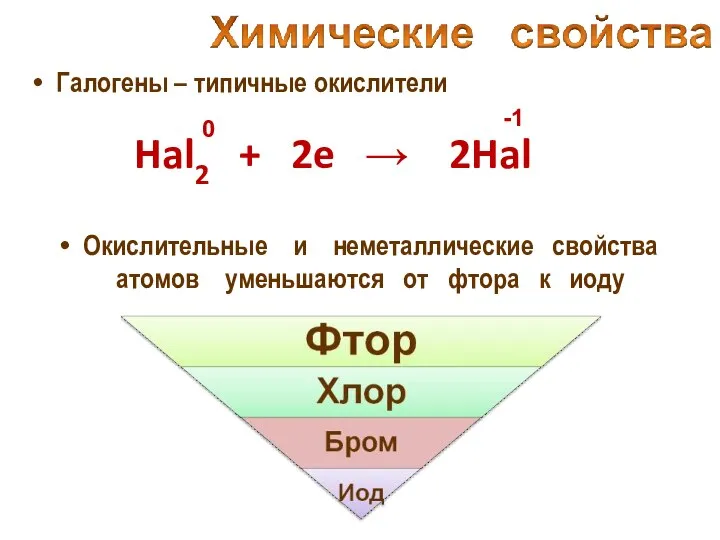
- 20. Галогены – типичные окислители Hal2 + 2e → 2Hal -1 Окислительные и неметаллические свойства атомов уменьшаются
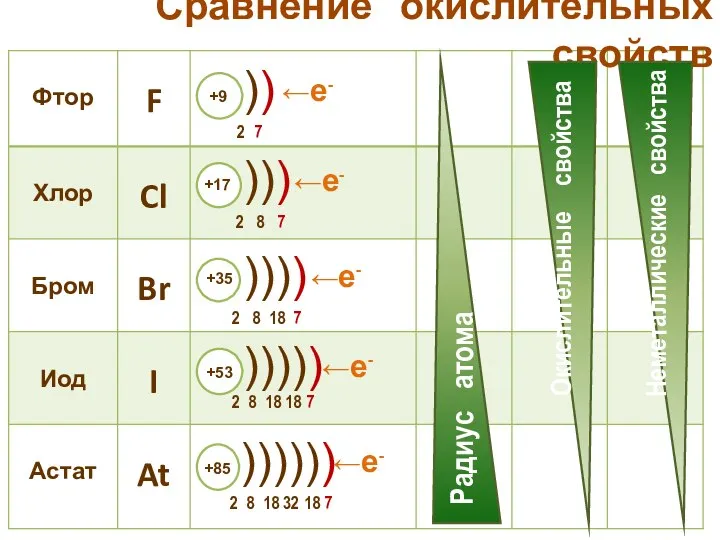
- 21. Сравнение окислительных свойств ←е- ←е- ←е- ←е- ←е-
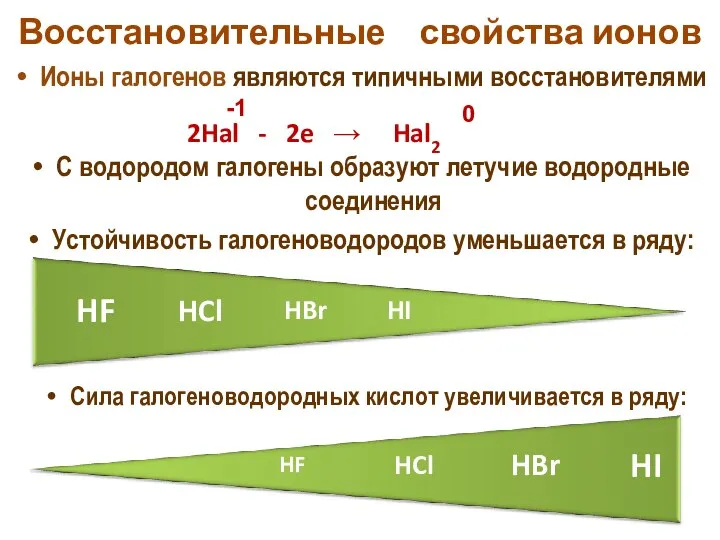
- 22. Восстановительные свойства ионов Ионы галогенов являются типичными восстановителями С водородом галогены образуют летучие водородные соединения Устойчивость
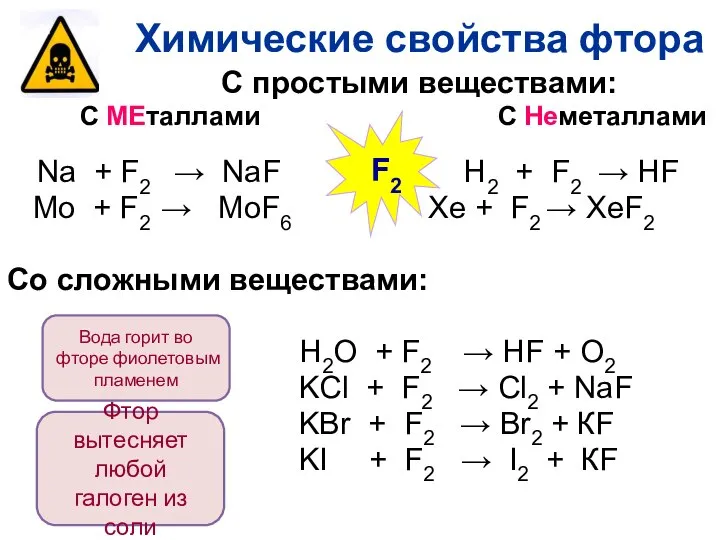
- 23. С простыми веществами: С МЕталлами С Неметаллами Na + F2 → NaF H2 + F2 →
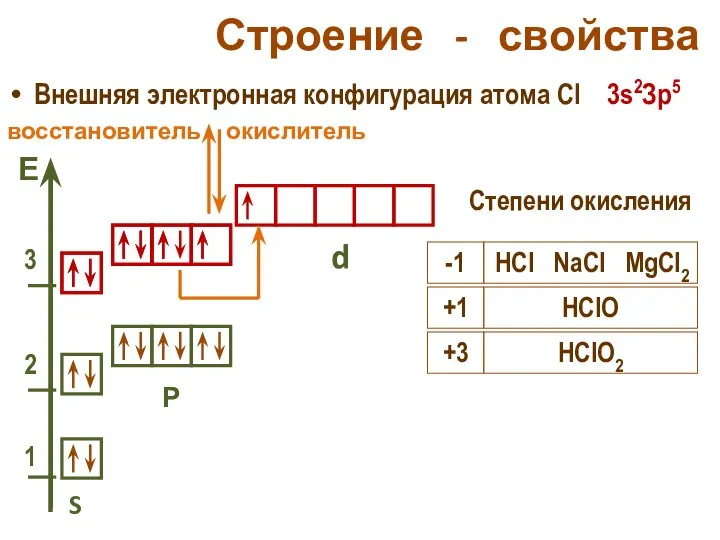
- 24. Строение - свойства Внешняя электронная конфигурация атома Cl 3s2Зр5 S Р d Степени окисления окислитель -1
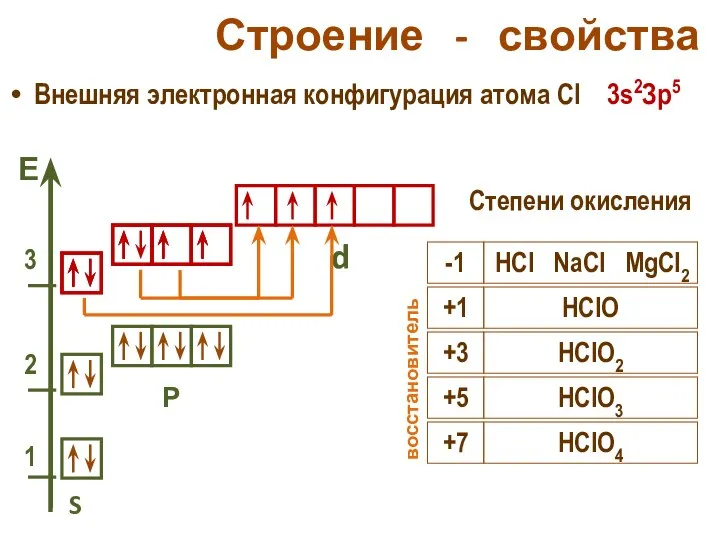
- 25. Строение - свойства Внешняя электронная конфигурация атома Cl 3s2Зр5 S Р d Степени окисления -1 HCl
- 26. 1. Взаимодействие с металлами Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии
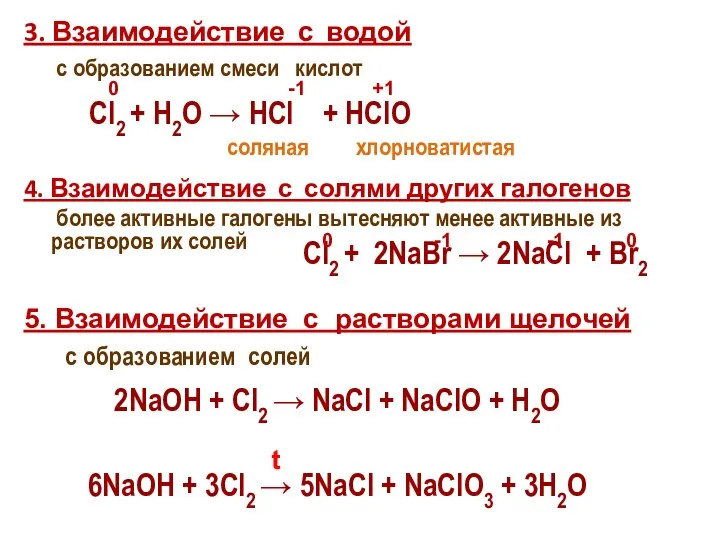
- 27. 3. Взаимодействие с водой с образованием смеси кислот 4. Взаимодействие с солями других галогенов более активные
- 28. В промышленности: электролиз расплава или раствора хлорида натрия В лаборатории: 4 HСl + MnO2 → MnCl2
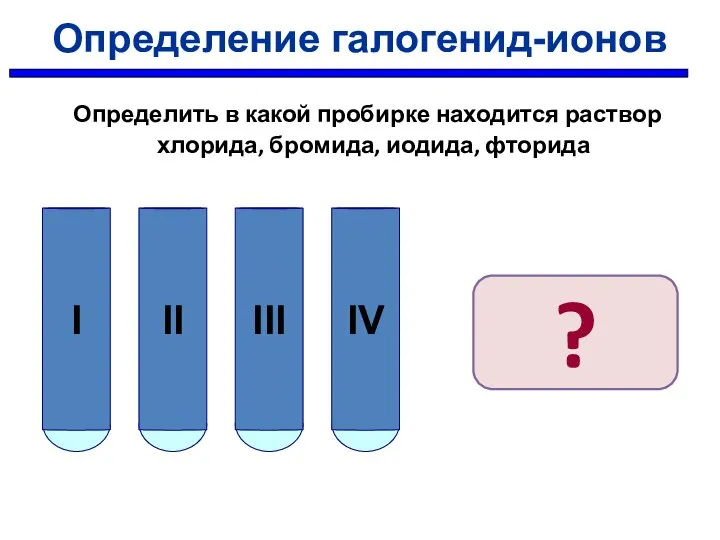
- 29. Определение галогенид-ионов Определить в какой пробирке находится раствор хлорида, бромида, иодида, фторида ?
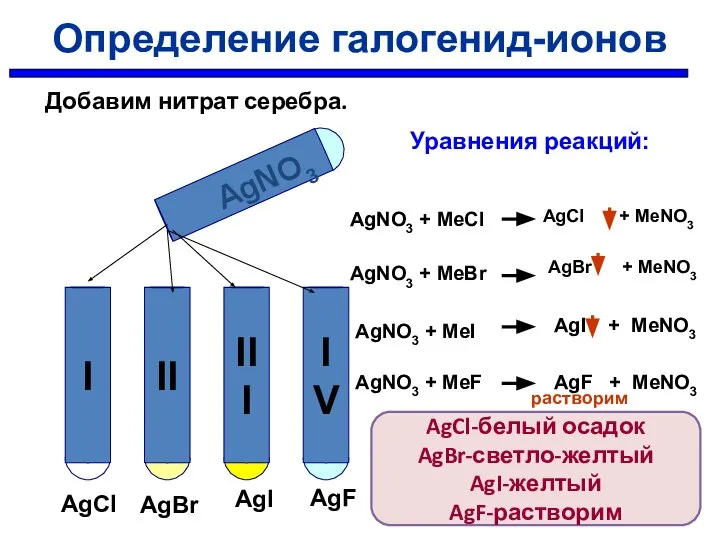
- 30. AgNO3 AgCl AgBr AgI AgF Уравнения реакций: AgNO3 + MeCl AgNO3 + MeBr AgNO3 + MeI
- 31. Хлор хвалился: «Нет мне равных! Галоген я - самый главный. Зря болтать я не люблю: Всё
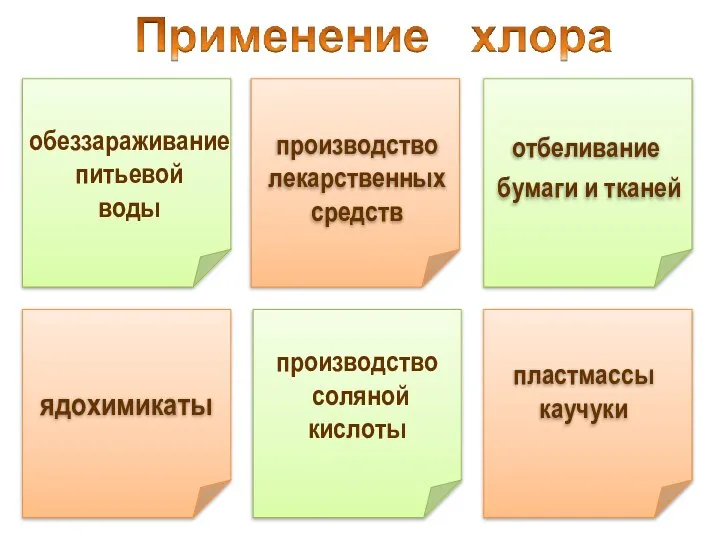
- 32. производство соляной кислоты
- 34. Скачать презентацию
















 Гемоглобин. Структура и свойства молекулы гемоглобина
Гемоглобин. Структура и свойства молекулы гемоглобина Керамика
Керамика Роботу виконав: Желєзний Влад
Роботу виконав: Желєзний Влад  Сполуки неметалічних елементів з гідрогеном. Амоніак та хлороводень
Сполуки неметалічних елементів з гідрогеном. Амоніак та хлороводень Фосфонсірке қыщқылының антипирендік қасиеттерін зерттеу
Фосфонсірке қыщқылының антипирендік қасиеттерін зерттеу Васильева Е.А. – учитель географии МОУ СОШ п. Солидарность Елецкого муниципального района Липецкой области
Васильева Е.А. – учитель географии МОУ СОШ п. Солидарность Елецкого муниципального района Липецкой области Щелочно-земельные металлы
Щелочно-земельные металлы Белки. Строение и свойства
Белки. Строение и свойства Алканы. Получение. Применение
Алканы. Получение. Применение Вивчення особливостей застосування детекторів дорогоцінних каменів та каратомірів
Вивчення особливостей застосування детекторів дорогоцінних каменів та каратомірів С П И Р Т И
С П И Р Т И  Псевдовідкриття хімічних елементів
Псевдовідкриття хімічних елементів Ферменттер. Ферменттердің жалпы қасиеттері. Ферменттердің жіктелуі мен номенклатурасы
Ферменттер. Ферменттердің жалпы қасиеттері. Ферменттердің жіктелуі мен номенклатурасы Chiral carbon
Chiral carbon Білки (протеїни)
Білки (протеїни) Дисперсные наполнители. Пневмогидрокомпрессионное формование. Магнитоимпульсное формование
Дисперсные наполнители. Пневмогидрокомпрессионное формование. Магнитоимпульсное формование А группа
А группа Характеристика элементов VI-В группы. Хром
Характеристика элементов VI-В группы. Хром Biochimie de la salive et des tissus de la cavité buccale
Biochimie de la salive et des tissus de la cavité buccale Презентация по Химии "Исследование содержания аскорбиновой кислоты в плодах яблони" - скачать смотреть
Презентация по Химии "Исследование содержания аскорбиновой кислоты в плодах яблони" - скачать смотреть  Пропитка рубинов и сапфиров
Пропитка рубинов и сапфиров Вдоль по радуге
Вдоль по радуге Химический процесс: энергетика и равновесие
Химический процесс: энергетика и равновесие Алкины
Алкины Охрана окружающей среды от загрязнения сульфуро-содержащими соединениями
Охрана окружающей среды от загрязнения сульфуро-содержащими соединениями Гетерофункциональные соединения, участвующие в процессах жизнедеятельности
Гетерофункциональные соединения, участвующие в процессах жизнедеятельности Химический состав клетки. Вода и ее роль в жизнедеятельности клетки. Минеральные вещества
Химический состав клетки. Вода и ее роль в жизнедеятельности клетки. Минеральные вещества Презентация по Химии "Железо: ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА" - скачать смотреть
Презентация по Химии "Железо: ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА" - скачать смотреть