Содержание
- 2. Азот и его свойства Строение атома азота Строение молекулы азота Физические свойства Химические свойства Получение Применение
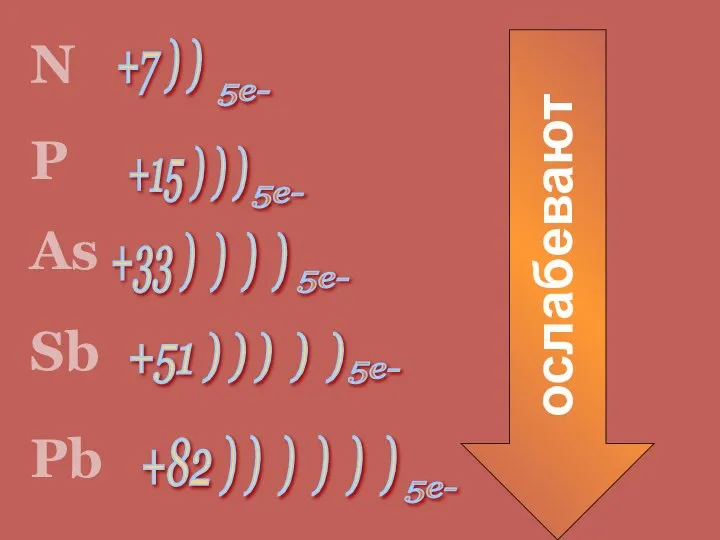
- 3. +7 ) ) +82 ) ) ) ) ) ) +51 ) ) ) ) )
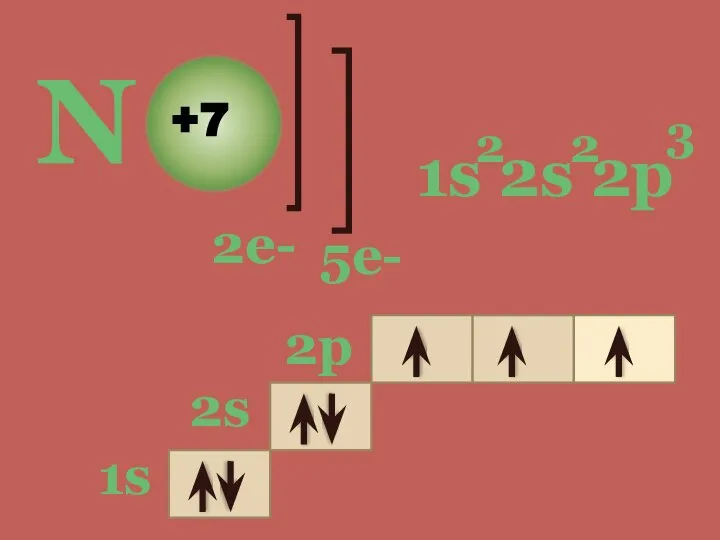
- 4. N +7 2е- 5е- 1s 2s 2p 2 2 3 1s 2s 2p
- 5. Возможные степени окисления 0 +1 +2 +3 +4 +5 -3 N2 N2O3 NO2 N2O5 NH3 NO
- 6. N2 молекулярная формула N N электронная формула структурная формула Ковалентная неполярная связь
- 7. азот - простое вещество , В, Ц, З, М N2 Ткип = - 195 С Тпл
- 8. N2 +6Li = 2Li3N N2 +3H2 ↔ 2NH3+Q Химические свойства аммиак нитрид Fe
- 9. N2 +O2 ↔ 2NO - Q
- 10. получение в лаборатории в промышленности NH4NO2 → N2 + 2H2О t Выделение из сжиженного воздуха
- 11. N2 Жидкий азот в медицине Синтез аммиака Производство удобрений Синтез азотной кислоты Создание инертной среды
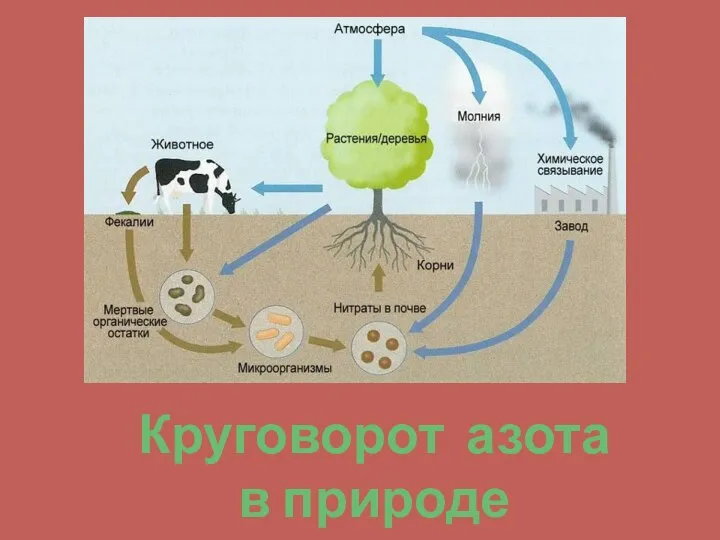
- 12. Круговорот азота в природе
- 13. Тест А1. Сумма протонов, нейтронов, электронов в атоме 14N 1) 7 2) 14 3) 28 4)
- 14. А3. Химическая связь в молекуле азота 1) ионная 2) ковалентная полярная 3) ковалентная неполярная 4) водородная
- 15. А5. Сумма коэффициентов в уравнении реакции между азотом и водородом равна 1) 2 2) 3 4)
- 16. А7. Азот является восстановителем в реакции 1) N2 + 3H2 = 2NH3 2) N2 + O2
- 18. Скачать презентацию












 Обзор электродных процессов
Обзор электродных процессов Дисперсные наполнители. Пневмогидрокомпрессионное формование. Магнитоимпульсное формование
Дисперсные наполнители. Пневмогидрокомпрессионное формование. Магнитоимпульсное формование Особливості горіння дисперсних систем
Особливості горіння дисперсних систем Химические процессы в атмосфере. Загрязнение атмосферы. Причины и последствия
Химические процессы в атмосфере. Загрязнение атмосферы. Причины и последствия Обмен липидов
Обмен липидов Оксигеновмісні сполуки Підготувала учениця 11-Б класу Нововолинського ліцею-інтернату Волинської обласної ради Федина Вале
Оксигеновмісні сполуки Підготувала учениця 11-Б класу Нововолинського ліцею-інтернату Волинської обласної ради Федина Вале Коррозия, как источник загрязнения окружающей среды
Коррозия, как источник загрязнения окружающей среды Лекарственное растительное сырье, содержащее жиры
Лекарственное растительное сырье, содержащее жиры Классификация химических реакций в органической и неорганической химии
Классификация химических реакций в органической и неорганической химии Аминокислоты и белки
Аминокислоты и белки Ароматичні аміни
Ароматичні аміни Антибиотики. Действие антибиотиков
Антибиотики. Действие антибиотиков Тест по теме «КИСЛОТЫ»
Тест по теме «КИСЛОТЫ» Водородный показатель
Водородный показатель Аттестационная работа. Проектно - исследовательская технология, как способ формирования УУД по химии
Аттестационная работа. Проектно - исследовательская технология, как способ формирования УУД по химии Химические превращения веществ
Химические превращения веществ Заттардың сұйық пен газдағы қозғалуы мысалында диффузия үдерісін зерттеу
Заттардың сұйық пен газдағы қозғалуы мысалында диффузия үдерісін зерттеу Микроорганизмы и важнейшие химические факторы среды обитания
Микроорганизмы и важнейшие химические факторы среды обитания Химические свойства
Химические свойства Презентация по Химии "Косметичні засоби" - скачать смотреть бесплатно
Презентация по Химии "Косметичні засоби" - скачать смотреть бесплатно Теория и практика решения задач высокого уровня сложности в процессе обучения химии
Теория и практика решения задач высокого уровня сложности в процессе обучения химии Строение и функция белков
Строение и функция белков Роль хімічних знань у пізнанні природи
Роль хімічних знань у пізнанні природи Необычные свойства металлов
Необычные свойства металлов Химические свойства металлов. (9 класс)
Химические свойства металлов. (9 класс) Физические и химические свойства алканов
Физические и химические свойства алканов Биохимия старения. (Лекция 24)
Биохимия старения. (Лекция 24) Теория гибридизации. (Лекция 3)
Теория гибридизации. (Лекция 3)