Содержание
- 2. Какой газообразный алкан имеет при нормальных условиях плотность 1,339 г/л? 2.Алкан имеет плотность паров по воздуху
- 3. Найдите молекулярную формулу УВ, содержание углерода в котором составляет 81,82%, плотность вещества (н.у.) равна 1,96 г/л
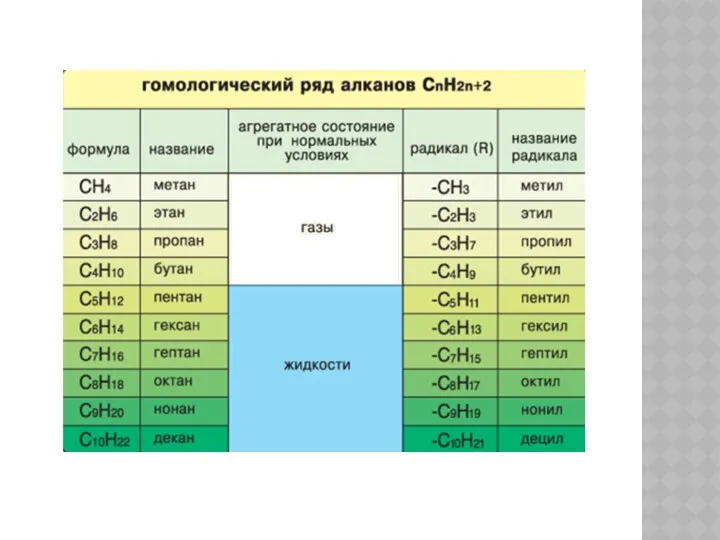
- 4. ФИЗИЧЕСКИЕ СВОЙСТВА АЛКАНОВ
- 5. ФИЗИЧЕСКИЕ СВОЙСТВА АЛКАНОВ. НАХОЖДЕНИЕ В ПРИРОДЕ. МЕТАН – газ, без цвета и запаха, в 2 раза
- 7. ЭТАН, ПРОПАН И БУТАН входят в состав природного и попутного нефтяного газов. АЛКАНЫ содержатся в нефти.
- 8. ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВ Реакции замещения – это реакции, идущие с разрывом С_Н связей.
- 9. ГАЛОГЕНИРОВАНИЕ АЛКАНОВ СН4 + Cl2 →hv CH3Cl + HCl Хлорметан, или Хлористый метил СН3 Cl –
- 10. ГАЛОГЕНИРОВАНИЕ АЛКАНОВ СН3Cl + Cl2 hv CH2Cl2 + HCl Дихлорметан СН2 Cl2 – применяется как растворитель,
- 11. ГАЛОГЕНИРОВАНИЕ АЛКАНОВ СН2Cl2 + Cl2 hv CHCl3 + HCl Трихлорметан или хлороформ СН Cl3 – хлороформ,
- 12. ГАЛОГЕНИРОВАНИЕ АЛКАНОВ СНCl3 + Cl2 hv CCl4 + HCl Тетрахлорметан, (хлористый углерод) С Cl4 - применяется
- 13. НИТРОВАНИЕ. При нагревании алканов до 140°С с разбавленной (10%-ной) азотной кислотой под давлением осуществляется реакция нитрования
- 14. Термические превращения Давыдова Н.Г.
- 15. ИЗОМЕРИЗАЦИЯ Под влиянием катализаторов при нагревании углеводороды нормального строения подвергаются изомеризации - перестройке углеродного скелета с
- 16. РЕАКЦИИ РАЗЛОЖЕНИЯ При нагревании до температуры выше 500° в молекулах алканов происходит разрыв связей между атомами
- 17. ПИРОЛИЗ При увеличении температуры можно достичь такой степени протекания реакции, при которой органические вещества – углеводороды
- 18. ДЕГИДРИРОВАНИЕ При пропускании нагретого алкана над платиновым или никелевым катализатором происходит отщепление молекулы водорода. Этот процесс
- 19. КОНВЕРСИЯ. СН4+Н2O CO+3H2 Так называют взаимодействия алканов, из которых чаще всего используют природный газ с парами
- 20. ПОЛНОЕ ОКИСЛЕНИЕ Горение При поджигании на воздухе алканы горят, превращаясь в двуокись углерода и воду и
- 21. СПОСОБЫ ПОЛУЧЕНИЯ Гидролиз карбида алюминия Синтез Вюрца Реакция Дюма Синтез Кольбе
- 23. Скачать презентацию



















 Предельные одноатомные спирты
Предельные одноатомные спирты Казанская химическая школа
Казанская химическая школа Схема катаболизма углеродного скилета аминокислот
Схема катаболизма углеродного скилета аминокислот Метаморфогенная серия. Группа регионального метаморфизма
Метаморфогенная серия. Группа регионального метаморфизма Хлороводород и соляная кислота
Хлороводород и соляная кислота Методика преподавания химии
Методика преподавания химии Гетерофункциональные органические соединения и их производные – метаболиты и биорегуляторы
Гетерофункциональные органические соединения и их производные – метаболиты и биорегуляторы Производство фенолформальдегидной смолы
Производство фенолформальдегидной смолы Валентность химических элементов
Валентность химических элементов Комплексные соединения
Комплексные соединения Галогены. История открытия галогенов
Галогены. История открытия галогенов Производство серной кислоты контактным способом
Производство серной кислоты контактным способом Мило. Синтетичні миючі засоби.
Мило. Синтетичні миючі засоби.  Углеводы (особенности строения, реакционной способности и методы синтеза альдегидо- и кетоспиртов)
Углеводы (особенности строения, реакционной способности и методы синтеза альдегидо- и кетоспиртов) Молекула Виконала учениці 10-В Висоцька Ірина і Замора Карина
Молекула Виконала учениці 10-В Висоцька Ірина і Замора Карина  Solutions. Acid–base equilibrium in biological systems
Solutions. Acid–base equilibrium in biological systems Химия сверхкритических жидкостей
Химия сверхкритических жидкостей ГИА. Вопрос 10. Химические свойства оксидов: основных, амфотерных, кислотных
ГИА. Вопрос 10. Химические свойства оксидов: основных, амфотерных, кислотных Классификация неорганических веществ. Оксиды и основания
Классификация неорганических веществ. Оксиды и основания Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Решение экспериментальных задач по теме "Подгруппы азота и углерода"
Решение экспериментальных задач по теме "Подгруппы азота и углерода" Агрегатные состояния воды
Агрегатные состояния воды Переработка нефти. (10 класс)
Переработка нефти. (10 класс) Обмен углеводов
Обмен углеводов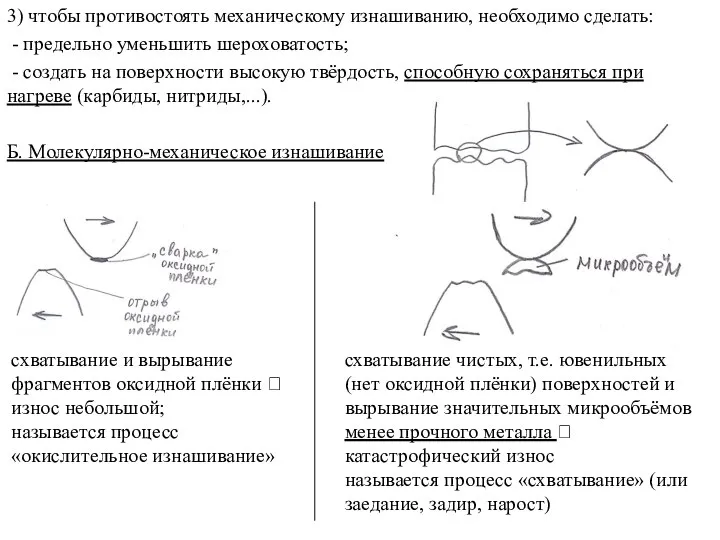 Молекулярно-механическое изнашивание
Молекулярно-механическое изнашивание Ammonia and amines
Ammonia and amines Бериллий, магний, щелочноземельные металлы
Бериллий, магний, щелочноземельные металлы Задача №5. Свинцовый водопровод. Команда «Карбораны»
Задача №5. Свинцовый водопровод. Команда «Карбораны»