Содержание
- 2. Общая характеристика кремния по положению в периодической системе Порядковый номер – 14, заряд ядра +14, протонов
- 3. Строение атома кремния Е Е Si +14 2e 8e 4e 1s 2s 2p 3s 3p 2
- 4. До завершения внешнего уровня кремнию не хватает 4 электронов. В соединениях может проявлять степени окисления +4,
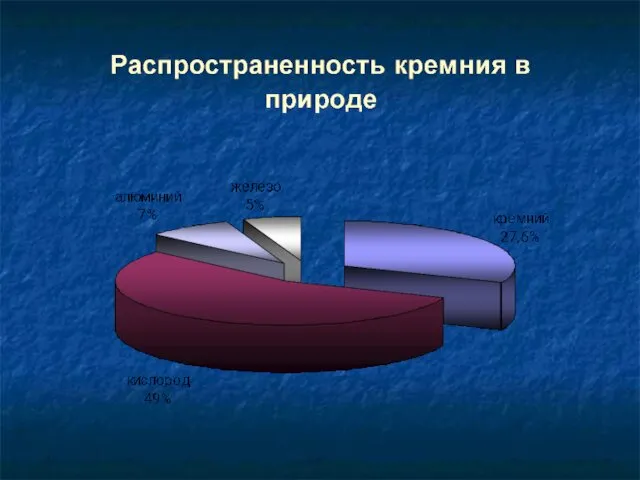
- 6. Кремний в природе В свободном виде не встречается. Встречается, преимущественно, в виде диоксида кремния (SiO2), другое
- 7. Один из типов природных соединений кремния – силикаты. Среди них наиболее распространены алюмосиликаты. К алюмосиликатам относятся
- 8. Значение для живых организмов Важнейшее соединение кремния – оксид SiO2 необходим для жизни растений и животных.
- 9. История открытия кремния Кремний был открыт в 1811 году Гей – Люссаком и Тенаром, но он
- 10. Получение кремния В лабораториях кремний получают, восстанавливая оксид кремния SiO2 магнием. SiO2 + 2Mg = 2MgO
- 11. Кремний – простое вещество В реакциях выступает в роли окислителя : В этом случае он взаимодействует
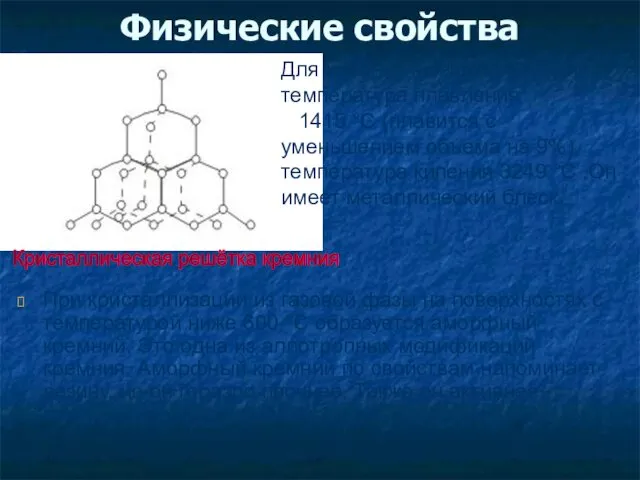
- 12. Физические свойства При кристаллизации из газовой фазы на поверхностях с температурой ниже 600 °С образуется аморфный
- 13. Оксид кремния (IV) Оксид кремния IV – кислотный оксид, отличается от других кислотных оксидов тем, что
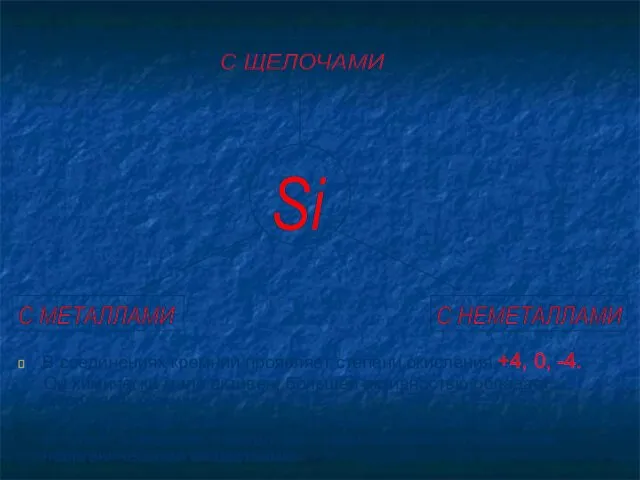
- 14. В соединениях кремний проявляет степени окисления +4, 0, -4. Он химически мало активен, большей активностью обладает
- 15. Взаимодействие с металлами Кремний растворим в расплавах металлов, причём с некоторыми из них ( Zn, Al,
- 16. Кремний взаимодействует с неметаллами, которые более электроотрицательны, и с галогенами. Si + O2 = SiO2 Si0
- 17. Со щелочами взаимодействует при малых количествах ионов ОН – (Возможен гидролиз стекла при хранении щелочей в
- 18. СИЛИЦИДЫ Твёрдые вещества неустойчивые по отношению к воде и растворам кислот, под действием которых необратимо гидролизуют
- 19. Силикаты – соли кремниевой кислоты Силикаты можно получить сплавлением диоксида кремния с оксидами металлов или с
- 20. Кремниевая кислота Действием на силикаты сильными кислотами(HNO3 , H2SO4) получают кремниевую кислоту H2SiO3 . Она очень
- 21. ПРИМЕНЕНИЕ Кремний применяют для полупроводниковых материалов, а также для кислотоупорных сплавов. Из расплавленного кварца делают химическую
- 22. При сплавлении кварцевого песка с углём при высоких температурах образуется карбид кремния SiC ,который по твёрдости
- 23. Силикатная промышленность Силикатная промышленность – отрасль промышленности, занимающаяся переработкой природных соединений кремния. Область применения кремния очень
- 24. Фарфор – керамический материал, состоящий из каолина, обычной глины, кварца и полевого шпата. Фарфор белого цвета,
- 26. Скачать презентацию




















 Алексей Евграфович Фаворский и его вклад в победу СССР.
Алексей Евграфович Фаворский и его вклад в победу СССР. Алкены. Пропилен
Алкены. Пропилен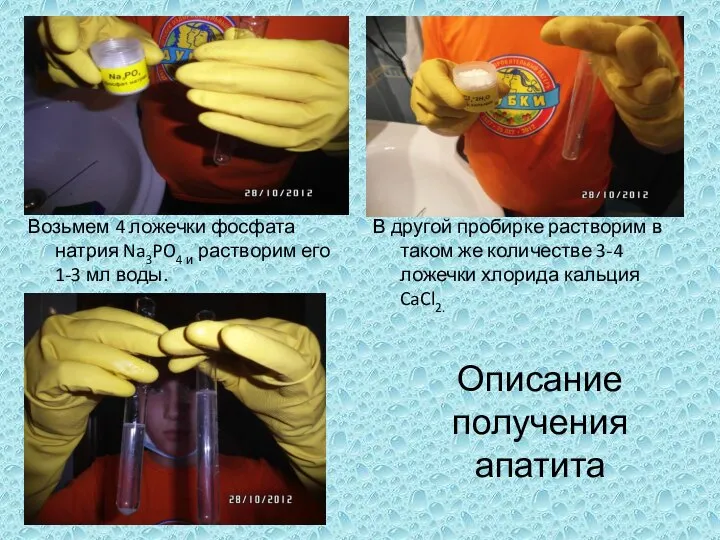 Возьмем 4 ложечки фосфата натрия Na3PO4 и растворим его 1-3 мл воды.
Возьмем 4 ложечки фосфата натрия Na3PO4 и растворим его 1-3 мл воды. Сера, ее физические и химические свойства
Сера, ее физические и химические свойства Оцтова кислота
Оцтова кислота Основные типы задач. Приготовление растворов
Основные типы задач. Приготовление растворов Тесты по неорганической химии
Тесты по неорганической химии Обобщение сведений о важнейших классах неорганических соединений
Обобщение сведений о важнейших классах неорганических соединений Щелочные металлы
Щелочные металлы Роль витаминов в обмене веществ
Роль витаминов в обмене веществ Повітря. Основні забруднювачі: теплоенергетика, кольорова та чорна металургія, використання фреонів, підприємства будматеріалі
Повітря. Основні забруднювачі: теплоенергетика, кольорова та чорна металургія, використання фреонів, підприємства будматеріалі Основы химической термодинамики. Термохимические расчеты
Основы химической термодинамики. Термохимические расчеты Фосфонсірке қыщқылының антипирендік қасиеттерін зерттеу
Фосфонсірке қыщқылының антипирендік қасиеттерін зерттеу Серная кислота. (9 класс)
Серная кислота. (9 класс) Использование Диофантовых уравнений при решении задач в математике и химии
Использование Диофантовых уравнений при решении задач в математике и химии Металлы побочных подгрупп. Марганец. Хром. (Лекция 15)
Металлы побочных подгрупп. Марганец. Хром. (Лекция 15) Аттестационная работа. Методическая разработка занятия клуба «Я – исследователь» по теме «Волшебное вещество ‒ соль»
Аттестационная работа. Методическая разработка занятия клуба «Я – исследователь» по теме «Волшебное вещество ‒ соль» Углерод и его соединения Лекция.(§29 -30, с.172 -178). Цель: Какие соединения образует углерод? Какие свойства, связанные со строением атома углерода, характерны для углерода и его соединений? Где находят применение соединения углерода?
Углерод и его соединения Лекция.(§29 -30, с.172 -178). Цель: Какие соединения образует углерод? Какие свойства, связанные со строением атома углерода, характерны для углерода и его соединений? Где находят применение соединения углерода? Химические средства защиты растений
Химические средства защиты растений Алюминий. Строение и свойства атома
Алюминий. Строение и свойства атома ZnS и ZnSe как оптические материалы,люминофоры, лазерные матрицы
ZnS и ZnSe как оптические материалы,люминофоры, лазерные матрицы Формування мотивації до самостійної пізнавальної діяльності учнів на уроках хімії
Формування мотивації до самостійної пізнавальної діяльності учнів на уроках хімії Откуда берутся кристаллы
Откуда берутся кристаллы Единый государственный экзамен. Химия 2021. ЕГЭ. Задание 5
Единый государственный экзамен. Химия 2021. ЕГЭ. Задание 5 Методика проведения исследовательской части работы по химии и экологии учитель химии и биологии высшей
Методика проведения исследовательской части работы по химии и экологии учитель химии и биологии высшей Органические и неорганические вещества. Нуклеиновые кислоты
Органические и неорганические вещества. Нуклеиновые кислоты Истинная и средняя скорости реакции
Истинная и средняя скорости реакции  Почему прокисает молоко?
Почему прокисает молоко?