Содержание
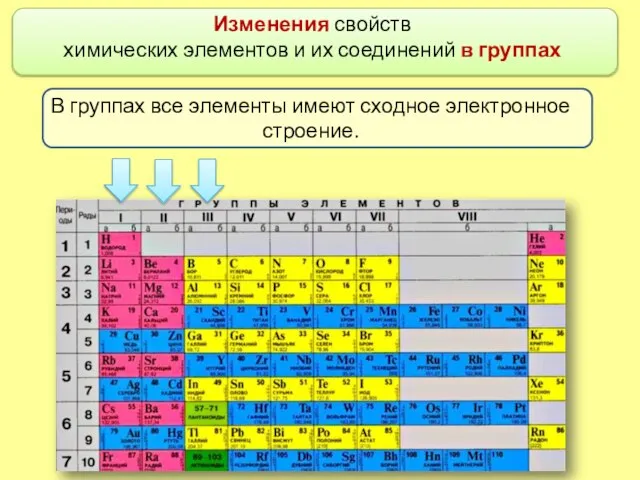
- 2. Изменения свойств химических элементов и их соединений в группах В группах все элементы имеют сходное электронное
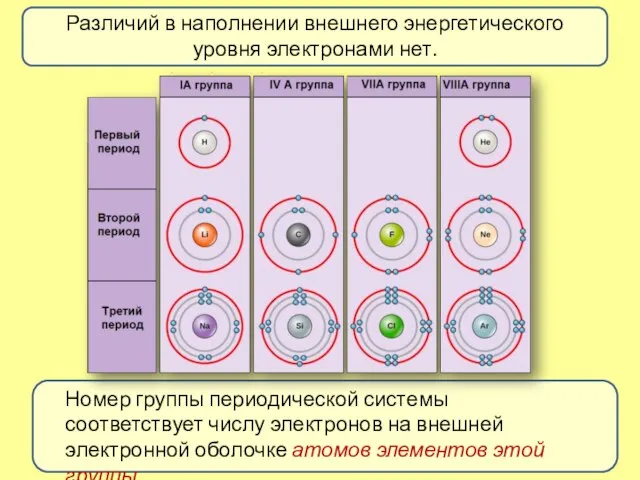
- 3. Различий в наполнении внешнего энергетического уровня электронами нет. Номер группы периодической системы соответствует числу электронов на
- 4. Меняется размер атома - сверху вниз в группе радиусы атомов увеличиваются! Периодический закон Д. И. Менделеева:
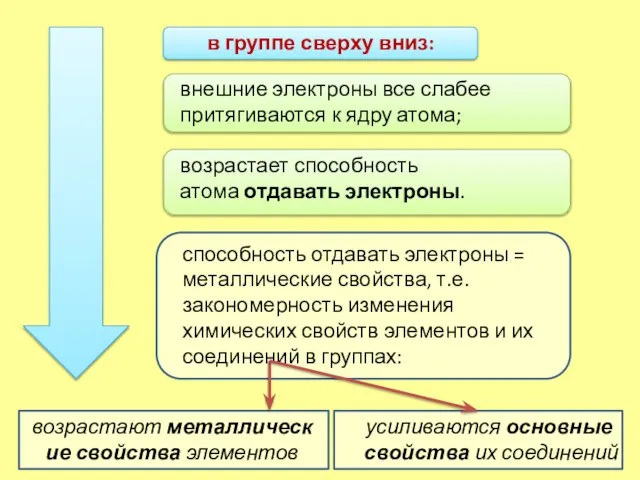
- 5. в группе сверху вниз: усиливаются основные свойства их соединений внешние электроны все слабее притягиваются к ядру
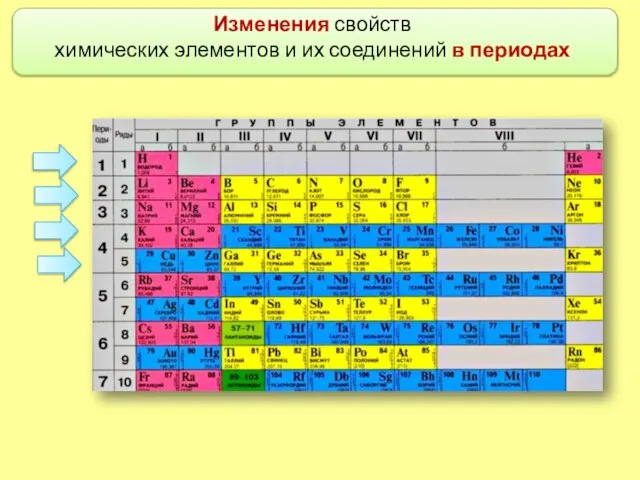
- 6. Изменения свойств химических элементов и их соединений в периодах
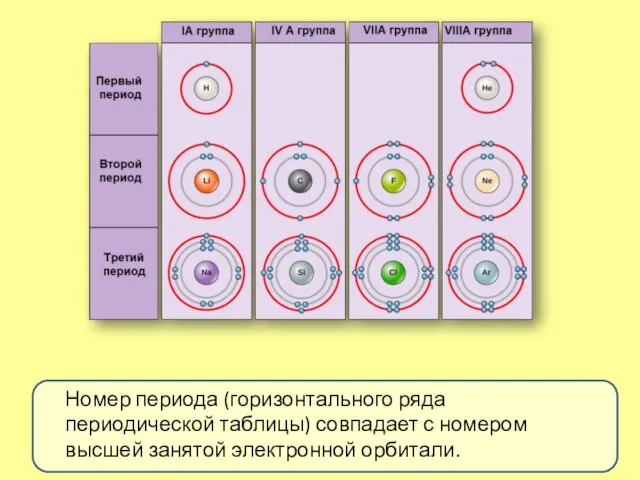
- 7. Номер периода (горизонтального ряда периодической таблицы) совпадает с номером высшей занятой электронной орбитали.
- 8. в периоде слева направо другая картина: усиливаются кислотные свойства их соединений радиусы атомов уменьшаются; количество электронов
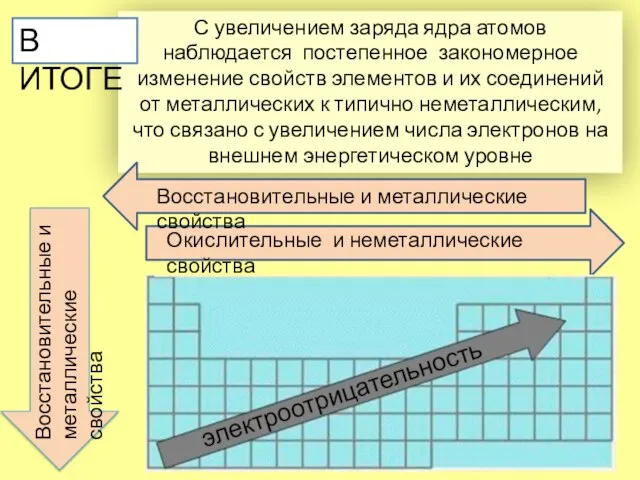
- 10. С увеличением заряда ядра атомов наблюдается постепенное закономерное изменение свойств элементов и их соединений от металлических
- 11. Zn Cr Al Sn Pb Mn Fe Be Есть еще элементы, которые образуют так называемые амфотерные
- 12. В ряду Li → Ве → В → С А усиливаются восстановительные свойства простых веществ Б
- 13. 2. Усиление металлических свойств элементов представлено в ряду: А N → Р → As Б S
- 14. 3. Электронную конфигурацию 1s(2)2s(2)2р(6)3s(2)Зр(6)4S(0) имеет ион А Ca(0) Б Al(3+) В Cs(+) Г K(+)
- 15. 4. В каком ряду кислотность соединений возрастает А Cr(0), Cr(3+), Cr(+6) Б Mn(+6), Mn(+4), Mn(+2) В
- 16. 5. Как изменяются кислотные свойства оксидов хрома в ряду: CrO - Cr2O3 - CrO3 А основной
- 17. 6. Даны элементы: F, O, N, Cl. Какие утверждения верны? А в заданном ряду элементов электроотрицательность
- 18. 7. Наиболее выражены металлические свойства у: А фософра Б азота В рубидия Г водорода
- 19. 8. Только амфотерные оксиды указаны в ряду: А Na2O, ZnO, CuO Б ZnO, Al2O3, Cr2O3 В
- 20. 9. Выберите правильное утверждение: А - в ряду элементов: Na – Si – Cl неметалличность простых
- 22. Скачать презентацию













 ТОМИЛОВА НАТАЛЬЯ ВЛАДИМИРОВНА УЧИТЕЛЬ ХИМИИ И ЕСТЕСТВОЗНАНИЯ МОУ СОШ № 47
ТОМИЛОВА НАТАЛЬЯ ВЛАДИМИРОВНА УЧИТЕЛЬ ХИМИИ И ЕСТЕСТВОЗНАНИЯ МОУ СОШ № 47 Периодический закон Менделеева и периодическая система химических элементов
Периодический закон Менделеева и периодическая система химических элементов  Презентация по Химии "Нафта і нафтопродукти" - скачать смотреть бесплатно
Презентация по Химии "Нафта і нафтопродукти" - скачать смотреть бесплатно Горение водорода
Горение водорода Periodic Table and Trends
Periodic Table and Trends Презентация по Химии "Галогены и их соединения" - скачать смотреть
Презентация по Химии "Галогены и их соединения" - скачать смотреть  Нуклеиновые кислоты Выполнил : Росовский Алексей
Нуклеиновые кислоты Выполнил : Росовский Алексей Получение этилена и опыты с ним. (Практическая работа 2)
Получение этилена и опыты с ним. (Практическая работа 2) Чистые вещества и смеси. 5 класс
Чистые вещества и смеси. 5 класс Презентация Драгоценные камни
Презентация Драгоценные камни  Жирорастворимые витамины. (Лекция 12)
Жирорастворимые витамины. (Лекция 12) Тема: Витамин Е Выполнила: студентка Шагиева А.А. ГОУ СПО ТОМУ № 1 г. Узловая 2012
Тема: Витамин Е Выполнила: студентка Шагиева А.А. ГОУ СПО ТОМУ № 1 г. Узловая 2012 Basic concepts and laws of chemistry
Basic concepts and laws of chemistry Природні гази
Природні гази Василий Баженов
Василий Баженов  Промежуточные фазы
Промежуточные фазы Окислительно-восстановительные реакции (ОВР). ОВР с участием органических веществ. Окисление углеводородов
Окислительно-восстановительные реакции (ОВР). ОВР с участием органических веществ. Окисление углеводородов Периодический закон Д.И. Менделеева
Периодический закон Д.И. Менделеева Сера. Важнейшие соединения серы
Сера. Важнейшие соединения серы Керамика на основе Al2O3
Керамика на основе Al2O3 Азотистая кислота
Азотистая кислота Строение газообразных, жидких и твердых тел
Строение газообразных, жидких и твердых тел Каучук
Каучук Реакции иммунного лизиса. Реакция связывания комплемента (РСК)
Реакции иммунного лизиса. Реакция связывания комплемента (РСК) Золото Aurum
Золото Aurum Элементы VIIА-группы (галогены). Группа самых электроотрицательных элементов
Элементы VIIА-группы (галогены). Группа самых электроотрицательных элементов Крахмал
Крахмал Геология полезных ископаемых
Геология полезных ископаемых